-
 두뇌 인지 기능 조절하는 신경 펩타이드 발견
우리 대학 생명과학과 이승희 교수 연구팀이 두뇌에 존재하는 신경 펩타이드 중 하나인 소마토스타틴(somatostatin)이 두뇌 인지 기능을 높일 수 있음을 밝혔다.
이 교수 연구팀은 특정 가바(뇌세포 대사 기능을 억제 신경 안정 작용을 하는 신경 전달 억제 물질) 분비 신경 세포에서 분비되는 펩타이드 중 하나인 소마토스태틴이 시각 피질의 정보 처리 과정을 조절하고 높일 수 있음을 규명했다. 이번 연구 성과는 치매 등의 뇌 질환에서 인지 능력 회복을 위한 치료제 개발의 계기가 될 것으로 기대된다.
생명과학과 송유향 박사, 황양선 석사, 바이오및뇌공학과 김관수 박사과정, 서울대학교 의과학대학 이형로 박사과정이 공동 1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘사이언스 어드밴시스 (Science Advances)’ 4월 22일 자 온라인판에 게재됐다(논문명 : Somatostatin enhances visual processing and perception by modulating excitatory inputs to the parvalbumin-positive interneurons in V1).
2019년 기준 국내 65세 이상 노인 중 10명 중 1명은 치매 질환을 갖고 있다. 치매는 기억력 손실, 인지 기능 및 운동기능 저하 등의 일상생활 장애를 유발해 그 심각성은 나날이 두드러지고 있다.
이승희 교수 연구팀은 치매의 한 종류인 알츠하이머 질환 환자의 뇌척수액에서 소마토스타틴의 발현율이 현저히 감소했다는 점에 주목해 소마토스타틴에 의한 인지 능력 회복 가능성을 밝히는 연구를 수행했다.
소마토스타틴은 인간을 포함한 포유류의 중추신경계에서 존재한다. 특히 정상적인 포유류의 대뇌 피질에서 소마토스타틴을 발현하는 신경 세포인 가바(GABA, γ-aminobutyric acid)를 신경전달물질로 분비해 흥분성 신경 세포의 활성을 억제함으로써 정보 처리 정도를 조율한다.
그러나 기존 연구는 가바의 효과에만 국한돼, 동시에 분비될 수 있는 신경 펩타이드인 소마토스타틴의 고유한 효과 관련 연구는 부족한 상황이다.
연구팀은 자유롭게 움직이는 실험용 생쥐에서 시각정보 인지 및 식별 능력을 측정할 수 있는 실험 장비를 개발 및 도입했다. 이를 통해 생쥐의 시각피질 또는 뇌척수액에 소마토스타틴을 직접 주입한 후 이를 관찰해 생쥐의 시각정보 인지 능력이 현저히 증가함을 발견했다.
나아가 소마토스타틴의 처리에 따른 생체 내 또는 뇌 절편에서의 신경 세포 간 신경전달 효율의 변화를 측정하고, 해당 신경망을 연속 볼록면 주사전자현미경(SBEM)으로 관찰해 소마토스타틴에 의한 시각인지 기능의 향상이 이루어지는 생체 내 신경 생리적 원리를 규명했다.
이러한 연구 성과는 향후 인간을 비롯한 포유류의 두뇌 인지 기능을 조절 가능할 수 있을 뿐 아니라 퇴행성 뇌 질환 등에서 나타나는 인지 기능 장애 치료에 폭넓게 응용 및 적용될 수 있을 것으로 기대된다.
이승희 교수는 “이번 연구는 두뇌 기능을 높이고, 뇌 질환을 치료할 수 있는 새로운 약물 개발로 이어질 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 한국연구재단 중견연구자 지원사업의 지원을 받아 수행됐다.
두뇌 인지 기능 조절하는 신경 펩타이드 발견
우리 대학 생명과학과 이승희 교수 연구팀이 두뇌에 존재하는 신경 펩타이드 중 하나인 소마토스타틴(somatostatin)이 두뇌 인지 기능을 높일 수 있음을 밝혔다.
이 교수 연구팀은 특정 가바(뇌세포 대사 기능을 억제 신경 안정 작용을 하는 신경 전달 억제 물질) 분비 신경 세포에서 분비되는 펩타이드 중 하나인 소마토스태틴이 시각 피질의 정보 처리 과정을 조절하고 높일 수 있음을 규명했다. 이번 연구 성과는 치매 등의 뇌 질환에서 인지 능력 회복을 위한 치료제 개발의 계기가 될 것으로 기대된다.
생명과학과 송유향 박사, 황양선 석사, 바이오및뇌공학과 김관수 박사과정, 서울대학교 의과학대학 이형로 박사과정이 공동 1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘사이언스 어드밴시스 (Science Advances)’ 4월 22일 자 온라인판에 게재됐다(논문명 : Somatostatin enhances visual processing and perception by modulating excitatory inputs to the parvalbumin-positive interneurons in V1).
2019년 기준 국내 65세 이상 노인 중 10명 중 1명은 치매 질환을 갖고 있다. 치매는 기억력 손실, 인지 기능 및 운동기능 저하 등의 일상생활 장애를 유발해 그 심각성은 나날이 두드러지고 있다.
이승희 교수 연구팀은 치매의 한 종류인 알츠하이머 질환 환자의 뇌척수액에서 소마토스타틴의 발현율이 현저히 감소했다는 점에 주목해 소마토스타틴에 의한 인지 능력 회복 가능성을 밝히는 연구를 수행했다.
소마토스타틴은 인간을 포함한 포유류의 중추신경계에서 존재한다. 특히 정상적인 포유류의 대뇌 피질에서 소마토스타틴을 발현하는 신경 세포인 가바(GABA, γ-aminobutyric acid)를 신경전달물질로 분비해 흥분성 신경 세포의 활성을 억제함으로써 정보 처리 정도를 조율한다.
그러나 기존 연구는 가바의 효과에만 국한돼, 동시에 분비될 수 있는 신경 펩타이드인 소마토스타틴의 고유한 효과 관련 연구는 부족한 상황이다.
연구팀은 자유롭게 움직이는 실험용 생쥐에서 시각정보 인지 및 식별 능력을 측정할 수 있는 실험 장비를 개발 및 도입했다. 이를 통해 생쥐의 시각피질 또는 뇌척수액에 소마토스타틴을 직접 주입한 후 이를 관찰해 생쥐의 시각정보 인지 능력이 현저히 증가함을 발견했다.
나아가 소마토스타틴의 처리에 따른 생체 내 또는 뇌 절편에서의 신경 세포 간 신경전달 효율의 변화를 측정하고, 해당 신경망을 연속 볼록면 주사전자현미경(SBEM)으로 관찰해 소마토스타틴에 의한 시각인지 기능의 향상이 이루어지는 생체 내 신경 생리적 원리를 규명했다.
이러한 연구 성과는 향후 인간을 비롯한 포유류의 두뇌 인지 기능을 조절 가능할 수 있을 뿐 아니라 퇴행성 뇌 질환 등에서 나타나는 인지 기능 장애 치료에 폭넓게 응용 및 적용될 수 있을 것으로 기대된다.
이승희 교수는 “이번 연구는 두뇌 기능을 높이고, 뇌 질환을 치료할 수 있는 새로운 약물 개발로 이어질 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 한국연구재단 중견연구자 지원사업의 지원을 받아 수행됐다.
2020.04.23
조회수 16126
-
 포유류 종마다 시각 뇌신경망 구조 다른 원인 밝혀
바이오및뇌공학과 백세범 교수 연구팀이 포유류 종들의 시각피질에서 서로 다른 뇌신경망 구조가 형성되는 원리를 밝혔다.
이번 연구결과는 시스템 뇌신경과학 분야에서 수십 년간 설명되지 못했던 문제를 이론적 접근과 계산적 모델 시뮬레이션을 통해 해답을 제시한 계산뇌과학 연구의 성공적인 예시로 평가된다.
연구팀은 두뇌의 시각피질과 망막에 분포하는 신경세포들 간의 정보 추출 비율을 분석함으로써 특정 포유류 종이 갖는 시각피질의 기능적 구조를 예측할 수 있음을 밝혀냈다.
연구팀은 서로 다른 크기의 망막과 시각피질 사이의 신경망 연결 모델을 시뮬레이션 해 두 정보 처리 영역 사이에 대응되는 신경세포의 비율이 달라짐에 따라 완전히 다른 두 가지 구조의 기능성 뇌지도가 형성됨을 보이고, 이 결과가 실제 실험에서 관측되는 신경망 구조와 일치함을 증명했다.
장재선, 송민 박사과정이 공동 1저자로 참여한 이번 연구는 국제 학술지 ‘셀(cell)’의 온라인 자매지 ‘셀 리포츠(Cell Reports)’ 3월 10일 자에 게재됐다. (논문명 : Retino-cortical mapping ratio predicts columnar and salt-and-pepper organization in mammalian visual cortex)
포유류의 시각피질에서는 시각 자극의 방향에 따라 반응의 정도가 달라지는 성질인 방향 선택성(orientation selectivity)을 갖는 세포들이 관측된다. 원숭이, 고양이 등의 종에서는 이 세포들의 선호 방향이 연속적, 주기적인 형태로 변하는 방향성 지도(orientation map) 구조를 형성하는 반면, 생쥐 등의 설치류에서는 마치 소금과 후추를 뿌려 놓은 듯한 무작위에 가까운 형태로 분포해, 이를 소금-후추 구조(salt-and-pepper organization)라 한다.
동일한 역할을 수행하는 것으로 보이는 기능성 뇌신경망이 이렇게 종에 따라 다른 구조를 갖는 원인을 찾기 위해 지난 수십여 년 간 다양한 연구가 진행됐으나, 아직까지도 이를 결정하는 요인에 대해서는 명확하게 알려진 바가 없었다.
이러한 원리를 규명하기 위해 연구팀은 서로 다른 크기의 망막과 시각피질이 연결될 때 동일한 망막 신호를 샘플링하는 시각피질 세포의 비율이 달라지게 된다고 가정했다. 이러한 조건에서 망막-시각피질 신호의 샘플링 형태를 시뮬레이션 하여 샘플링 비율에 따라 시각피질에서 형성되는 기능성 지도의 구조가 완전히 다르게 결정될 수 있음을 발견했다.
이 결과를 기반으로 연구팀은 다양한 종들에 대한 망막 및 시각피질 데이터를 종합적으로 비교해 시각피질이 클수록, 또 망막이 작을수록 연속적인 방향성 지도가 형성되는 경향이 있음을 확인했다.
또한, 기존의 연구에서 확인된 포유류 여덟 종의 시각피질-망막 크기 비율을 기반으로 한 모델을 정량적으로 시뮬레이션하고, 이 결과가 실험에서 관측된 것과 같이 방향성 지도 존재 여부에 따라 두 그룹으로 명확히 나누어짐을 확인했다.
이러한 결과는 다른 종으로 진화가 이뤄질 때, 감각기관의 크기와 같은 지극히 단순한 물리적인 조건의 차이에 의해서도 뇌신경망의 구조가 완전히 다른 방향으로 변화될 수 있음을 뜻한다. 이는 다양한 생물학적 구조가 기존의 생각보다 훨씬 단순한 물리적 요소들의 차이에 의해 예측되거나 설명될 수 있음을 보여준다.
백세범 교수는 “이미 오랫동안 알려져 있었으나 그 의미를 찾아내지 못했던 데이터들과 이론적인 모델을 결합해 새로운 발견을 도출해낸 의미 있는 연구이다”라며 “뇌 과학뿐만 아니라 계통분류학, 진화생물학 등 생물의 기능적 구조와 관련된 다양한 생물학 분야에서 이론적 모델 연구의 역할에 대한 중요한 시각을 제공할 것이다”라고 언급했다.
이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업의 지원을 받아 수행됐다.
포유류 종마다 시각 뇌신경망 구조 다른 원인 밝혀
바이오및뇌공학과 백세범 교수 연구팀이 포유류 종들의 시각피질에서 서로 다른 뇌신경망 구조가 형성되는 원리를 밝혔다.
이번 연구결과는 시스템 뇌신경과학 분야에서 수십 년간 설명되지 못했던 문제를 이론적 접근과 계산적 모델 시뮬레이션을 통해 해답을 제시한 계산뇌과학 연구의 성공적인 예시로 평가된다.
연구팀은 두뇌의 시각피질과 망막에 분포하는 신경세포들 간의 정보 추출 비율을 분석함으로써 특정 포유류 종이 갖는 시각피질의 기능적 구조를 예측할 수 있음을 밝혀냈다.
연구팀은 서로 다른 크기의 망막과 시각피질 사이의 신경망 연결 모델을 시뮬레이션 해 두 정보 처리 영역 사이에 대응되는 신경세포의 비율이 달라짐에 따라 완전히 다른 두 가지 구조의 기능성 뇌지도가 형성됨을 보이고, 이 결과가 실제 실험에서 관측되는 신경망 구조와 일치함을 증명했다.
장재선, 송민 박사과정이 공동 1저자로 참여한 이번 연구는 국제 학술지 ‘셀(cell)’의 온라인 자매지 ‘셀 리포츠(Cell Reports)’ 3월 10일 자에 게재됐다. (논문명 : Retino-cortical mapping ratio predicts columnar and salt-and-pepper organization in mammalian visual cortex)
포유류의 시각피질에서는 시각 자극의 방향에 따라 반응의 정도가 달라지는 성질인 방향 선택성(orientation selectivity)을 갖는 세포들이 관측된다. 원숭이, 고양이 등의 종에서는 이 세포들의 선호 방향이 연속적, 주기적인 형태로 변하는 방향성 지도(orientation map) 구조를 형성하는 반면, 생쥐 등의 설치류에서는 마치 소금과 후추를 뿌려 놓은 듯한 무작위에 가까운 형태로 분포해, 이를 소금-후추 구조(salt-and-pepper organization)라 한다.
동일한 역할을 수행하는 것으로 보이는 기능성 뇌신경망이 이렇게 종에 따라 다른 구조를 갖는 원인을 찾기 위해 지난 수십여 년 간 다양한 연구가 진행됐으나, 아직까지도 이를 결정하는 요인에 대해서는 명확하게 알려진 바가 없었다.
이러한 원리를 규명하기 위해 연구팀은 서로 다른 크기의 망막과 시각피질이 연결될 때 동일한 망막 신호를 샘플링하는 시각피질 세포의 비율이 달라지게 된다고 가정했다. 이러한 조건에서 망막-시각피질 신호의 샘플링 형태를 시뮬레이션 하여 샘플링 비율에 따라 시각피질에서 형성되는 기능성 지도의 구조가 완전히 다르게 결정될 수 있음을 발견했다.
이 결과를 기반으로 연구팀은 다양한 종들에 대한 망막 및 시각피질 데이터를 종합적으로 비교해 시각피질이 클수록, 또 망막이 작을수록 연속적인 방향성 지도가 형성되는 경향이 있음을 확인했다.
또한, 기존의 연구에서 확인된 포유류 여덟 종의 시각피질-망막 크기 비율을 기반으로 한 모델을 정량적으로 시뮬레이션하고, 이 결과가 실험에서 관측된 것과 같이 방향성 지도 존재 여부에 따라 두 그룹으로 명확히 나누어짐을 확인했다.
이러한 결과는 다른 종으로 진화가 이뤄질 때, 감각기관의 크기와 같은 지극히 단순한 물리적인 조건의 차이에 의해서도 뇌신경망의 구조가 완전히 다른 방향으로 변화될 수 있음을 뜻한다. 이는 다양한 생물학적 구조가 기존의 생각보다 훨씬 단순한 물리적 요소들의 차이에 의해 예측되거나 설명될 수 있음을 보여준다.
백세범 교수는 “이미 오랫동안 알려져 있었으나 그 의미를 찾아내지 못했던 데이터들과 이론적인 모델을 결합해 새로운 발견을 도출해낸 의미 있는 연구이다”라며 “뇌 과학뿐만 아니라 계통분류학, 진화생물학 등 생물의 기능적 구조와 관련된 다양한 생물학 분야에서 이론적 모델 연구의 역할에 대한 중요한 시각을 제공할 것이다”라고 언급했다.
이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업의 지원을 받아 수행됐다.
2020.03.11
조회수 14877
-
 허원도 교수, 머리에 빛 비춰 기억 및 공감능력 향상 기술 개발
우리 대학 생명과학과 허원도 교수 연구팀이 머리에 빛을 비춰 뇌신경세포 내 칼슘 농도를 조절함으로써 공간기억 및 공감 능력을 높이는 비침습적인 기술을 개발했다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 10일 자 온라인 판에 게재됐다.
칼슘은 세포 기능에 중요한 물질로, 세포 이동, 분열, 유전자 발현, 신경 전달 물질 분비, 항상성 유지 등에 폭넓게 관여한다. 세포가 제 기능을 잘 수행하기 위해서는 세포 내 칼슘 농도가 적절하게 조절돼야 한다.
세포 내 칼슘 양이 부족해지면 인지장애, 심장부정맥 등 다양한 질환으로 이어질 수 있다. 허원도 교수 연구팀은 이전 연구에서 세포에 빛을 비춰 세포 내 칼슘 농도를 조절하는 옵토스팀원(OptoSTIM1) 기술을 개발하여 네이처 바오이테크놀로지(Nature Biotechnology) 2015년 9월호 표지논문으로 보고한 바 있다.
옵토스팀원(OptoSTIM1) 기술은 빛을 이용하여 비침습적으로 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 쥐 머리에 청색 빛을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 세포의 칼슘 통로를 열면 세포 내로 칼슘이 유입된다. 외과적 시술에 비해 비침습적이긴 하나, 옵토스팀원(OptoSTIM1) 기술을 이용하려면 생체 내에 광섬유를 삽입해 빛을 뇌 조직 내로 전달하는 과정이 필요하다. 광섬유 삽입은 털, 피부, 머리뼈, 생체 조직 손상 및 면역력 약화 등 부작용을 유발한다는 문제점이 있다.
연구진은 옵토스팀원 기술에서 사용했던 광수용체 단백질의 유전자를 변형시킴으로써 빛에 민감도를 55배 증가시킨 몬스팀원(monSTIM1) 기술을 개발했다. 청색 빛에 대한 민감도를 크게 높여 광섬유 삽입 없이 살아있는 쥐의 머리에 손전등 강도의 빛을 쬐어주는 것만으로도 뇌신경세포의 칼슘 조절이 가능해졌다. 이를 이용해 수술 없이 살아있는 동물의 뇌신경세포의 활성화를 유도할 수 있기 때문에 향후 세포 수준뿐만 아니라 개체 수준에서의 칼슘 역할 규명이 가능할 것으로 기대된다.
연구진은 쥐의 뇌세포에 몬스팀원을 발현시키고, 뇌가 손상되지 않은 쥐의 머리 위에 청색광을 쬐어 비침습적으로 칼슘 신호를 활성화했다. 머리뼈 근처에 위치하는 뇌 피질뿐만 아니라 뇌 깊숙하게 위치한 해마와 시상까지도 칼슘 신호가 활성화됐다. 추가적으로 뇌 전대상 피질의 흥분성 신경세포에 몬스팀원 기술을 적용하여 행동 변화를 관찰했다. 살아있는 쥐에서 빛 자극을 통해 칼슘 신호가 증가하고 생쥐의 공간기억이 증가하고 공감능력이 향상됨을 관찰했다.
비침습적인 빛 자극으로 쥐의 생리학적 현상에 지장을 주지 않는 상태에서 뇌의 칼슘 신호를 실시간으로 조절할 수 있어 뇌 연구에 다양하게 적용 가능하다. 칼슘에 의한 신경 행동적인 변화에 대한 연구를 생체 모델에서 하기 위해 더 향상된 기술이다.
허원도 교수는“몬스팀원(monSTIM1) 기술을 이용하면 빛을 이용하면 뇌를 손상하지 않고 비침습적으로 세포 내 칼슘 신호를 쉽게 조작할 수 있다”라며 “이 기술이 뇌세포 칼슘 연구, 뇌인지 과학 연구 등에 다양하게 적용 되길 바란다”라고 말했다.
허원도 교수, 머리에 빛 비춰 기억 및 공감능력 향상 기술 개발
우리 대학 생명과학과 허원도 교수 연구팀이 머리에 빛을 비춰 뇌신경세포 내 칼슘 농도를 조절함으로써 공간기억 및 공감 능력을 높이는 비침습적인 기술을 개발했다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 10일 자 온라인 판에 게재됐다.
칼슘은 세포 기능에 중요한 물질로, 세포 이동, 분열, 유전자 발현, 신경 전달 물질 분비, 항상성 유지 등에 폭넓게 관여한다. 세포가 제 기능을 잘 수행하기 위해서는 세포 내 칼슘 농도가 적절하게 조절돼야 한다.
세포 내 칼슘 양이 부족해지면 인지장애, 심장부정맥 등 다양한 질환으로 이어질 수 있다. 허원도 교수 연구팀은 이전 연구에서 세포에 빛을 비춰 세포 내 칼슘 농도를 조절하는 옵토스팀원(OptoSTIM1) 기술을 개발하여 네이처 바오이테크놀로지(Nature Biotechnology) 2015년 9월호 표지논문으로 보고한 바 있다.
옵토스팀원(OptoSTIM1) 기술은 빛을 이용하여 비침습적으로 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 쥐 머리에 청색 빛을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 세포의 칼슘 통로를 열면 세포 내로 칼슘이 유입된다. 외과적 시술에 비해 비침습적이긴 하나, 옵토스팀원(OptoSTIM1) 기술을 이용하려면 생체 내에 광섬유를 삽입해 빛을 뇌 조직 내로 전달하는 과정이 필요하다. 광섬유 삽입은 털, 피부, 머리뼈, 생체 조직 손상 및 면역력 약화 등 부작용을 유발한다는 문제점이 있다.
연구진은 옵토스팀원 기술에서 사용했던 광수용체 단백질의 유전자를 변형시킴으로써 빛에 민감도를 55배 증가시킨 몬스팀원(monSTIM1) 기술을 개발했다. 청색 빛에 대한 민감도를 크게 높여 광섬유 삽입 없이 살아있는 쥐의 머리에 손전등 강도의 빛을 쬐어주는 것만으로도 뇌신경세포의 칼슘 조절이 가능해졌다. 이를 이용해 수술 없이 살아있는 동물의 뇌신경세포의 활성화를 유도할 수 있기 때문에 향후 세포 수준뿐만 아니라 개체 수준에서의 칼슘 역할 규명이 가능할 것으로 기대된다.
연구진은 쥐의 뇌세포에 몬스팀원을 발현시키고, 뇌가 손상되지 않은 쥐의 머리 위에 청색광을 쬐어 비침습적으로 칼슘 신호를 활성화했다. 머리뼈 근처에 위치하는 뇌 피질뿐만 아니라 뇌 깊숙하게 위치한 해마와 시상까지도 칼슘 신호가 활성화됐다. 추가적으로 뇌 전대상 피질의 흥분성 신경세포에 몬스팀원 기술을 적용하여 행동 변화를 관찰했다. 살아있는 쥐에서 빛 자극을 통해 칼슘 신호가 증가하고 생쥐의 공간기억이 증가하고 공감능력이 향상됨을 관찰했다.
비침습적인 빛 자극으로 쥐의 생리학적 현상에 지장을 주지 않는 상태에서 뇌의 칼슘 신호를 실시간으로 조절할 수 있어 뇌 연구에 다양하게 적용 가능하다. 칼슘에 의한 신경 행동적인 변화에 대한 연구를 생체 모델에서 하기 위해 더 향상된 기술이다.
허원도 교수는“몬스팀원(monSTIM1) 기술을 이용하면 빛을 이용하면 뇌를 손상하지 않고 비침습적으로 세포 내 칼슘 신호를 쉽게 조작할 수 있다”라며 “이 기술이 뇌세포 칼슘 연구, 뇌인지 과학 연구 등에 다양하게 적용 되길 바란다”라고 말했다.
2020.01.22
조회수 9579
-
 임미희 교수, 손상된 뇌 신경교세포 회복 물질 개발
우리 대학 화학과 임미희 교수 연구팀이 손상된 뇌의 신경교세포를 회복시키는 저분자 화합물(Small molecule)을 발견했다.
연구팀의 이번 연구는 기억력 등 인지기능이 저하돼 일상생활의 장애를 유발하는 알츠하이머 등 만성질환의 치료 가능성을 제시할 수 있을 것으로 기대된다.
경북대 의대 박민희 교수가 1 저자로 참여하고 경북대 배재성, 진희경 교수가 공동 교신저자로 참여한 이번 연구는 미국 국립과학원에서 발행하는 국제 학술지 ‘PNAS’ 11월 4일 자 온라인판에 게재됐다.
퇴행성 뇌 질환인 치매의 일종인 알츠하이머병은 다양한 원인에 의해 발생된다. 이 질병을 치료하기 위해서 병의 원인을 정확히 파악하고 그에 맞는 치료제들을 개발하는 것이 무엇보다 중요하다.
아밀로이드-베타 펩타이드는 알츠하이머병과 밀접한 관계가 있다고 알려져 있다. 또한, 뇌의 신경 세포이며 면역 세포인 신경교세포는 신경염증 반응에 중추적인 역할을 한다. 최근 들어, 아밀로이드-베타 펩타이드와 신경교세포의 신경염증 반응 사이의 상관관계가 알츠하이머병을 일으킬 수 있는 주요한 원인으로 주목받고 있다.
신경교세포는 뇌에서 면역기능을 담당하는 신경세포의 일종으로, 탐식기능 및 식세포 작용을 통해 노폐물을 처리하는 역할을 한다.
연구팀은 알츠하이머 동물 모델들에게 저분자 화합물을 주입한 후, 동물들의 인지능력과 뇌 속에 존재하는 베타 아밀로이드의 양을 관찰해 알츠하이머 치료제로서 어떠한 유효한 효과가 있는지 실험했다.
이를 통해 ‘저분자 화합물’이 주입된 동물들은 손상된 신경교세포가 회복돼 뇌 속에 존재하는 베타 아밀로이드 단백질이 감소하는 등 인지능력이 향상된다는 사실을 발견했다.
임미희 교수는 “이 연구는 마이크로글리아의 식세포 작용 손상을 복구시켜 알츠하이머병을 치료할 수 있다는 것을 증명했다”라며 “발견된 합성 분자를 바탕으로 다양한 퇴행성 뇌질환의 치료제 개발에 더욱 박차를 가할 것이다”라고 말했다.
이번 연구는 한국보건산업진흥원, 한국연구재단, KAIST, 그리고 국가과학기술연구회 지원으로 수행됐다.
임미희 교수, 손상된 뇌 신경교세포 회복 물질 개발
우리 대학 화학과 임미희 교수 연구팀이 손상된 뇌의 신경교세포를 회복시키는 저분자 화합물(Small molecule)을 발견했다.
연구팀의 이번 연구는 기억력 등 인지기능이 저하돼 일상생활의 장애를 유발하는 알츠하이머 등 만성질환의 치료 가능성을 제시할 수 있을 것으로 기대된다.
경북대 의대 박민희 교수가 1 저자로 참여하고 경북대 배재성, 진희경 교수가 공동 교신저자로 참여한 이번 연구는 미국 국립과학원에서 발행하는 국제 학술지 ‘PNAS’ 11월 4일 자 온라인판에 게재됐다.
퇴행성 뇌 질환인 치매의 일종인 알츠하이머병은 다양한 원인에 의해 발생된다. 이 질병을 치료하기 위해서 병의 원인을 정확히 파악하고 그에 맞는 치료제들을 개발하는 것이 무엇보다 중요하다.
아밀로이드-베타 펩타이드는 알츠하이머병과 밀접한 관계가 있다고 알려져 있다. 또한, 뇌의 신경 세포이며 면역 세포인 신경교세포는 신경염증 반응에 중추적인 역할을 한다. 최근 들어, 아밀로이드-베타 펩타이드와 신경교세포의 신경염증 반응 사이의 상관관계가 알츠하이머병을 일으킬 수 있는 주요한 원인으로 주목받고 있다.
신경교세포는 뇌에서 면역기능을 담당하는 신경세포의 일종으로, 탐식기능 및 식세포 작용을 통해 노폐물을 처리하는 역할을 한다.
연구팀은 알츠하이머 동물 모델들에게 저분자 화합물을 주입한 후, 동물들의 인지능력과 뇌 속에 존재하는 베타 아밀로이드의 양을 관찰해 알츠하이머 치료제로서 어떠한 유효한 효과가 있는지 실험했다.
이를 통해 ‘저분자 화합물’이 주입된 동물들은 손상된 신경교세포가 회복돼 뇌 속에 존재하는 베타 아밀로이드 단백질이 감소하는 등 인지능력이 향상된다는 사실을 발견했다.
임미희 교수는 “이 연구는 마이크로글리아의 식세포 작용 손상을 복구시켜 알츠하이머병을 치료할 수 있다는 것을 증명했다”라며 “발견된 합성 분자를 바탕으로 다양한 퇴행성 뇌질환의 치료제 개발에 더욱 박차를 가할 것이다”라고 말했다.
이번 연구는 한국보건산업진흥원, 한국연구재단, KAIST, 그리고 국가과학기술연구회 지원으로 수행됐다.
2019.11.25
조회수 10902
-
 서성배 교수, 당뇨에 큰 영향 미치는 뇌 혈당조절 신경세포 발견
〈 오양균 박사, 서성배 교수 〉
우리 대학 생명과학과 서성배 교수와 뉴욕대학교(NYU) 오양균 박사 공동연구팀이 초파리 모델 시스템을 이용해 뇌 속에 체내 혈당에 직접적인 기능을 하는 포도당 감지 신경세포를 발견하고 그 구체적인 원리를 밝혔다.
이번 연구는 초파리 뇌 속의 포도당 감지 신경세포가 인슐린 생산 조직 활성화, 글루카곤 생산 조직 활동 억제 등을 통해 체내 혈당 조절에 어떻게 관여하는지를 처음으로 밝혀낸 중요한 단서로, 당뇨병의 진단 및 치료에 새로운 가능성을 열 것으로 기대된다.
생명과학과 출신의 오양균 박사가 1 저자로 참여하고 서성배 교수가 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘네이처(Nature)’ 10월 23일 자 온라인판에 게재됐다. (논문명 :A glucose-sensing neuron pair regulates insulin and glucagon in Drosophila)
한국인의 당뇨병 유병률은 14%로 2018년 기준 환자 500만 명을 돌파했다. 당뇨병 증가속도 세계 1위, 잠재적 환자는 4명 중 1명꼴이지만 발병원인은 정확하게 규명되지 않았다. 유전적 요인과 환경적 요인이 존재하지만 대부분 췌장 인슐린 분비세포 기능이 저하되면서 병이 시작되는 것으로 알려져 있다.
최근에는 뇌가 당뇨병의 정도에 영향을 미칠 수 있다는 사실이 밝혀지기도 했다. 대부분 당뇨병 환자에게 스트레스가 당뇨병 증세에 영향을 미치고 혈당 조절을 어렵게 하는데 뇌 어딘가에 존재하는, 알려지지 않은 혈당 조절 능력 때문이라는 것이 학계 주장이다.
서성배 교수 연구팀은 오래전부터 초파리를 이용해 혀나 내장기관뿐 아니라 동물의 뇌 속에도 포도당을 감지하는 세포와 수용체가 존재한다는 사실을 연구해왔다. 인간 두뇌의 시상하부나 후뇌 등에 포도당을 감지하는 신경세포가 존재할 것이라는 점은 예측돼왔지만, 이런 세포들이 어떻게 포도당을 감지해 몸의 각 부위에 명령을 내리는지에 대한 연구는 지금까지 없었다.
연구팀은 초파리 전체 뇌 신경조직을 대상으로 한 광범위한 스크리닝을 통해 초파리가 포도당의 영양적 가치를 판단하는데 필수적인 한 쌍의 신경세포를 발견했다. 이 한 쌍의 신경세포가 체내 포도당 농도 증가에 반응해 활성화되는 특징을 가지고 있음을 파악했다.
연구팀은 약학적, 유전학적 방식을 사용해 이들 세포가 인간의 췌장 세포와 유사한 분자적 시스템을 통해 포도당을 인지한다는 사실을 확인했다. 이를 기반으로 연구팀은 포도당 감지 신경세포가 어떠한 신경세포 및 조직에 신호를 전달하는지에 대해 연구했다.
연구팀은 해당 신경세포가 초파리의 인슐린 생산을 담당하는 신경조직(insulin-producing cells, IPCs)과 글루카곤의 기능을 하는 단백질을 생산하는 조직(AKH-producing cells)에 각각 축삭돌기(Axon, 신경 세포체에서 뻗어 나온 돌기)를 이루고 있음을 확인했다.
이 결과는 한 쌍의 포도당 감지 신경세포가 체내 혈당 조절에 중요한 호르몬을 생산하는 조직들에 직접 체내 영양 정보를 전달할 수 있다는 가능성을 발견한 것이다.
이를 확인하기 위해서 연구팀은 포도당 감지 신경세포와 두 호르몬 분비 조직들 사이의 물리적, 기능적 상호작용들을 확인했다. 그 결과 한 쌍의 포도당 감지 신경세포가 활성화된 경우 인슐린 생산 조직 역시 활성화되며 반면에 글루카곤 생산 조직의 활동은 억제됨을 확인했다.
또한, 연구팀은 포도당 감지 신경세포를 억제할 경우 인슐린 생산 조직의 억제로 인해 혈중 인슐린 농도가 감소하며, 글루카곤 생산 조직에 대한 억제가 사라짐에 따라 혈중 글루카곤 농도가 증가 됨을 확인했다. 이들 호르몬의 변화로 인해 혈중 포도당 농도가 유의미하게 증가함을 최종적으로 확인했다.
뇌 속에 단 한 쌍의 포도당 감지 신경세포만의 활동을 조절함으로써 당뇨병의 증상을 가지는 초파리를 인위적으로 만들 수 있는 것이다.
한발 더 나아가 연구팀은 초파리에서 신경전달 기능을 하는 짧은 단백질의 한 종류인 sNPF(small Neuropeptide F)가 해당 포도당 감지 신경세포에서 발현됨을 파악하고 포도당에 노출됐을 때 이 신경전달물질이 분비됨을 확인했다. 또한, 연구팀은 인슐린 생산 조직과 글루카곤 생산 조직에서 sNPF 의 수용체가 포도당 감지 신경세포의 신호를 받는데 필수적인 역할을 함을 증명했다.
서성배 교수는 “이번 연구 결과는 초파리에서 의미 있는 발견을 했다는 사실을 넘어 당뇨병 원인 규명과 치료의 패러다임을 근본적으로 바꿀 수 있는 계기를 마련한 것이다”라며 “뇌에서 만들어지는 신호가 체내 혈당 조절에 근본적인 역할을 함이 구체적으로 규명되면 한 단계 진보된 당뇨병의 진단 및 치료뿐 아니라 비만, 대사질환 치료도 가능해질 것이다”라고 말했다.
□ 그림 설명
그림1,2. 서성배 교수 연구성과 개념도. 혈당에 반응하는 CN neuron의 Axon이 두 갈래로 갈라지며 갈라진 axonal branch는 인슐린을 만드는 세포를 활성화시키고 다른 갈라진 axonal branch는 글루카곤을 만드는 세포를 억제시킴
서성배 교수, 당뇨에 큰 영향 미치는 뇌 혈당조절 신경세포 발견
〈 오양균 박사, 서성배 교수 〉
우리 대학 생명과학과 서성배 교수와 뉴욕대학교(NYU) 오양균 박사 공동연구팀이 초파리 모델 시스템을 이용해 뇌 속에 체내 혈당에 직접적인 기능을 하는 포도당 감지 신경세포를 발견하고 그 구체적인 원리를 밝혔다.
이번 연구는 초파리 뇌 속의 포도당 감지 신경세포가 인슐린 생산 조직 활성화, 글루카곤 생산 조직 활동 억제 등을 통해 체내 혈당 조절에 어떻게 관여하는지를 처음으로 밝혀낸 중요한 단서로, 당뇨병의 진단 및 치료에 새로운 가능성을 열 것으로 기대된다.
생명과학과 출신의 오양균 박사가 1 저자로 참여하고 서성배 교수가 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘네이처(Nature)’ 10월 23일 자 온라인판에 게재됐다. (논문명 :A glucose-sensing neuron pair regulates insulin and glucagon in Drosophila)
한국인의 당뇨병 유병률은 14%로 2018년 기준 환자 500만 명을 돌파했다. 당뇨병 증가속도 세계 1위, 잠재적 환자는 4명 중 1명꼴이지만 발병원인은 정확하게 규명되지 않았다. 유전적 요인과 환경적 요인이 존재하지만 대부분 췌장 인슐린 분비세포 기능이 저하되면서 병이 시작되는 것으로 알려져 있다.
최근에는 뇌가 당뇨병의 정도에 영향을 미칠 수 있다는 사실이 밝혀지기도 했다. 대부분 당뇨병 환자에게 스트레스가 당뇨병 증세에 영향을 미치고 혈당 조절을 어렵게 하는데 뇌 어딘가에 존재하는, 알려지지 않은 혈당 조절 능력 때문이라는 것이 학계 주장이다.
서성배 교수 연구팀은 오래전부터 초파리를 이용해 혀나 내장기관뿐 아니라 동물의 뇌 속에도 포도당을 감지하는 세포와 수용체가 존재한다는 사실을 연구해왔다. 인간 두뇌의 시상하부나 후뇌 등에 포도당을 감지하는 신경세포가 존재할 것이라는 점은 예측돼왔지만, 이런 세포들이 어떻게 포도당을 감지해 몸의 각 부위에 명령을 내리는지에 대한 연구는 지금까지 없었다.
연구팀은 초파리 전체 뇌 신경조직을 대상으로 한 광범위한 스크리닝을 통해 초파리가 포도당의 영양적 가치를 판단하는데 필수적인 한 쌍의 신경세포를 발견했다. 이 한 쌍의 신경세포가 체내 포도당 농도 증가에 반응해 활성화되는 특징을 가지고 있음을 파악했다.
연구팀은 약학적, 유전학적 방식을 사용해 이들 세포가 인간의 췌장 세포와 유사한 분자적 시스템을 통해 포도당을 인지한다는 사실을 확인했다. 이를 기반으로 연구팀은 포도당 감지 신경세포가 어떠한 신경세포 및 조직에 신호를 전달하는지에 대해 연구했다.
연구팀은 해당 신경세포가 초파리의 인슐린 생산을 담당하는 신경조직(insulin-producing cells, IPCs)과 글루카곤의 기능을 하는 단백질을 생산하는 조직(AKH-producing cells)에 각각 축삭돌기(Axon, 신경 세포체에서 뻗어 나온 돌기)를 이루고 있음을 확인했다.
이 결과는 한 쌍의 포도당 감지 신경세포가 체내 혈당 조절에 중요한 호르몬을 생산하는 조직들에 직접 체내 영양 정보를 전달할 수 있다는 가능성을 발견한 것이다.
이를 확인하기 위해서 연구팀은 포도당 감지 신경세포와 두 호르몬 분비 조직들 사이의 물리적, 기능적 상호작용들을 확인했다. 그 결과 한 쌍의 포도당 감지 신경세포가 활성화된 경우 인슐린 생산 조직 역시 활성화되며 반면에 글루카곤 생산 조직의 활동은 억제됨을 확인했다.
또한, 연구팀은 포도당 감지 신경세포를 억제할 경우 인슐린 생산 조직의 억제로 인해 혈중 인슐린 농도가 감소하며, 글루카곤 생산 조직에 대한 억제가 사라짐에 따라 혈중 글루카곤 농도가 증가 됨을 확인했다. 이들 호르몬의 변화로 인해 혈중 포도당 농도가 유의미하게 증가함을 최종적으로 확인했다.
뇌 속에 단 한 쌍의 포도당 감지 신경세포만의 활동을 조절함으로써 당뇨병의 증상을 가지는 초파리를 인위적으로 만들 수 있는 것이다.
한발 더 나아가 연구팀은 초파리에서 신경전달 기능을 하는 짧은 단백질의 한 종류인 sNPF(small Neuropeptide F)가 해당 포도당 감지 신경세포에서 발현됨을 파악하고 포도당에 노출됐을 때 이 신경전달물질이 분비됨을 확인했다. 또한, 연구팀은 인슐린 생산 조직과 글루카곤 생산 조직에서 sNPF 의 수용체가 포도당 감지 신경세포의 신호를 받는데 필수적인 역할을 함을 증명했다.
서성배 교수는 “이번 연구 결과는 초파리에서 의미 있는 발견을 했다는 사실을 넘어 당뇨병 원인 규명과 치료의 패러다임을 근본적으로 바꿀 수 있는 계기를 마련한 것이다”라며 “뇌에서 만들어지는 신호가 체내 혈당 조절에 근본적인 역할을 함이 구체적으로 규명되면 한 단계 진보된 당뇨병의 진단 및 치료뿐 아니라 비만, 대사질환 치료도 가능해질 것이다”라고 말했다.
□ 그림 설명
그림1,2. 서성배 교수 연구성과 개념도. 혈당에 반응하는 CN neuron의 Axon이 두 갈래로 갈라지며 갈라진 axonal branch는 인슐린을 만드는 세포를 활성화시키고 다른 갈라진 axonal branch는 글루카곤을 만드는 세포를 억제시킴
2019.10.24
조회수 14869
-
 심남석 연구원, 난치성 뇌전증의 새로운 유전자 진단법 개발
〈 심남석 연구원 〉
우리 대학 의과학대학원 심남석 박사과정(지도교수 : 이정호 교수), 연세대학교 의료원(의료원장 윤도흠) 세브란스 어린이병원 신경외과 김동석 교수, 소아신경과 강훈철 교수 공동 연구팀이 난치성 뇌전증의 원인 돌연변이를 정확하게 분석할 수 있는 새로운 진단법을 개발했다.
이번 연구를 통해 기초 과학 분야와 임상 진료 영역 간 차이로 환자에게 쉽게 적용하지 못했던 난치성 뇌전증 원인 유전자 진단을 실제 임상 영역에서 시행할 수 있을 것으로 보이며, 이를 통해 환자들에게 더 나은 치료법을 제시할 수 있을 것으로 기대된다.
심남석 박사과정이 1 저자로 참여한 이번 연구는 뇌병리 분야 국제 학술지 ‘악타 뉴로패쏠로지카 (Acta Neuropathologica)’ 8월 3일 자 온라인판에 게재됐다. (논문명 : Precise detection of low-level somatic mutation in resected epilepsy brain tissue)
뇌전증은 전 세계적으로 4번째로 높은 유병률을 보이는 신경학적 질환으로 높은 사회 경제적 비용이 소모된다. 그중 전체 뇌전증의 3~40%를 차지하는 난치성 뇌전증은 약물치료로 조절되지 않고 위험성이 높아 수술 치료가 요구되는 질병이다.
최근 연구팀은 이 난치성 뇌전증이 뇌 체성(사람의 신체적 성질) 돌연변이에 의해 발생한다는 사실을 규명해 새 치료법을 제안한 바 있다. 그러나 뇌 국소 부위에서 발생한 소량의 돌연변이를 찾는 기존 진단법은 정확도가 30% 이하로 매우 낮아 실제 사용에는 어려움이 많다.
연구팀은 세브란스 병원에서 뇌수술을 받은 난치성 뇌전증 환자 232명의 뇌 조직 및 말초 조직(혈액 또는 침)을 분석해 돌연변이가 자주 발생하는 타겟 유전자를 확보했다. 이 타겟 유전자를 대상으로 표적 유전자 복제 염기서열 분석법을 적용해 체성 돌연변이를 분석했다.
연구팀은 고심도 유전체 분석을 통해 최적의 표적 유전자 선별, 고심도 시퀀싱 분석 및 방법의 조합을 찾아 진단 정확도를 50%에서 최대 100%까지 높이는 데 성공했다.
특히 임상에서 쉽게 확보할 수 있는 뇌 조직 절편만으로도 정확도가 100%에 가까운 체성 돌연변이 유전자 진단이 가능함을 확인했다.
1 저자인 심남석 연구원은 “난치성 뇌전증의 유전자 진단은 현재 임상시험 중인 새로운 치료법의 필수적인 과정이다”라며 “높은 효율, 낮은 비용으로 유전자 진단을 할 수 있게 만들어 고통받는 환아들에게 도움을 주고 싶다”라고 말했다.
연구팀은 이번 연구 결과를 바탕으로 교원창업 기업(소바젠, 대표 김병태)을 통해 빠르고 정확한 난치성 뇌전증 원인 유전자 진단 제공할 예정이다.
이번 연구는 서경배 과학재단, 한국연구재단, 보건복지부, 교원창업 기업 소바젠의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구에서 발견한 체세포성 돌연변이
심남석 연구원, 난치성 뇌전증의 새로운 유전자 진단법 개발
〈 심남석 연구원 〉
우리 대학 의과학대학원 심남석 박사과정(지도교수 : 이정호 교수), 연세대학교 의료원(의료원장 윤도흠) 세브란스 어린이병원 신경외과 김동석 교수, 소아신경과 강훈철 교수 공동 연구팀이 난치성 뇌전증의 원인 돌연변이를 정확하게 분석할 수 있는 새로운 진단법을 개발했다.
이번 연구를 통해 기초 과학 분야와 임상 진료 영역 간 차이로 환자에게 쉽게 적용하지 못했던 난치성 뇌전증 원인 유전자 진단을 실제 임상 영역에서 시행할 수 있을 것으로 보이며, 이를 통해 환자들에게 더 나은 치료법을 제시할 수 있을 것으로 기대된다.
심남석 박사과정이 1 저자로 참여한 이번 연구는 뇌병리 분야 국제 학술지 ‘악타 뉴로패쏠로지카 (Acta Neuropathologica)’ 8월 3일 자 온라인판에 게재됐다. (논문명 : Precise detection of low-level somatic mutation in resected epilepsy brain tissue)
뇌전증은 전 세계적으로 4번째로 높은 유병률을 보이는 신경학적 질환으로 높은 사회 경제적 비용이 소모된다. 그중 전체 뇌전증의 3~40%를 차지하는 난치성 뇌전증은 약물치료로 조절되지 않고 위험성이 높아 수술 치료가 요구되는 질병이다.
최근 연구팀은 이 난치성 뇌전증이 뇌 체성(사람의 신체적 성질) 돌연변이에 의해 발생한다는 사실을 규명해 새 치료법을 제안한 바 있다. 그러나 뇌 국소 부위에서 발생한 소량의 돌연변이를 찾는 기존 진단법은 정확도가 30% 이하로 매우 낮아 실제 사용에는 어려움이 많다.
연구팀은 세브란스 병원에서 뇌수술을 받은 난치성 뇌전증 환자 232명의 뇌 조직 및 말초 조직(혈액 또는 침)을 분석해 돌연변이가 자주 발생하는 타겟 유전자를 확보했다. 이 타겟 유전자를 대상으로 표적 유전자 복제 염기서열 분석법을 적용해 체성 돌연변이를 분석했다.
연구팀은 고심도 유전체 분석을 통해 최적의 표적 유전자 선별, 고심도 시퀀싱 분석 및 방법의 조합을 찾아 진단 정확도를 50%에서 최대 100%까지 높이는 데 성공했다.
특히 임상에서 쉽게 확보할 수 있는 뇌 조직 절편만으로도 정확도가 100%에 가까운 체성 돌연변이 유전자 진단이 가능함을 확인했다.
1 저자인 심남석 연구원은 “난치성 뇌전증의 유전자 진단은 현재 임상시험 중인 새로운 치료법의 필수적인 과정이다”라며 “높은 효율, 낮은 비용으로 유전자 진단을 할 수 있게 만들어 고통받는 환아들에게 도움을 주고 싶다”라고 말했다.
연구팀은 이번 연구 결과를 바탕으로 교원창업 기업(소바젠, 대표 김병태)을 통해 빠르고 정확한 난치성 뇌전증 원인 유전자 진단 제공할 예정이다.
이번 연구는 서경배 과학재단, 한국연구재단, 보건복지부, 교원창업 기업 소바젠의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구에서 발견한 체세포성 돌연변이
2019.08.13
조회수 14831
-
 정재웅 교수, 스마트폰으로 뇌 신경회로 무선 제어 기술 개발
〈 김충연, 변상혁 박사과정, 정재웅 교수〉
우리 대학 전기및전자공학부 정재웅 교수와 미국 워싱턴대(University of Washington) 마이클 브루카스(Michael Bruchas) 교수 공동 연구팀이 스마트폰 앱 조작을 통해 약물과 빛을 뇌 특정 부위에 전달함으로써 신경회로를 정교하게 조절할 수 있는 뇌 이식용 무선 기기를 개발했다.
이번 기술 개발을 통해 장기간의 동물 실험이 필요한 신약 개발뿐 아니라 치매, 파킨슨병 등 뇌 질환 치료에도 적용할 수 있을 것으로 기대된다.
라자 콰지(Raza Qazi, 1저자), 김충연, 변상혁 연구원이 개발하고 워싱턴대 신경과학 연구원들이 공동으로 참여한 이번 연구는 의공학 분야 국제 학술지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 8월 6일 자에 게재됐다. (논문명 : Wireless optofluidic brain probes for chronic neuropharmacology and photostimulation).
광유전학과 신경약물학은 주변 신경회로에 영향을 주지 않고 목표로 하는 뉴런이나 신경회로만을 빛 또는 약물, 혹은 그 둘의 조합을 이용해 정교하게 제어할 수 있다. 기존의 전기자극을 활용한 방법에 비해 훨씬 더 높은 시공간적 해상도를 가져 최근 뇌 연구 및 뇌 질병 치료 목적으로 주목받고 있다.
하지만 현재 뇌 연구에 일반적으로 쓰는 기기는 상대적으로 크기가 커 뇌 조직 손상, 정교한 선택적 신경회로 제어 불가, 하나의 다기능성 프로브(probe) 형태로 구현이 어렵다. 또한, 기존 기기는 실리카(silica)와 금속 등 고강성 재료로 제작돼 부드러운 뇌 조직과의 기계 특성적 간극이 있다. 이러한 특성으로 인해 염증반응을 악화시켜 장기간 이식용으로 적합하지 않다.
무엇보다 일반적으로 연구실에서 쓰이고 있는 광섬유, 약물주입관 등은 뇌 이식 후 외부기기에 선이 연결된 형태로 사용해야 해 자유로운 행동을 크게 제약하게 된다.
연구팀은 중합체(polymer) 미세유체관과 마이크로 LED를 결합해 머리카락 두께의 유연한 탐침을 만들고, 이를 소형 블루투스 기반 제어 회로와 교체 가능한 약물 카트리지와 결합했다. 이를 통해 스마트폰 앱을 통해 무선으로 마이크로 LED와 약물 전달을 제어할 수 있는 무게 2g의 뇌 이식용 기기를 구현했다.
특히 약물 카트리지는 레고의 원리를 모사해 탐침 부분과 쉽게 조립 및 분리할 수 있도록 제작해, 필요할 때마다 새로운 약물 카트리지를 결합함으로써 원하는 약물을 장기간에 걸쳐 뇌의 특정 부위에 반복 전달할 수 있도록 만들었다.
연구팀은 이 기기를 쥐의 뇌 보상회로에 이식한 후 도파민 활성 약물과 억제 약물이 든 카트리지를 기기와 결합했다. 그 후 간단한 스마트폰 앱 제어와 도파민 활성 약물을 이용해 원하는 타이밍에 자유롭게 움직이는 쥐의 행동을 증가, 억제하는 데 성공했다.
또한, 연구팀은 쥐의 뇌에서 장소 선호도를 유도할 수 있는 부위에 빛에 반응하는 단백질을 주입해 신경세포가 빛에 반응하도록 처리했다.
그 후 쥐가 특정 장소로 이동했을 때 마이크로 LED를 켜 빛 자극을 통해 쥐가 그 장소에 계속 머물고 싶게 만들었다. 반대로 약물 전달을 통해 뇌 신경회로를 제어함으로써 쥐의 특정 장소 선호도를 없애는 데도 성공했다.
정 교수는 “빛과 약물을 이용한 신경회로 제어는 기존의 전기자극 방법보다 훨씬 더 정교해 부작용 없는 뇌 제어가 가능하다”라며 “개발된 기기는 간단한 스마트폰 조작으로 뇌의 특정 회로를 빛과 약물을 이용해 반복적, 장기적으로 무선 제어가 가능해 뇌 기능을 밝혀내기 위한 연구나 향후 뇌 질환의 치료에도 유용하게 적용할 수 있을 것이다”라고 말했다.
연구팀은 이 기술을 인체에 적용하기 위해 두개골 내에 완전히 이식할 수 있고 반영구적 사용이 가능한 형태로 디자인을 발전시키는 확장 연구를 계획하고 있다.
이번 연구는 한국연구재단 신진연구자지원사업(완전 이식 가능한 무선 유연성 광유체 뉴럴 임플랜트 개발 및 뇌 연구를 위한 광유전학/광약물학에의 적용) 및 기초연구실 지원사업(유전자 및 신경회로 조절 기반 중독 행동 제어 기초연구실)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 디바이스가 이식된 쥐의 사진
그림2. 스마트폰앱을 이용한 마이크로 LED 컨트롤
그림3. 개발된 뇌 이식용 무선 디바이스
정재웅 교수, 스마트폰으로 뇌 신경회로 무선 제어 기술 개발
〈 김충연, 변상혁 박사과정, 정재웅 교수〉
우리 대학 전기및전자공학부 정재웅 교수와 미국 워싱턴대(University of Washington) 마이클 브루카스(Michael Bruchas) 교수 공동 연구팀이 스마트폰 앱 조작을 통해 약물과 빛을 뇌 특정 부위에 전달함으로써 신경회로를 정교하게 조절할 수 있는 뇌 이식용 무선 기기를 개발했다.
이번 기술 개발을 통해 장기간의 동물 실험이 필요한 신약 개발뿐 아니라 치매, 파킨슨병 등 뇌 질환 치료에도 적용할 수 있을 것으로 기대된다.
라자 콰지(Raza Qazi, 1저자), 김충연, 변상혁 연구원이 개발하고 워싱턴대 신경과학 연구원들이 공동으로 참여한 이번 연구는 의공학 분야 국제 학술지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 8월 6일 자에 게재됐다. (논문명 : Wireless optofluidic brain probes for chronic neuropharmacology and photostimulation).
광유전학과 신경약물학은 주변 신경회로에 영향을 주지 않고 목표로 하는 뉴런이나 신경회로만을 빛 또는 약물, 혹은 그 둘의 조합을 이용해 정교하게 제어할 수 있다. 기존의 전기자극을 활용한 방법에 비해 훨씬 더 높은 시공간적 해상도를 가져 최근 뇌 연구 및 뇌 질병 치료 목적으로 주목받고 있다.
하지만 현재 뇌 연구에 일반적으로 쓰는 기기는 상대적으로 크기가 커 뇌 조직 손상, 정교한 선택적 신경회로 제어 불가, 하나의 다기능성 프로브(probe) 형태로 구현이 어렵다. 또한, 기존 기기는 실리카(silica)와 금속 등 고강성 재료로 제작돼 부드러운 뇌 조직과의 기계 특성적 간극이 있다. 이러한 특성으로 인해 염증반응을 악화시켜 장기간 이식용으로 적합하지 않다.
무엇보다 일반적으로 연구실에서 쓰이고 있는 광섬유, 약물주입관 등은 뇌 이식 후 외부기기에 선이 연결된 형태로 사용해야 해 자유로운 행동을 크게 제약하게 된다.
연구팀은 중합체(polymer) 미세유체관과 마이크로 LED를 결합해 머리카락 두께의 유연한 탐침을 만들고, 이를 소형 블루투스 기반 제어 회로와 교체 가능한 약물 카트리지와 결합했다. 이를 통해 스마트폰 앱을 통해 무선으로 마이크로 LED와 약물 전달을 제어할 수 있는 무게 2g의 뇌 이식용 기기를 구현했다.
특히 약물 카트리지는 레고의 원리를 모사해 탐침 부분과 쉽게 조립 및 분리할 수 있도록 제작해, 필요할 때마다 새로운 약물 카트리지를 결합함으로써 원하는 약물을 장기간에 걸쳐 뇌의 특정 부위에 반복 전달할 수 있도록 만들었다.
연구팀은 이 기기를 쥐의 뇌 보상회로에 이식한 후 도파민 활성 약물과 억제 약물이 든 카트리지를 기기와 결합했다. 그 후 간단한 스마트폰 앱 제어와 도파민 활성 약물을 이용해 원하는 타이밍에 자유롭게 움직이는 쥐의 행동을 증가, 억제하는 데 성공했다.
또한, 연구팀은 쥐의 뇌에서 장소 선호도를 유도할 수 있는 부위에 빛에 반응하는 단백질을 주입해 신경세포가 빛에 반응하도록 처리했다.
그 후 쥐가 특정 장소로 이동했을 때 마이크로 LED를 켜 빛 자극을 통해 쥐가 그 장소에 계속 머물고 싶게 만들었다. 반대로 약물 전달을 통해 뇌 신경회로를 제어함으로써 쥐의 특정 장소 선호도를 없애는 데도 성공했다.
정 교수는 “빛과 약물을 이용한 신경회로 제어는 기존의 전기자극 방법보다 훨씬 더 정교해 부작용 없는 뇌 제어가 가능하다”라며 “개발된 기기는 간단한 스마트폰 조작으로 뇌의 특정 회로를 빛과 약물을 이용해 반복적, 장기적으로 무선 제어가 가능해 뇌 기능을 밝혀내기 위한 연구나 향후 뇌 질환의 치료에도 유용하게 적용할 수 있을 것이다”라고 말했다.
연구팀은 이 기술을 인체에 적용하기 위해 두개골 내에 완전히 이식할 수 있고 반영구적 사용이 가능한 형태로 디자인을 발전시키는 확장 연구를 계획하고 있다.
이번 연구는 한국연구재단 신진연구자지원사업(완전 이식 가능한 무선 유연성 광유체 뉴럴 임플랜트 개발 및 뇌 연구를 위한 광유전학/광약물학에의 적용) 및 기초연구실 지원사업(유전자 및 신경회로 조절 기반 중독 행동 제어 기초연구실)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 디바이스가 이식된 쥐의 사진
그림2. 스마트폰앱을 이용한 마이크로 LED 컨트롤
그림3. 개발된 뇌 이식용 무선 디바이스
2019.08.08
조회수 24693
-
 박준성 연구원, 알츠하이머병의 새로운 원인 규명
〈 박준성 박사 〉
우리 대학 의과학대학원 박준성 박사(지도교수 : 이정호 교수), KISTI(한국과학기술정보연구원) 국가슈퍼컴퓨팅본부 유석종 박사 공동 연구팀이 노화 과정에서 발생하는 후천적 뇌 돌연변이가 알츠하이머병의 새 원인이 될 수 있다는 이론을 제시했다.
연구팀은 52명의 알츠하이머병 환자에게 얻은 사후 뇌 조직에서 전장 엑솜 유전체 서열(whole-exome sequencing) 데이터 분석을 통해 알츠하이머병에 존재하는 뇌 체성 유전변이를 찾아냈다. 또한, 뇌 체성 돌연변이가 알츠하이머병의 중요 원인으로 알려진 신경섬유다발 형성을 비정상적으로 증가시킴을 확인했다.
박준성 박사와 KISTI 이준학 박사가 공동 1 저자로 참여한 이번 연구는 국제 학술지 네이처 커뮤니케이션(Nature Communications) 7월 12일자 온라인판에 게재됐다. (논문명 : Brain somatic mutations observed in Alzheimer's disease associated with aging and dysregulation of tau phosphorylation)
노인성 치매의 가장 흔한 원인으로 알려진 알츠하이머병은 전 세계 GDP의 1%를 차지할 정도로 사회, 경제적 소모비용이 큰 질환이다. 하지만 여전히 알츠하이머병을 일으키는 분자 유전학적 원인은 명확하게 규명되지 않고 있다.
기존의 알츠하이머병 유전체 연구는 주로 환자의 말초조직인 혈액에서 전장유전체 연관분석(Genome-wide association study)을 하거나, 이미 가족력이 있는 환자에서 발견된 일부 유전자들(e.g., APP, PSEN1/2)에 대한 유전자 패널 분석 등이 주를 이루었다.
연구팀은 산발성 알츠하이머병 환자들에게 내후각피질에서 신경섬유다발이 공통으로 나타나는 현상에 주목해 알츠하이머병 환자의 뇌 조직에서 직접 엑솜 유전체 데이터를 생성해 알츠하이머병 뇌-특이적 체성 유전변이를 발굴했다.
연구팀은 알츠하이머병 환자와 정상인의 해마 형성체 부위를 레이저 현미 해부법을 통해 정밀하게 오려냈고, 저빈도의 체성 유전변이(Somatic mutation)를 정확하게 찾아내기 위해 대용량 고심도 엑솜 시퀀싱 데이터를 생성하고 저빈도 체성 유전변이 분석에 특화된 분석 파이프라인을 독자적으로 구축했다.
이러한 새 방법론을 통해 실제로 알츠하이머병 환자의 뇌에 체성 유전변이가 실제로 존재함을 체계적으로 규명함과 동시에 체성 유전변이의 누적속도 및 신경섬유다발 형성과의 관련성도 함께 밝혀냈다.
연구팀의 발견은 알츠하이머병의 발병에 체성 유전변이가 주요한 역할을 할 수 있음을 강력하게 시사하는 것으로, 알츠하이머병 유전체 연구에 대한 새로운 틀을 제시함과 동시에 향후 다른 신경퇴행성뇌질환의 연구에도 기여할 수 있을 것으로 기대된다.
연구팀은 이번 연구 결과를 바탕으로 교원 창업 기업(소바젠, 대표 김병태)을 통해 알츠하이머 질환의 진단과 치료제 개발에 나설 예정이다.
KISTI 유석종 박사는 연구팀이 구축한 저빈도 체성 유전변이 분석 파이프라인 및 빅데이터 분석을 위한 슈퍼컴퓨팅 기술을 통해 알츠하이머병의 새로운 발병 원리를 밝혀냈다라며 타 유전체 기반 연구에 활용할 수 있는 기반을 마련했다라고 말했다.
이번 연구는 서경배 과학재단, 보건복지부 및 한국과학기술정보연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
□ 그림 설명
그림1. 본 연구에서 사용된 체성 유전변이 분석 파이프라인
그림2. 신경섬유성다발 형성에 관여하는 체성 유전변이
그림3. PIN1 유전자에 발생한 병원성 뇌 체성유전변이와 신경섬유다발 형성과의 관계 규명
박준성 연구원, 알츠하이머병의 새로운 원인 규명
〈 박준성 박사 〉
우리 대학 의과학대학원 박준성 박사(지도교수 : 이정호 교수), KISTI(한국과학기술정보연구원) 국가슈퍼컴퓨팅본부 유석종 박사 공동 연구팀이 노화 과정에서 발생하는 후천적 뇌 돌연변이가 알츠하이머병의 새 원인이 될 수 있다는 이론을 제시했다.
연구팀은 52명의 알츠하이머병 환자에게 얻은 사후 뇌 조직에서 전장 엑솜 유전체 서열(whole-exome sequencing) 데이터 분석을 통해 알츠하이머병에 존재하는 뇌 체성 유전변이를 찾아냈다. 또한, 뇌 체성 돌연변이가 알츠하이머병의 중요 원인으로 알려진 신경섬유다발 형성을 비정상적으로 증가시킴을 확인했다.
박준성 박사와 KISTI 이준학 박사가 공동 1 저자로 참여한 이번 연구는 국제 학술지 네이처 커뮤니케이션(Nature Communications) 7월 12일자 온라인판에 게재됐다. (논문명 : Brain somatic mutations observed in Alzheimer's disease associated with aging and dysregulation of tau phosphorylation)
노인성 치매의 가장 흔한 원인으로 알려진 알츠하이머병은 전 세계 GDP의 1%를 차지할 정도로 사회, 경제적 소모비용이 큰 질환이다. 하지만 여전히 알츠하이머병을 일으키는 분자 유전학적 원인은 명확하게 규명되지 않고 있다.
기존의 알츠하이머병 유전체 연구는 주로 환자의 말초조직인 혈액에서 전장유전체 연관분석(Genome-wide association study)을 하거나, 이미 가족력이 있는 환자에서 발견된 일부 유전자들(e.g., APP, PSEN1/2)에 대한 유전자 패널 분석 등이 주를 이루었다.
연구팀은 산발성 알츠하이머병 환자들에게 내후각피질에서 신경섬유다발이 공통으로 나타나는 현상에 주목해 알츠하이머병 환자의 뇌 조직에서 직접 엑솜 유전체 데이터를 생성해 알츠하이머병 뇌-특이적 체성 유전변이를 발굴했다.
연구팀은 알츠하이머병 환자와 정상인의 해마 형성체 부위를 레이저 현미 해부법을 통해 정밀하게 오려냈고, 저빈도의 체성 유전변이(Somatic mutation)를 정확하게 찾아내기 위해 대용량 고심도 엑솜 시퀀싱 데이터를 생성하고 저빈도 체성 유전변이 분석에 특화된 분석 파이프라인을 독자적으로 구축했다.
이러한 새 방법론을 통해 실제로 알츠하이머병 환자의 뇌에 체성 유전변이가 실제로 존재함을 체계적으로 규명함과 동시에 체성 유전변이의 누적속도 및 신경섬유다발 형성과의 관련성도 함께 밝혀냈다.
연구팀의 발견은 알츠하이머병의 발병에 체성 유전변이가 주요한 역할을 할 수 있음을 강력하게 시사하는 것으로, 알츠하이머병 유전체 연구에 대한 새로운 틀을 제시함과 동시에 향후 다른 신경퇴행성뇌질환의 연구에도 기여할 수 있을 것으로 기대된다.
연구팀은 이번 연구 결과를 바탕으로 교원 창업 기업(소바젠, 대표 김병태)을 통해 알츠하이머 질환의 진단과 치료제 개발에 나설 예정이다.
KISTI 유석종 박사는 연구팀이 구축한 저빈도 체성 유전변이 분석 파이프라인 및 빅데이터 분석을 위한 슈퍼컴퓨팅 기술을 통해 알츠하이머병의 새로운 발병 원리를 밝혀냈다라며 타 유전체 기반 연구에 활용할 수 있는 기반을 마련했다라고 말했다.
이번 연구는 서경배 과학재단, 보건복지부 및 한국과학기술정보연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
□ 그림 설명
그림1. 본 연구에서 사용된 체성 유전변이 분석 파이프라인
그림2. 신경섬유성다발 형성에 관여하는 체성 유전변이
그림3. PIN1 유전자에 발생한 병원성 뇌 체성유전변이와 신경섬유다발 형성과의 관계 규명
2019.07.17
조회수 17215
-
 조광현 교수, 뇌의 제어구조 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌 영역 간 복잡한 연결 네트워크에 내재된 뇌의 제어구조를 규명했다.
이번 연구를 통해 뇌의 동작 원리에 대한 이해를 높이고, 뇌의 제어구조 분석을 통해 뇌 질환 연구 및 치료에 응용될 수 있을 것으로 기대된다. 또한 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학을 통해 규명했다는 의의가 있다.
이병욱 박사, 강의룡, 장홍준 박사과정이 참여한 이번 연구는 셀(Cell) 출판사가 펴내는 융합과학 국제학술지 ‘아이사이언스(iScience)’ 3월 29일 자에 게재됐다.
뇌의 다양한 인지기능은 뇌 영역들 사이의 복잡한 연결을 통한 영역 간 상호작용으로 이뤄진다. 최근 뇌의 연결성에 대한 정보가 뇌의 동작 원리를 파악하는 핵심이라는 의견이 대두되면서 세계적으로 뇌 연결성을 파악하기 위한 커넥톰(Connectome) 연구가 활발히 이뤄지고 있다.
이를 통해 뇌 영역 사이의 구체적 연결성이 파악되고 있지만 복잡한 연결성에 내재된 뇌의 동작 원리에 대한 이해는 아직 매우 부족한 상황이다. 특히 뇌의 강건하면서 효율적 정보처리 능력의 기반이 되는 뇌의 숨겨진 제어구조는 파악된 내용이 없다.
조 교수 연구팀은 뇌의 제어구조 분석을 위해 ‘미국국립보건원(NIH) 휴먼 커넥톰 프로젝트(Human Connectome Project)’에서 제공하는 정상인의 뇌 영상 이미지 데이터를 활용해 뇌 영영 간 네트워크를 구축했다.
이후 연구팀은 그래프 이론의 최소지배집합(minimum dominating set) 개념을 활용해 뇌 영역 간 복잡한 연결 네트워크의 제어구조를 분석했다.
최소지배집합이란 네트워크의 각 노드(뇌의 각 영역)가 링크(뇌의 서로 다른 영역간의 연결)로 연결된 이웃 노드에 직접적 영향을 줘 기능을 제어할 수 있다고 가정할 때, 네트워크를 구성하는 모든 노드를 제어하는 데 필요한 최소한의 노드 집합을 말한다.
기존 여러 연구를 통해 다양한 생체 네트워크 및 통신망, 전력망 등의 복잡계 네트워크를 제어하는 데 있어서 최소지배집합이 핵심적인 역할을 한다는 것이 보고된 바 있다.
연구팀은 최소지배집합을 기반으로 ‘제어영역의 분포(distribution of control)’와 ‘제어영역의 중첩(overlap in control area)’이라는 두 가지 지표를 정의한 뒤 이를 기준으로 총 네 종류의 제어구조를 정의했다.
이후 연구팀은 브레인 네트워크를 비롯해 도로망, 통신망, 소셜 네트워크 등 실존하는 다양한 복잡계 네트워크가 어떤 제어구조를 갖는지 분석했다. 분석 결과 뇌는 다른 대부분 네트워크와는 달리 제어영역이 분산된 동시에 서로 중첩된 특이한 구조로 이뤄짐을 밝혀냈다.
뇌의 이러한 제어구조는 외부 섭동에 의한 네트워크의 높은 강건성을 유지하면서 동시에 여러 인지기능을 효율적으로 수행하기 위한 영역들의 상호 활성화를 다양하게 하기 위한 것임을 밝혔다.
IT와 BT가 융합된 시스템생물학 접근을 통한 브레인 네트워크의 구조분석은 인공지능의 발전에도 기여할 것으로 보인다. 브레인 네트워크의 진화적 설계원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다.
조 교수는 “지금껏 뇌의 제어구조가 밝혀진 바가 없었다”라며 “복잡한 연결성에 숨겨진 브레인 네트워크의 진화적 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작 원리를 파악할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뇌의 제어구조 규명
그림2. 뇌 영역 간 네트워크 구축
조광현 교수, 뇌의 제어구조 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌 영역 간 복잡한 연결 네트워크에 내재된 뇌의 제어구조를 규명했다.
이번 연구를 통해 뇌의 동작 원리에 대한 이해를 높이고, 뇌의 제어구조 분석을 통해 뇌 질환 연구 및 치료에 응용될 수 있을 것으로 기대된다. 또한 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학을 통해 규명했다는 의의가 있다.
이병욱 박사, 강의룡, 장홍준 박사과정이 참여한 이번 연구는 셀(Cell) 출판사가 펴내는 융합과학 국제학술지 ‘아이사이언스(iScience)’ 3월 29일 자에 게재됐다.
뇌의 다양한 인지기능은 뇌 영역들 사이의 복잡한 연결을 통한 영역 간 상호작용으로 이뤄진다. 최근 뇌의 연결성에 대한 정보가 뇌의 동작 원리를 파악하는 핵심이라는 의견이 대두되면서 세계적으로 뇌 연결성을 파악하기 위한 커넥톰(Connectome) 연구가 활발히 이뤄지고 있다.
이를 통해 뇌 영역 사이의 구체적 연결성이 파악되고 있지만 복잡한 연결성에 내재된 뇌의 동작 원리에 대한 이해는 아직 매우 부족한 상황이다. 특히 뇌의 강건하면서 효율적 정보처리 능력의 기반이 되는 뇌의 숨겨진 제어구조는 파악된 내용이 없다.
조 교수 연구팀은 뇌의 제어구조 분석을 위해 ‘미국국립보건원(NIH) 휴먼 커넥톰 프로젝트(Human Connectome Project)’에서 제공하는 정상인의 뇌 영상 이미지 데이터를 활용해 뇌 영영 간 네트워크를 구축했다.
이후 연구팀은 그래프 이론의 최소지배집합(minimum dominating set) 개념을 활용해 뇌 영역 간 복잡한 연결 네트워크의 제어구조를 분석했다.
최소지배집합이란 네트워크의 각 노드(뇌의 각 영역)가 링크(뇌의 서로 다른 영역간의 연결)로 연결된 이웃 노드에 직접적 영향을 줘 기능을 제어할 수 있다고 가정할 때, 네트워크를 구성하는 모든 노드를 제어하는 데 필요한 최소한의 노드 집합을 말한다.
기존 여러 연구를 통해 다양한 생체 네트워크 및 통신망, 전력망 등의 복잡계 네트워크를 제어하는 데 있어서 최소지배집합이 핵심적인 역할을 한다는 것이 보고된 바 있다.
연구팀은 최소지배집합을 기반으로 ‘제어영역의 분포(distribution of control)’와 ‘제어영역의 중첩(overlap in control area)’이라는 두 가지 지표를 정의한 뒤 이를 기준으로 총 네 종류의 제어구조를 정의했다.
이후 연구팀은 브레인 네트워크를 비롯해 도로망, 통신망, 소셜 네트워크 등 실존하는 다양한 복잡계 네트워크가 어떤 제어구조를 갖는지 분석했다. 분석 결과 뇌는 다른 대부분 네트워크와는 달리 제어영역이 분산된 동시에 서로 중첩된 특이한 구조로 이뤄짐을 밝혀냈다.
뇌의 이러한 제어구조는 외부 섭동에 의한 네트워크의 높은 강건성을 유지하면서 동시에 여러 인지기능을 효율적으로 수행하기 위한 영역들의 상호 활성화를 다양하게 하기 위한 것임을 밝혔다.
IT와 BT가 융합된 시스템생물학 접근을 통한 브레인 네트워크의 구조분석은 인공지능의 발전에도 기여할 것으로 보인다. 브레인 네트워크의 진화적 설계원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다.
조 교수는 “지금껏 뇌의 제어구조가 밝혀진 바가 없었다”라며 “복잡한 연결성에 숨겨진 브레인 네트워크의 진화적 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작 원리를 파악할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뇌의 제어구조 규명
그림2. 뇌 영역 간 네트워크 구축
2019.04.10
조회수 20938
-
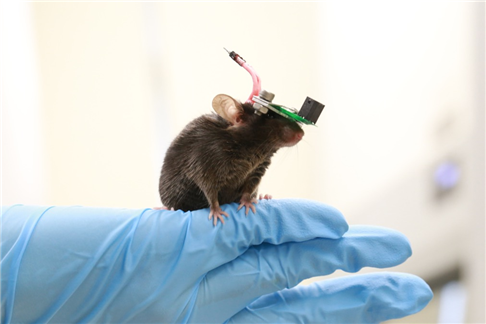 이현주 교수(전기및전자공학부), 움직이는 쥐에 초음파 뇌 자극 실험 성공
우리 대학 전기및전자공학부 이현주 교수 연구팀이 초소형화 및 초경량화한 미세 초음파 소자(CMUT)를 통해 자유롭게 움직이는 쥐의 뇌에 초음파 자극을 줄 수 있는 기술을 개발했다.
이 교수 연구팀은 1g 미만의 초경량 초음파 소자 개발을 통해 움직이는 쥐의 뇌 초음파 결과를 얻는 데 성공했다. 이는 쥐 무게의 6배에 달하는 초음파 변환기를 사용해 움직이는 쥐에 적용할 수 없었던 기존 기술의 한계를 극복한 것이다.
김형국 석사가 주도하고 김성연 석사과정과 덴마크 공과대학교 (DTU) 티어샤(Thielscher) 교수 연구팀이 참여한 이번 연구는 국제 학술지 ‘브레인 스티뮬레이션(Brain Stimulation)’ 11월 17일자 온라인판에 게재됐고, 3월자 12권 2호에 출판될 예정이다. (논문명 : 자유롭게 움직이는 동물에서 비침습 뇌자극이 가능한 초소형 초음파 링 변환자 어레이, Miniature ultrasound ring array transducers for transcranial ultrasound neuromodulation of freely-moving small animals)
최근 뇌 자극 기술로 비침습적이고 집속이 가능한 초음파 자극 기술이 차세대 뇌 자극 기술로 주목받고 있다.
뇌를 자극하는 기존 방법에는 뇌의 특정 영역을 미세 자극할 수 있는 심부뇌자극술(DBS)과 광유전학 기반의 광 자극이 있지만 침습도가 높아 임상에 적용이 어렵다. 경두개전기자극술(TES)과 경두개자기자극술(TMS) 등은 비침습적이지만 자극 부위가 넓고 심부 자극이 불가능해 적용 범위에 한계가 있다.
초음파는 비침습적이기 때문에 동물실험뿐만 아니라 인체에도 안전하게 적용할 수 있어 임상 시험에 활용된다. 또한 초음파 집속을 통해 국소부위 자극과 심부 자극이 모두 가능해 타 기술 대비 이점이 많다.
초음파 뇌 자극 기술은 개발 초기 단계이기 때문에 지금까지는 쥐를 고정한 상태에서의 연구 결과만 발표됐다. 뇌 자극 관련 연구는 동물의 행동실험이 필수적임에도 불구하고 무거운 초음파 소자 때문에 쥐를 고정 및 마취해야만 했다.
연구팀은 미소 전자 기계 시스템(MEMS) 기술을 통한 정전용량 미세 초음파 소자(CMUT)의 초소형, 초경량화를 연구했다. 쥐의 구조에 맞는 중심 주파수, 크기, 초점 거리, 초음파 세기를 갖는 1g 미만의 소자와 행동실험에 적합한 실험 장치를 제작했다.
연구팀은 초음파 소자의 성능 평가를 위해 쥐 뇌의 운동 피질 (motor cortex)을 자극해 쥐의 앞발이 움직이는 운동 반응을 확인하고 승모근의 근전도를 측정했다.
연구팀은 초음파의 강도를 높일수록 운동 피질을 자극할 때 나오는 쥐의 앞발이 움직이는 현상이 더 자주 발생함을 확인했다. 결과적으로 초음파가 세지면서 반응의 성공률이 높아지는 결과를 얻어냈다.
연구팀의 초음파 소자는 쥐 뇌의 3~4mm 깊이까지 초음파가 전달되고 쥐 뇌 전체 크기의 25% 영역을 자극할 수 있다. 이 교수 연구팀은 향후 자극 범위를 국소화해 소형 동물 뇌의 단일 영역도 특이적으로 자극할 수 있는 차세대 뉴로툴 기술을 개발할 계획이다.
연구팀은 움직이는 쥐의 결과를 실시간으로 얻어낸 이번 연구 결과를 토대로 초음파가 수면에 미치는 영향을 연구 중이다. 향후 수면 연구뿐 아니라 다양한 행동실험 연구에 초음파 자극 기술을 적용할 수 있을 것으로 예상된다.
이 교수는 “머리를 고정하고 마취를 매번 시켰던 동물실험 방식을 벗어나 움직이는 쥐의 초음파 뇌 자극이 처음으로 가능해졌다”라며 “향후 수면장애, 파킨슨병, 치매, 우울증 등 여러 뇌 질환의 새로운 치료법 연구와 특이적 뇌 회로 규명에 광범위하게 적용될 수 있을 것이다”라고 말했다.
이번 연구는 과학기술정보통신부 뇌과학원천기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 행동실험이 가능한 초소형 비침습 초음파 자극 장치
그림2. 정전용량형 미세 초음파 소자의 (a-c) 구조 및 (d) 2D 시뮬레이션 빔 형
이현주 교수(전기및전자공학부), 움직이는 쥐에 초음파 뇌 자극 실험 성공
우리 대학 전기및전자공학부 이현주 교수 연구팀이 초소형화 및 초경량화한 미세 초음파 소자(CMUT)를 통해 자유롭게 움직이는 쥐의 뇌에 초음파 자극을 줄 수 있는 기술을 개발했다.
이 교수 연구팀은 1g 미만의 초경량 초음파 소자 개발을 통해 움직이는 쥐의 뇌 초음파 결과를 얻는 데 성공했다. 이는 쥐 무게의 6배에 달하는 초음파 변환기를 사용해 움직이는 쥐에 적용할 수 없었던 기존 기술의 한계를 극복한 것이다.
김형국 석사가 주도하고 김성연 석사과정과 덴마크 공과대학교 (DTU) 티어샤(Thielscher) 교수 연구팀이 참여한 이번 연구는 국제 학술지 ‘브레인 스티뮬레이션(Brain Stimulation)’ 11월 17일자 온라인판에 게재됐고, 3월자 12권 2호에 출판될 예정이다. (논문명 : 자유롭게 움직이는 동물에서 비침습 뇌자극이 가능한 초소형 초음파 링 변환자 어레이, Miniature ultrasound ring array transducers for transcranial ultrasound neuromodulation of freely-moving small animals)
최근 뇌 자극 기술로 비침습적이고 집속이 가능한 초음파 자극 기술이 차세대 뇌 자극 기술로 주목받고 있다.
뇌를 자극하는 기존 방법에는 뇌의 특정 영역을 미세 자극할 수 있는 심부뇌자극술(DBS)과 광유전학 기반의 광 자극이 있지만 침습도가 높아 임상에 적용이 어렵다. 경두개전기자극술(TES)과 경두개자기자극술(TMS) 등은 비침습적이지만 자극 부위가 넓고 심부 자극이 불가능해 적용 범위에 한계가 있다.
초음파는 비침습적이기 때문에 동물실험뿐만 아니라 인체에도 안전하게 적용할 수 있어 임상 시험에 활용된다. 또한 초음파 집속을 통해 국소부위 자극과 심부 자극이 모두 가능해 타 기술 대비 이점이 많다.
초음파 뇌 자극 기술은 개발 초기 단계이기 때문에 지금까지는 쥐를 고정한 상태에서의 연구 결과만 발표됐다. 뇌 자극 관련 연구는 동물의 행동실험이 필수적임에도 불구하고 무거운 초음파 소자 때문에 쥐를 고정 및 마취해야만 했다.
연구팀은 미소 전자 기계 시스템(MEMS) 기술을 통한 정전용량 미세 초음파 소자(CMUT)의 초소형, 초경량화를 연구했다. 쥐의 구조에 맞는 중심 주파수, 크기, 초점 거리, 초음파 세기를 갖는 1g 미만의 소자와 행동실험에 적합한 실험 장치를 제작했다.
연구팀은 초음파 소자의 성능 평가를 위해 쥐 뇌의 운동 피질 (motor cortex)을 자극해 쥐의 앞발이 움직이는 운동 반응을 확인하고 승모근의 근전도를 측정했다.
연구팀은 초음파의 강도를 높일수록 운동 피질을 자극할 때 나오는 쥐의 앞발이 움직이는 현상이 더 자주 발생함을 확인했다. 결과적으로 초음파가 세지면서 반응의 성공률이 높아지는 결과를 얻어냈다.
연구팀의 초음파 소자는 쥐 뇌의 3~4mm 깊이까지 초음파가 전달되고 쥐 뇌 전체 크기의 25% 영역을 자극할 수 있다. 이 교수 연구팀은 향후 자극 범위를 국소화해 소형 동물 뇌의 단일 영역도 특이적으로 자극할 수 있는 차세대 뉴로툴 기술을 개발할 계획이다.
연구팀은 움직이는 쥐의 결과를 실시간으로 얻어낸 이번 연구 결과를 토대로 초음파가 수면에 미치는 영향을 연구 중이다. 향후 수면 연구뿐 아니라 다양한 행동실험 연구에 초음파 자극 기술을 적용할 수 있을 것으로 예상된다.
이 교수는 “머리를 고정하고 마취를 매번 시켰던 동물실험 방식을 벗어나 움직이는 쥐의 초음파 뇌 자극이 처음으로 가능해졌다”라며 “향후 수면장애, 파킨슨병, 치매, 우울증 등 여러 뇌 질환의 새로운 치료법 연구와 특이적 뇌 회로 규명에 광범위하게 적용될 수 있을 것이다”라고 말했다.
이번 연구는 과학기술정보통신부 뇌과학원천기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 행동실험이 가능한 초소형 비침습 초음파 자극 장치
그림2. 정전용량형 미세 초음파 소자의 (a-c) 구조 및 (d) 2D 시뮬레이션 빔 형
2019.02.11
조회수 14683
-
 조광현 교수, 뇌파 생성, 변조 담당하는 신경회로 원리 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌파의 생성 및 변조를 담당하는 핵심 신경회로를 규명하는 데 성공했다.
이를 통해 뇌의 동작원리를 밝힐 뿐 아니라 향후 여러 뇌질환 환자에게서 발생하는 비정상적 뇌파활동을 신경세포 네트워크 수준에서 규명하는 데 활용 가능할 것으로 기대된다. 이번 연구는 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명했다는 의미를 갖는다.
이병욱 박사과정, 신동관 박사, 스티븐 그로스 박사가 함께 참여한 이번 연구는 국제 학술지 ‘셀 리포트(Cell Reports)’ 11월 6일자 온라인 판에 게재됐다.
뇌의 다양한 기능은 신경세포(뉴런) 사이의 복잡한 상호작용을 통해 이뤄진다. 특히 뉴런들의 동시다발적인 발화에 의해 형성되는 뇌파는 뇌의 활동 상태를 측정하는 가장 중요한 지표이며, 특정 기능을 수행하기 위해 영역 간 선택적 통신의 매개체 역할을 하는 것으로 알려져 있다.
또한 뇌파의 비정상적인 생성 및 변조 현상은 다양한 뇌질환과 밀접한 관계를 갖는 것으로 밝혀지고 있다. 이에 따라 전 세계 신경생물학 연구자들은 뇌파의 생성 및 변조 원리를 파악하기 위해 노력해 왔다.
그러나 뇌파의 생성 및 변조는 수많은 뉴런 사이의 복잡한 상호작용을 통해 발생하는 예측할 수 없는 창발적 특성(emergent property)을 갖기 때문에 기존의 신경 생물학 실험을 통해 그 원리를 규명하기에는 한계가 있었다.
조 교수 연구팀은 시스템생물학 기반의 연구방법을 통해 뇌파의 생성 및 변조 원리를 분석했다. 연구팀은 여러 뇌 영역 중 특히 감각 피질(sensory cortex)에 주목했다. 감각 피질은 외부 감각 정보를 처리하고 통합, 조절하는 핵심 영역으로 여러 주파수 대역의 뇌파와 변조를 관측할 수 있다.
연구팀은 최근 커넥토믹스 (connectomics) 연구를 통해 밝혀진 쥐의 감각피질 내 뉴런의 종류 및 뉴런 간 연결성 정보를 이용해 감각피질을 구성하는 뉴런들과 이들을 연결하는 시냅스를 수학 모델을 통해 표현하고 이로부터 신경회로를 구축해 뇌파의 생성 및 변조 과정을 분석했다.
연구팀은 대규모 컴퓨터 시뮬레이션 분석을 통해 흥분성 뉴런과 억제성 뉴런으로 구성된 양성피드백과 음성피드백의 중첩된 구조(interlinked positive and negative feedback)가 뇌파의 생성 및 주파수 변조 현상의 핵심회로임을 최초로 규명했다.
특히 연구팀은 기존의 전기생리학 실험을 통해 측정된 뉴런 간 시냅스의 특정 연결강도가 신경회로의 뇌파 생성 및 변조 기능을 극대화시킬 수 있는 최적의 조합임을 밝혀냈다.
이번에 개발한 수학모형을 활용하면 전통적 생물학 실험을 통해 파악이 어려웠던 뉴런들 간의 다양한 상호작용을 이해하고 신경회로의 복잡한 설계원리를 파악할 수 있을 것으로 기대된다.
또한 여러 뇌질환 환자의 뇌에서 관측되는 비정상적인 뇌파 활동을 신경네트워크 차원에서 분석하고 규명할 수 있을 것으로 예상된다.
시스템생물학 접근을 통한 신경회로의 구조 및 기능 분석은 인공지능의 발전에도 기여할 것으로 기대된다. 두뇌 신경회로의 작동원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다. 자폐증이나 집중력 조절장애 등과 관련된 신경회로 규명, 두뇌 치료 기술 개발 등의 원천 의료기술 개발에도 혁신으로 이어질 수 있다.
조 교수는 “지금껏 뇌파의 생성 및 변조를 담당하는 핵심 신경회로가 밝혀진 바가 없었다”며 “이번 연구에서는 최근 커넥토믹스 (connectomcis) 연구를 통해 점차 밝혀지고 있는 뉴런간의 복잡한 연결성에 숨겨진 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작원리를 파악할 수 있는 새로운 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, 그리고 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뉴런 간 연결 강도에 내제된 기능적 설계원리 파악
그림2. 뇌파의 생성 및 변조를 담당하는 핵심 신경회로
조광현 교수, 뇌파 생성, 변조 담당하는 신경회로 원리 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌파의 생성 및 변조를 담당하는 핵심 신경회로를 규명하는 데 성공했다.
이를 통해 뇌의 동작원리를 밝힐 뿐 아니라 향후 여러 뇌질환 환자에게서 발생하는 비정상적 뇌파활동을 신경세포 네트워크 수준에서 규명하는 데 활용 가능할 것으로 기대된다. 이번 연구는 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명했다는 의미를 갖는다.
이병욱 박사과정, 신동관 박사, 스티븐 그로스 박사가 함께 참여한 이번 연구는 국제 학술지 ‘셀 리포트(Cell Reports)’ 11월 6일자 온라인 판에 게재됐다.
뇌의 다양한 기능은 신경세포(뉴런) 사이의 복잡한 상호작용을 통해 이뤄진다. 특히 뉴런들의 동시다발적인 발화에 의해 형성되는 뇌파는 뇌의 활동 상태를 측정하는 가장 중요한 지표이며, 특정 기능을 수행하기 위해 영역 간 선택적 통신의 매개체 역할을 하는 것으로 알려져 있다.
또한 뇌파의 비정상적인 생성 및 변조 현상은 다양한 뇌질환과 밀접한 관계를 갖는 것으로 밝혀지고 있다. 이에 따라 전 세계 신경생물학 연구자들은 뇌파의 생성 및 변조 원리를 파악하기 위해 노력해 왔다.
그러나 뇌파의 생성 및 변조는 수많은 뉴런 사이의 복잡한 상호작용을 통해 발생하는 예측할 수 없는 창발적 특성(emergent property)을 갖기 때문에 기존의 신경 생물학 실험을 통해 그 원리를 규명하기에는 한계가 있었다.
조 교수 연구팀은 시스템생물학 기반의 연구방법을 통해 뇌파의 생성 및 변조 원리를 분석했다. 연구팀은 여러 뇌 영역 중 특히 감각 피질(sensory cortex)에 주목했다. 감각 피질은 외부 감각 정보를 처리하고 통합, 조절하는 핵심 영역으로 여러 주파수 대역의 뇌파와 변조를 관측할 수 있다.
연구팀은 최근 커넥토믹스 (connectomics) 연구를 통해 밝혀진 쥐의 감각피질 내 뉴런의 종류 및 뉴런 간 연결성 정보를 이용해 감각피질을 구성하는 뉴런들과 이들을 연결하는 시냅스를 수학 모델을 통해 표현하고 이로부터 신경회로를 구축해 뇌파의 생성 및 변조 과정을 분석했다.
연구팀은 대규모 컴퓨터 시뮬레이션 분석을 통해 흥분성 뉴런과 억제성 뉴런으로 구성된 양성피드백과 음성피드백의 중첩된 구조(interlinked positive and negative feedback)가 뇌파의 생성 및 주파수 변조 현상의 핵심회로임을 최초로 규명했다.
특히 연구팀은 기존의 전기생리학 실험을 통해 측정된 뉴런 간 시냅스의 특정 연결강도가 신경회로의 뇌파 생성 및 변조 기능을 극대화시킬 수 있는 최적의 조합임을 밝혀냈다.
이번에 개발한 수학모형을 활용하면 전통적 생물학 실험을 통해 파악이 어려웠던 뉴런들 간의 다양한 상호작용을 이해하고 신경회로의 복잡한 설계원리를 파악할 수 있을 것으로 기대된다.
또한 여러 뇌질환 환자의 뇌에서 관측되는 비정상적인 뇌파 활동을 신경네트워크 차원에서 분석하고 규명할 수 있을 것으로 예상된다.
시스템생물학 접근을 통한 신경회로의 구조 및 기능 분석은 인공지능의 발전에도 기여할 것으로 기대된다. 두뇌 신경회로의 작동원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다. 자폐증이나 집중력 조절장애 등과 관련된 신경회로 규명, 두뇌 치료 기술 개발 등의 원천 의료기술 개발에도 혁신으로 이어질 수 있다.
조 교수는 “지금껏 뇌파의 생성 및 변조를 담당하는 핵심 신경회로가 밝혀진 바가 없었다”며 “이번 연구에서는 최근 커넥토믹스 (connectomcis) 연구를 통해 점차 밝혀지고 있는 뉴런간의 복잡한 연결성에 숨겨진 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작원리를 파악할 수 있는 새로운 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, 그리고 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뉴런 간 연결 강도에 내제된 기능적 설계원리 파악
그림2. 뇌파의 생성 및 변조를 담당하는 핵심 신경회로
2018.11.14
조회수 18788
-
 고현용 연구원, 뇌전증 동반하는 소아 뇌종양 근본원인 밝혀
〈 고 현 용 연구원 〉
우리 대학 의과학대학원 고현용 연구원(지도교수 : 이정호 교수)이 난치성 뇌전증(간질 발작)을 일으키는 소아 뇌종양의 근본 원인과 뇌전증 발생의 원리를 규명해 새로운 치료법을 제시했다.
이번 연구 결과를 통해 수술 치료에 어려움이 있는 소아 뇌종양 기반의 난치성 뇌전증 치료에 큰 기여를 할 수 있을 것으로 기대된다.
고현용 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 메디슨(Nature Medicine)’ 9월 17일자 온라인 판에 게재됐다. (논문명: 비라프 체성 돌연변이가 소아뇌종양의 본질적 뇌전증 발생에 기여함; BRAF somatic mutation contributes to intrinsic epileptogenicity in pediatric brain tumors)
소아 뇌종양은 성인 뇌종양에 비해 난치성 뇌전증이 빈번하게 동반되는 특징을 갖고 있다. 그러나 소아 뇌종양에서 특이적으로 난치성 뇌전증이 발생하는 원인에 대해서는 밝혀진 바가 없으며 현존하는 항 뇌전증 약물에 반응하지 않기 때문에 환자의 치료에 많은 어려움을 겪고 있다.
연구팀은 소아 뇌종양 환지 뇌 조직 및 동물 모델의 분자 유전학적 분석을 통해 태아의 뇌 발달과정 중 신경 줄기 세포에 ‘비라프 (BRAF V600E)’라는 돌연변이가 발생하면서 난치성 뇌전증이 동반된 소아 뇌종양이 발생하는 것을 규명했다.
연구팀은 뇌전증이 동반된 소아 뇌종양 중 하나인 신경절 교세포종 환자의 종양 조직을 분자 유전학적으로 분석한 결과 비라프 유전변이가 태아 뇌 발달 과정 중 발생함을 확인했다.
이 변이를 동물 모델에서 구현해 신경절 교세포종의 병리 양상을 재현하고 발작을 관찰해 소아 뇌종양 기반의 뇌전증 치료용 동물 모델을 최초로 확립했다.
이를 이용해 면역 염색 분석과 전사체 분석을 실시했다. 소아 뇌종양에서 발생하는 난치성 뇌전증이 신경세포에 존재하는 비라프 변이로 인해 발생하고, 교세포에 존재하는 변이는 종양 덩어리를 형성하는데 중요한 역할을 하는 것을 확인했다.
특히 현재 임상에서 항암제로 사용되고 있는 비라프의 저해제를 동물 모델에 주입해 난치성 뇌전증 치료 효과를 확인했다.
1저자인 고현용 연구원은 “소아 뇌종양 환자의 경 줄기 세포에서 발생한 특정 돌연변이가 난치성 뇌전증 발생에 핵심적 역할을 한다는 것을 국내 연구진이 최초로 발견해냈다는 것에 큰 의미가 있다”며 “소아 뇌종양으로 인해 발생한 난치성 뇌전증의 근본 원인을 규명해 과적 치료의 가능성을 처음으로 보여준 것이다”고 말했다.
연구팀은 교원창업기업(소바젠, 대표 김병태)을 통해 소아 뇌종양 기반의 난치성 뇌전증 치료약 개발에 나설 예정이다.
이번 연구는 연세대학교 의과대학 세브란스 병원 김동석, 김세훈, 강훈철 교수 연구팀과 공동 연구 및 서경배과학재단, 보건복지부 세계선도과학자육성사업의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 수술전 (PreOP) 과 수술후 (PostOP) 의 신경절 교세포종의 MRI사진과 이형성이 동반된 신경세포가 있는 병리 조직 사진
그림2. BRAF V600E 돌연변이가 발생하여 뇌전증 동반 소아 뇌종양을 유발하는 과정 모식도
고현용 연구원, 뇌전증 동반하는 소아 뇌종양 근본원인 밝혀
〈 고 현 용 연구원 〉
우리 대학 의과학대학원 고현용 연구원(지도교수 : 이정호 교수)이 난치성 뇌전증(간질 발작)을 일으키는 소아 뇌종양의 근본 원인과 뇌전증 발생의 원리를 규명해 새로운 치료법을 제시했다.
이번 연구 결과를 통해 수술 치료에 어려움이 있는 소아 뇌종양 기반의 난치성 뇌전증 치료에 큰 기여를 할 수 있을 것으로 기대된다.
고현용 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 메디슨(Nature Medicine)’ 9월 17일자 온라인 판에 게재됐다. (논문명: 비라프 체성 돌연변이가 소아뇌종양의 본질적 뇌전증 발생에 기여함; BRAF somatic mutation contributes to intrinsic epileptogenicity in pediatric brain tumors)
소아 뇌종양은 성인 뇌종양에 비해 난치성 뇌전증이 빈번하게 동반되는 특징을 갖고 있다. 그러나 소아 뇌종양에서 특이적으로 난치성 뇌전증이 발생하는 원인에 대해서는 밝혀진 바가 없으며 현존하는 항 뇌전증 약물에 반응하지 않기 때문에 환자의 치료에 많은 어려움을 겪고 있다.
연구팀은 소아 뇌종양 환지 뇌 조직 및 동물 모델의 분자 유전학적 분석을 통해 태아의 뇌 발달과정 중 신경 줄기 세포에 ‘비라프 (BRAF V600E)’라는 돌연변이가 발생하면서 난치성 뇌전증이 동반된 소아 뇌종양이 발생하는 것을 규명했다.
연구팀은 뇌전증이 동반된 소아 뇌종양 중 하나인 신경절 교세포종 환자의 종양 조직을 분자 유전학적으로 분석한 결과 비라프 유전변이가 태아 뇌 발달 과정 중 발생함을 확인했다.
이 변이를 동물 모델에서 구현해 신경절 교세포종의 병리 양상을 재현하고 발작을 관찰해 소아 뇌종양 기반의 뇌전증 치료용 동물 모델을 최초로 확립했다.
이를 이용해 면역 염색 분석과 전사체 분석을 실시했다. 소아 뇌종양에서 발생하는 난치성 뇌전증이 신경세포에 존재하는 비라프 변이로 인해 발생하고, 교세포에 존재하는 변이는 종양 덩어리를 형성하는데 중요한 역할을 하는 것을 확인했다.
특히 현재 임상에서 항암제로 사용되고 있는 비라프의 저해제를 동물 모델에 주입해 난치성 뇌전증 치료 효과를 확인했다.
1저자인 고현용 연구원은 “소아 뇌종양 환자의 경 줄기 세포에서 발생한 특정 돌연변이가 난치성 뇌전증 발생에 핵심적 역할을 한다는 것을 국내 연구진이 최초로 발견해냈다는 것에 큰 의미가 있다”며 “소아 뇌종양으로 인해 발생한 난치성 뇌전증의 근본 원인을 규명해 과적 치료의 가능성을 처음으로 보여준 것이다”고 말했다.
연구팀은 교원창업기업(소바젠, 대표 김병태)을 통해 소아 뇌종양 기반의 난치성 뇌전증 치료약 개발에 나설 예정이다.
이번 연구는 연세대학교 의과대학 세브란스 병원 김동석, 김세훈, 강훈철 교수 연구팀과 공동 연구 및 서경배과학재단, 보건복지부 세계선도과학자육성사업의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 수술전 (PreOP) 과 수술후 (PostOP) 의 신경절 교세포종의 MRI사진과 이형성이 동반된 신경세포가 있는 병리 조직 사진
그림2. BRAF V600E 돌연변이가 발생하여 뇌전증 동반 소아 뇌종양을 유발하는 과정 모식도
2018.09.18
조회수 12384
 두뇌 인지 기능 조절하는 신경 펩타이드 발견
우리 대학 생명과학과 이승희 교수 연구팀이 두뇌에 존재하는 신경 펩타이드 중 하나인 소마토스타틴(somatostatin)이 두뇌 인지 기능을 높일 수 있음을 밝혔다.
이 교수 연구팀은 특정 가바(뇌세포 대사 기능을 억제 신경 안정 작용을 하는 신경 전달 억제 물질) 분비 신경 세포에서 분비되는 펩타이드 중 하나인 소마토스태틴이 시각 피질의 정보 처리 과정을 조절하고 높일 수 있음을 규명했다. 이번 연구 성과는 치매 등의 뇌 질환에서 인지 능력 회복을 위한 치료제 개발의 계기가 될 것으로 기대된다.
생명과학과 송유향 박사, 황양선 석사, 바이오및뇌공학과 김관수 박사과정, 서울대학교 의과학대학 이형로 박사과정이 공동 1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘사이언스 어드밴시스 (Science Advances)’ 4월 22일 자 온라인판에 게재됐다(논문명 : Somatostatin enhances visual processing and perception by modulating excitatory inputs to the parvalbumin-positive interneurons in V1).
2019년 기준 국내 65세 이상 노인 중 10명 중 1명은 치매 질환을 갖고 있다. 치매는 기억력 손실, 인지 기능 및 운동기능 저하 등의 일상생활 장애를 유발해 그 심각성은 나날이 두드러지고 있다.
이승희 교수 연구팀은 치매의 한 종류인 알츠하이머 질환 환자의 뇌척수액에서 소마토스타틴의 발현율이 현저히 감소했다는 점에 주목해 소마토스타틴에 의한 인지 능력 회복 가능성을 밝히는 연구를 수행했다.
소마토스타틴은 인간을 포함한 포유류의 중추신경계에서 존재한다. 특히 정상적인 포유류의 대뇌 피질에서 소마토스타틴을 발현하는 신경 세포인 가바(GABA, γ-aminobutyric acid)를 신경전달물질로 분비해 흥분성 신경 세포의 활성을 억제함으로써 정보 처리 정도를 조율한다.
그러나 기존 연구는 가바의 효과에만 국한돼, 동시에 분비될 수 있는 신경 펩타이드인 소마토스타틴의 고유한 효과 관련 연구는 부족한 상황이다.
연구팀은 자유롭게 움직이는 실험용 생쥐에서 시각정보 인지 및 식별 능력을 측정할 수 있는 실험 장비를 개발 및 도입했다. 이를 통해 생쥐의 시각피질 또는 뇌척수액에 소마토스타틴을 직접 주입한 후 이를 관찰해 생쥐의 시각정보 인지 능력이 현저히 증가함을 발견했다.
나아가 소마토스타틴의 처리에 따른 생체 내 또는 뇌 절편에서의 신경 세포 간 신경전달 효율의 변화를 측정하고, 해당 신경망을 연속 볼록면 주사전자현미경(SBEM)으로 관찰해 소마토스타틴에 의한 시각인지 기능의 향상이 이루어지는 생체 내 신경 생리적 원리를 규명했다.
이러한 연구 성과는 향후 인간을 비롯한 포유류의 두뇌 인지 기능을 조절 가능할 수 있을 뿐 아니라 퇴행성 뇌 질환 등에서 나타나는 인지 기능 장애 치료에 폭넓게 응용 및 적용될 수 있을 것으로 기대된다.
이승희 교수는 “이번 연구는 두뇌 기능을 높이고, 뇌 질환을 치료할 수 있는 새로운 약물 개발로 이어질 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 한국연구재단 중견연구자 지원사업의 지원을 받아 수행됐다.
2020.04.23 조회수 16126
두뇌 인지 기능 조절하는 신경 펩타이드 발견
우리 대학 생명과학과 이승희 교수 연구팀이 두뇌에 존재하는 신경 펩타이드 중 하나인 소마토스타틴(somatostatin)이 두뇌 인지 기능을 높일 수 있음을 밝혔다.
이 교수 연구팀은 특정 가바(뇌세포 대사 기능을 억제 신경 안정 작용을 하는 신경 전달 억제 물질) 분비 신경 세포에서 분비되는 펩타이드 중 하나인 소마토스태틴이 시각 피질의 정보 처리 과정을 조절하고 높일 수 있음을 규명했다. 이번 연구 성과는 치매 등의 뇌 질환에서 인지 능력 회복을 위한 치료제 개발의 계기가 될 것으로 기대된다.
생명과학과 송유향 박사, 황양선 석사, 바이오및뇌공학과 김관수 박사과정, 서울대학교 의과학대학 이형로 박사과정이 공동 1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘사이언스 어드밴시스 (Science Advances)’ 4월 22일 자 온라인판에 게재됐다(논문명 : Somatostatin enhances visual processing and perception by modulating excitatory inputs to the parvalbumin-positive interneurons in V1).
2019년 기준 국내 65세 이상 노인 중 10명 중 1명은 치매 질환을 갖고 있다. 치매는 기억력 손실, 인지 기능 및 운동기능 저하 등의 일상생활 장애를 유발해 그 심각성은 나날이 두드러지고 있다.
이승희 교수 연구팀은 치매의 한 종류인 알츠하이머 질환 환자의 뇌척수액에서 소마토스타틴의 발현율이 현저히 감소했다는 점에 주목해 소마토스타틴에 의한 인지 능력 회복 가능성을 밝히는 연구를 수행했다.
소마토스타틴은 인간을 포함한 포유류의 중추신경계에서 존재한다. 특히 정상적인 포유류의 대뇌 피질에서 소마토스타틴을 발현하는 신경 세포인 가바(GABA, γ-aminobutyric acid)를 신경전달물질로 분비해 흥분성 신경 세포의 활성을 억제함으로써 정보 처리 정도를 조율한다.
그러나 기존 연구는 가바의 효과에만 국한돼, 동시에 분비될 수 있는 신경 펩타이드인 소마토스타틴의 고유한 효과 관련 연구는 부족한 상황이다.
연구팀은 자유롭게 움직이는 실험용 생쥐에서 시각정보 인지 및 식별 능력을 측정할 수 있는 실험 장비를 개발 및 도입했다. 이를 통해 생쥐의 시각피질 또는 뇌척수액에 소마토스타틴을 직접 주입한 후 이를 관찰해 생쥐의 시각정보 인지 능력이 현저히 증가함을 발견했다.
나아가 소마토스타틴의 처리에 따른 생체 내 또는 뇌 절편에서의 신경 세포 간 신경전달 효율의 변화를 측정하고, 해당 신경망을 연속 볼록면 주사전자현미경(SBEM)으로 관찰해 소마토스타틴에 의한 시각인지 기능의 향상이 이루어지는 생체 내 신경 생리적 원리를 규명했다.
이러한 연구 성과는 향후 인간을 비롯한 포유류의 두뇌 인지 기능을 조절 가능할 수 있을 뿐 아니라 퇴행성 뇌 질환 등에서 나타나는 인지 기능 장애 치료에 폭넓게 응용 및 적용될 수 있을 것으로 기대된다.
이승희 교수는 “이번 연구는 두뇌 기능을 높이고, 뇌 질환을 치료할 수 있는 새로운 약물 개발로 이어질 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 한국연구재단 중견연구자 지원사업의 지원을 받아 수행됐다.
2020.04.23 조회수 16126 포유류 종마다 시각 뇌신경망 구조 다른 원인 밝혀
바이오및뇌공학과 백세범 교수 연구팀이 포유류 종들의 시각피질에서 서로 다른 뇌신경망 구조가 형성되는 원리를 밝혔다.
이번 연구결과는 시스템 뇌신경과학 분야에서 수십 년간 설명되지 못했던 문제를 이론적 접근과 계산적 모델 시뮬레이션을 통해 해답을 제시한 계산뇌과학 연구의 성공적인 예시로 평가된다.
연구팀은 두뇌의 시각피질과 망막에 분포하는 신경세포들 간의 정보 추출 비율을 분석함으로써 특정 포유류 종이 갖는 시각피질의 기능적 구조를 예측할 수 있음을 밝혀냈다.
연구팀은 서로 다른 크기의 망막과 시각피질 사이의 신경망 연결 모델을 시뮬레이션 해 두 정보 처리 영역 사이에 대응되는 신경세포의 비율이 달라짐에 따라 완전히 다른 두 가지 구조의 기능성 뇌지도가 형성됨을 보이고, 이 결과가 실제 실험에서 관측되는 신경망 구조와 일치함을 증명했다.
장재선, 송민 박사과정이 공동 1저자로 참여한 이번 연구는 국제 학술지 ‘셀(cell)’의 온라인 자매지 ‘셀 리포츠(Cell Reports)’ 3월 10일 자에 게재됐다. (논문명 : Retino-cortical mapping ratio predicts columnar and salt-and-pepper organization in mammalian visual cortex)
포유류의 시각피질에서는 시각 자극의 방향에 따라 반응의 정도가 달라지는 성질인 방향 선택성(orientation selectivity)을 갖는 세포들이 관측된다. 원숭이, 고양이 등의 종에서는 이 세포들의 선호 방향이 연속적, 주기적인 형태로 변하는 방향성 지도(orientation map) 구조를 형성하는 반면, 생쥐 등의 설치류에서는 마치 소금과 후추를 뿌려 놓은 듯한 무작위에 가까운 형태로 분포해, 이를 소금-후추 구조(salt-and-pepper organization)라 한다.
동일한 역할을 수행하는 것으로 보이는 기능성 뇌신경망이 이렇게 종에 따라 다른 구조를 갖는 원인을 찾기 위해 지난 수십여 년 간 다양한 연구가 진행됐으나, 아직까지도 이를 결정하는 요인에 대해서는 명확하게 알려진 바가 없었다.
이러한 원리를 규명하기 위해 연구팀은 서로 다른 크기의 망막과 시각피질이 연결될 때 동일한 망막 신호를 샘플링하는 시각피질 세포의 비율이 달라지게 된다고 가정했다. 이러한 조건에서 망막-시각피질 신호의 샘플링 형태를 시뮬레이션 하여 샘플링 비율에 따라 시각피질에서 형성되는 기능성 지도의 구조가 완전히 다르게 결정될 수 있음을 발견했다.
이 결과를 기반으로 연구팀은 다양한 종들에 대한 망막 및 시각피질 데이터를 종합적으로 비교해 시각피질이 클수록, 또 망막이 작을수록 연속적인 방향성 지도가 형성되는 경향이 있음을 확인했다.
또한, 기존의 연구에서 확인된 포유류 여덟 종의 시각피질-망막 크기 비율을 기반으로 한 모델을 정량적으로 시뮬레이션하고, 이 결과가 실험에서 관측된 것과 같이 방향성 지도 존재 여부에 따라 두 그룹으로 명확히 나누어짐을 확인했다.
이러한 결과는 다른 종으로 진화가 이뤄질 때, 감각기관의 크기와 같은 지극히 단순한 물리적인 조건의 차이에 의해서도 뇌신경망의 구조가 완전히 다른 방향으로 변화될 수 있음을 뜻한다. 이는 다양한 생물학적 구조가 기존의 생각보다 훨씬 단순한 물리적 요소들의 차이에 의해 예측되거나 설명될 수 있음을 보여준다.
백세범 교수는 “이미 오랫동안 알려져 있었으나 그 의미를 찾아내지 못했던 데이터들과 이론적인 모델을 결합해 새로운 발견을 도출해낸 의미 있는 연구이다”라며 “뇌 과학뿐만 아니라 계통분류학, 진화생물학 등 생물의 기능적 구조와 관련된 다양한 생물학 분야에서 이론적 모델 연구의 역할에 대한 중요한 시각을 제공할 것이다”라고 언급했다.
이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업의 지원을 받아 수행됐다.
2020.03.11 조회수 14877
포유류 종마다 시각 뇌신경망 구조 다른 원인 밝혀
바이오및뇌공학과 백세범 교수 연구팀이 포유류 종들의 시각피질에서 서로 다른 뇌신경망 구조가 형성되는 원리를 밝혔다.
이번 연구결과는 시스템 뇌신경과학 분야에서 수십 년간 설명되지 못했던 문제를 이론적 접근과 계산적 모델 시뮬레이션을 통해 해답을 제시한 계산뇌과학 연구의 성공적인 예시로 평가된다.
연구팀은 두뇌의 시각피질과 망막에 분포하는 신경세포들 간의 정보 추출 비율을 분석함으로써 특정 포유류 종이 갖는 시각피질의 기능적 구조를 예측할 수 있음을 밝혀냈다.
연구팀은 서로 다른 크기의 망막과 시각피질 사이의 신경망 연결 모델을 시뮬레이션 해 두 정보 처리 영역 사이에 대응되는 신경세포의 비율이 달라짐에 따라 완전히 다른 두 가지 구조의 기능성 뇌지도가 형성됨을 보이고, 이 결과가 실제 실험에서 관측되는 신경망 구조와 일치함을 증명했다.
장재선, 송민 박사과정이 공동 1저자로 참여한 이번 연구는 국제 학술지 ‘셀(cell)’의 온라인 자매지 ‘셀 리포츠(Cell Reports)’ 3월 10일 자에 게재됐다. (논문명 : Retino-cortical mapping ratio predicts columnar and salt-and-pepper organization in mammalian visual cortex)
포유류의 시각피질에서는 시각 자극의 방향에 따라 반응의 정도가 달라지는 성질인 방향 선택성(orientation selectivity)을 갖는 세포들이 관측된다. 원숭이, 고양이 등의 종에서는 이 세포들의 선호 방향이 연속적, 주기적인 형태로 변하는 방향성 지도(orientation map) 구조를 형성하는 반면, 생쥐 등의 설치류에서는 마치 소금과 후추를 뿌려 놓은 듯한 무작위에 가까운 형태로 분포해, 이를 소금-후추 구조(salt-and-pepper organization)라 한다.
동일한 역할을 수행하는 것으로 보이는 기능성 뇌신경망이 이렇게 종에 따라 다른 구조를 갖는 원인을 찾기 위해 지난 수십여 년 간 다양한 연구가 진행됐으나, 아직까지도 이를 결정하는 요인에 대해서는 명확하게 알려진 바가 없었다.
이러한 원리를 규명하기 위해 연구팀은 서로 다른 크기의 망막과 시각피질이 연결될 때 동일한 망막 신호를 샘플링하는 시각피질 세포의 비율이 달라지게 된다고 가정했다. 이러한 조건에서 망막-시각피질 신호의 샘플링 형태를 시뮬레이션 하여 샘플링 비율에 따라 시각피질에서 형성되는 기능성 지도의 구조가 완전히 다르게 결정될 수 있음을 발견했다.
이 결과를 기반으로 연구팀은 다양한 종들에 대한 망막 및 시각피질 데이터를 종합적으로 비교해 시각피질이 클수록, 또 망막이 작을수록 연속적인 방향성 지도가 형성되는 경향이 있음을 확인했다.
또한, 기존의 연구에서 확인된 포유류 여덟 종의 시각피질-망막 크기 비율을 기반으로 한 모델을 정량적으로 시뮬레이션하고, 이 결과가 실험에서 관측된 것과 같이 방향성 지도 존재 여부에 따라 두 그룹으로 명확히 나누어짐을 확인했다.
이러한 결과는 다른 종으로 진화가 이뤄질 때, 감각기관의 크기와 같은 지극히 단순한 물리적인 조건의 차이에 의해서도 뇌신경망의 구조가 완전히 다른 방향으로 변화될 수 있음을 뜻한다. 이는 다양한 생물학적 구조가 기존의 생각보다 훨씬 단순한 물리적 요소들의 차이에 의해 예측되거나 설명될 수 있음을 보여준다.
백세범 교수는 “이미 오랫동안 알려져 있었으나 그 의미를 찾아내지 못했던 데이터들과 이론적인 모델을 결합해 새로운 발견을 도출해낸 의미 있는 연구이다”라며 “뇌 과학뿐만 아니라 계통분류학, 진화생물학 등 생물의 기능적 구조와 관련된 다양한 생물학 분야에서 이론적 모델 연구의 역할에 대한 중요한 시각을 제공할 것이다”라고 언급했다.
이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업의 지원을 받아 수행됐다.
2020.03.11 조회수 14877 허원도 교수, 머리에 빛 비춰 기억 및 공감능력 향상 기술 개발
우리 대학 생명과학과 허원도 교수 연구팀이 머리에 빛을 비춰 뇌신경세포 내 칼슘 농도를 조절함으로써 공간기억 및 공감 능력을 높이는 비침습적인 기술을 개발했다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 10일 자 온라인 판에 게재됐다.
칼슘은 세포 기능에 중요한 물질로, 세포 이동, 분열, 유전자 발현, 신경 전달 물질 분비, 항상성 유지 등에 폭넓게 관여한다. 세포가 제 기능을 잘 수행하기 위해서는 세포 내 칼슘 농도가 적절하게 조절돼야 한다.
세포 내 칼슘 양이 부족해지면 인지장애, 심장부정맥 등 다양한 질환으로 이어질 수 있다. 허원도 교수 연구팀은 이전 연구에서 세포에 빛을 비춰 세포 내 칼슘 농도를 조절하는 옵토스팀원(OptoSTIM1) 기술을 개발하여 네이처 바오이테크놀로지(Nature Biotechnology) 2015년 9월호 표지논문으로 보고한 바 있다.
옵토스팀원(OptoSTIM1) 기술은 빛을 이용하여 비침습적으로 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 쥐 머리에 청색 빛을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 세포의 칼슘 통로를 열면 세포 내로 칼슘이 유입된다. 외과적 시술에 비해 비침습적이긴 하나, 옵토스팀원(OptoSTIM1) 기술을 이용하려면 생체 내에 광섬유를 삽입해 빛을 뇌 조직 내로 전달하는 과정이 필요하다. 광섬유 삽입은 털, 피부, 머리뼈, 생체 조직 손상 및 면역력 약화 등 부작용을 유발한다는 문제점이 있다.
연구진은 옵토스팀원 기술에서 사용했던 광수용체 단백질의 유전자를 변형시킴으로써 빛에 민감도를 55배 증가시킨 몬스팀원(monSTIM1) 기술을 개발했다. 청색 빛에 대한 민감도를 크게 높여 광섬유 삽입 없이 살아있는 쥐의 머리에 손전등 강도의 빛을 쬐어주는 것만으로도 뇌신경세포의 칼슘 조절이 가능해졌다. 이를 이용해 수술 없이 살아있는 동물의 뇌신경세포의 활성화를 유도할 수 있기 때문에 향후 세포 수준뿐만 아니라 개체 수준에서의 칼슘 역할 규명이 가능할 것으로 기대된다.
연구진은 쥐의 뇌세포에 몬스팀원을 발현시키고, 뇌가 손상되지 않은 쥐의 머리 위에 청색광을 쬐어 비침습적으로 칼슘 신호를 활성화했다. 머리뼈 근처에 위치하는 뇌 피질뿐만 아니라 뇌 깊숙하게 위치한 해마와 시상까지도 칼슘 신호가 활성화됐다. 추가적으로 뇌 전대상 피질의 흥분성 신경세포에 몬스팀원 기술을 적용하여 행동 변화를 관찰했다. 살아있는 쥐에서 빛 자극을 통해 칼슘 신호가 증가하고 생쥐의 공간기억이 증가하고 공감능력이 향상됨을 관찰했다.
비침습적인 빛 자극으로 쥐의 생리학적 현상에 지장을 주지 않는 상태에서 뇌의 칼슘 신호를 실시간으로 조절할 수 있어 뇌 연구에 다양하게 적용 가능하다. 칼슘에 의한 신경 행동적인 변화에 대한 연구를 생체 모델에서 하기 위해 더 향상된 기술이다.
허원도 교수는“몬스팀원(monSTIM1) 기술을 이용하면 빛을 이용하면 뇌를 손상하지 않고 비침습적으로 세포 내 칼슘 신호를 쉽게 조작할 수 있다”라며 “이 기술이 뇌세포 칼슘 연구, 뇌인지 과학 연구 등에 다양하게 적용 되길 바란다”라고 말했다.
2020.01.22 조회수 9579
허원도 교수, 머리에 빛 비춰 기억 및 공감능력 향상 기술 개발
우리 대학 생명과학과 허원도 교수 연구팀이 머리에 빛을 비춰 뇌신경세포 내 칼슘 농도를 조절함으로써 공간기억 및 공감 능력을 높이는 비침습적인 기술을 개발했다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 10일 자 온라인 판에 게재됐다.
칼슘은 세포 기능에 중요한 물질로, 세포 이동, 분열, 유전자 발현, 신경 전달 물질 분비, 항상성 유지 등에 폭넓게 관여한다. 세포가 제 기능을 잘 수행하기 위해서는 세포 내 칼슘 농도가 적절하게 조절돼야 한다.
세포 내 칼슘 양이 부족해지면 인지장애, 심장부정맥 등 다양한 질환으로 이어질 수 있다. 허원도 교수 연구팀은 이전 연구에서 세포에 빛을 비춰 세포 내 칼슘 농도를 조절하는 옵토스팀원(OptoSTIM1) 기술을 개발하여 네이처 바오이테크놀로지(Nature Biotechnology) 2015년 9월호 표지논문으로 보고한 바 있다.
옵토스팀원(OptoSTIM1) 기술은 빛을 이용하여 비침습적으로 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 쥐 머리에 청색 빛을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 세포의 칼슘 통로를 열면 세포 내로 칼슘이 유입된다. 외과적 시술에 비해 비침습적이긴 하나, 옵토스팀원(OptoSTIM1) 기술을 이용하려면 생체 내에 광섬유를 삽입해 빛을 뇌 조직 내로 전달하는 과정이 필요하다. 광섬유 삽입은 털, 피부, 머리뼈, 생체 조직 손상 및 면역력 약화 등 부작용을 유발한다는 문제점이 있다.
연구진은 옵토스팀원 기술에서 사용했던 광수용체 단백질의 유전자를 변형시킴으로써 빛에 민감도를 55배 증가시킨 몬스팀원(monSTIM1) 기술을 개발했다. 청색 빛에 대한 민감도를 크게 높여 광섬유 삽입 없이 살아있는 쥐의 머리에 손전등 강도의 빛을 쬐어주는 것만으로도 뇌신경세포의 칼슘 조절이 가능해졌다. 이를 이용해 수술 없이 살아있는 동물의 뇌신경세포의 활성화를 유도할 수 있기 때문에 향후 세포 수준뿐만 아니라 개체 수준에서의 칼슘 역할 규명이 가능할 것으로 기대된다.
연구진은 쥐의 뇌세포에 몬스팀원을 발현시키고, 뇌가 손상되지 않은 쥐의 머리 위에 청색광을 쬐어 비침습적으로 칼슘 신호를 활성화했다. 머리뼈 근처에 위치하는 뇌 피질뿐만 아니라 뇌 깊숙하게 위치한 해마와 시상까지도 칼슘 신호가 활성화됐다. 추가적으로 뇌 전대상 피질의 흥분성 신경세포에 몬스팀원 기술을 적용하여 행동 변화를 관찰했다. 살아있는 쥐에서 빛 자극을 통해 칼슘 신호가 증가하고 생쥐의 공간기억이 증가하고 공감능력이 향상됨을 관찰했다.
비침습적인 빛 자극으로 쥐의 생리학적 현상에 지장을 주지 않는 상태에서 뇌의 칼슘 신호를 실시간으로 조절할 수 있어 뇌 연구에 다양하게 적용 가능하다. 칼슘에 의한 신경 행동적인 변화에 대한 연구를 생체 모델에서 하기 위해 더 향상된 기술이다.
허원도 교수는“몬스팀원(monSTIM1) 기술을 이용하면 빛을 이용하면 뇌를 손상하지 않고 비침습적으로 세포 내 칼슘 신호를 쉽게 조작할 수 있다”라며 “이 기술이 뇌세포 칼슘 연구, 뇌인지 과학 연구 등에 다양하게 적용 되길 바란다”라고 말했다.
2020.01.22 조회수 9579 임미희 교수, 손상된 뇌 신경교세포 회복 물질 개발
우리 대학 화학과 임미희 교수 연구팀이 손상된 뇌의 신경교세포를 회복시키는 저분자 화합물(Small molecule)을 발견했다.
연구팀의 이번 연구는 기억력 등 인지기능이 저하돼 일상생활의 장애를 유발하는 알츠하이머 등 만성질환의 치료 가능성을 제시할 수 있을 것으로 기대된다.
경북대 의대 박민희 교수가 1 저자로 참여하고 경북대 배재성, 진희경 교수가 공동 교신저자로 참여한 이번 연구는 미국 국립과학원에서 발행하는 국제 학술지 ‘PNAS’ 11월 4일 자 온라인판에 게재됐다.
퇴행성 뇌 질환인 치매의 일종인 알츠하이머병은 다양한 원인에 의해 발생된다. 이 질병을 치료하기 위해서 병의 원인을 정확히 파악하고 그에 맞는 치료제들을 개발하는 것이 무엇보다 중요하다.
아밀로이드-베타 펩타이드는 알츠하이머병과 밀접한 관계가 있다고 알려져 있다. 또한, 뇌의 신경 세포이며 면역 세포인 신경교세포는 신경염증 반응에 중추적인 역할을 한다. 최근 들어, 아밀로이드-베타 펩타이드와 신경교세포의 신경염증 반응 사이의 상관관계가 알츠하이머병을 일으킬 수 있는 주요한 원인으로 주목받고 있다.
신경교세포는 뇌에서 면역기능을 담당하는 신경세포의 일종으로, 탐식기능 및 식세포 작용을 통해 노폐물을 처리하는 역할을 한다.
연구팀은 알츠하이머 동물 모델들에게 저분자 화합물을 주입한 후, 동물들의 인지능력과 뇌 속에 존재하는 베타 아밀로이드의 양을 관찰해 알츠하이머 치료제로서 어떠한 유효한 효과가 있는지 실험했다.
이를 통해 ‘저분자 화합물’이 주입된 동물들은 손상된 신경교세포가 회복돼 뇌 속에 존재하는 베타 아밀로이드 단백질이 감소하는 등 인지능력이 향상된다는 사실을 발견했다.
임미희 교수는 “이 연구는 마이크로글리아의 식세포 작용 손상을 복구시켜 알츠하이머병을 치료할 수 있다는 것을 증명했다”라며 “발견된 합성 분자를 바탕으로 다양한 퇴행성 뇌질환의 치료제 개발에 더욱 박차를 가할 것이다”라고 말했다.
이번 연구는 한국보건산업진흥원, 한국연구재단, KAIST, 그리고 국가과학기술연구회 지원으로 수행됐다.
2019.11.25 조회수 10902
임미희 교수, 손상된 뇌 신경교세포 회복 물질 개발
우리 대학 화학과 임미희 교수 연구팀이 손상된 뇌의 신경교세포를 회복시키는 저분자 화합물(Small molecule)을 발견했다.
연구팀의 이번 연구는 기억력 등 인지기능이 저하돼 일상생활의 장애를 유발하는 알츠하이머 등 만성질환의 치료 가능성을 제시할 수 있을 것으로 기대된다.
경북대 의대 박민희 교수가 1 저자로 참여하고 경북대 배재성, 진희경 교수가 공동 교신저자로 참여한 이번 연구는 미국 국립과학원에서 발행하는 국제 학술지 ‘PNAS’ 11월 4일 자 온라인판에 게재됐다.
퇴행성 뇌 질환인 치매의 일종인 알츠하이머병은 다양한 원인에 의해 발생된다. 이 질병을 치료하기 위해서 병의 원인을 정확히 파악하고 그에 맞는 치료제들을 개발하는 것이 무엇보다 중요하다.
아밀로이드-베타 펩타이드는 알츠하이머병과 밀접한 관계가 있다고 알려져 있다. 또한, 뇌의 신경 세포이며 면역 세포인 신경교세포는 신경염증 반응에 중추적인 역할을 한다. 최근 들어, 아밀로이드-베타 펩타이드와 신경교세포의 신경염증 반응 사이의 상관관계가 알츠하이머병을 일으킬 수 있는 주요한 원인으로 주목받고 있다.
신경교세포는 뇌에서 면역기능을 담당하는 신경세포의 일종으로, 탐식기능 및 식세포 작용을 통해 노폐물을 처리하는 역할을 한다.
연구팀은 알츠하이머 동물 모델들에게 저분자 화합물을 주입한 후, 동물들의 인지능력과 뇌 속에 존재하는 베타 아밀로이드의 양을 관찰해 알츠하이머 치료제로서 어떠한 유효한 효과가 있는지 실험했다.
이를 통해 ‘저분자 화합물’이 주입된 동물들은 손상된 신경교세포가 회복돼 뇌 속에 존재하는 베타 아밀로이드 단백질이 감소하는 등 인지능력이 향상된다는 사실을 발견했다.
임미희 교수는 “이 연구는 마이크로글리아의 식세포 작용 손상을 복구시켜 알츠하이머병을 치료할 수 있다는 것을 증명했다”라며 “발견된 합성 분자를 바탕으로 다양한 퇴행성 뇌질환의 치료제 개발에 더욱 박차를 가할 것이다”라고 말했다.
이번 연구는 한국보건산업진흥원, 한국연구재단, KAIST, 그리고 국가과학기술연구회 지원으로 수행됐다.
2019.11.25 조회수 10902 서성배 교수, 당뇨에 큰 영향 미치는 뇌 혈당조절 신경세포 발견
〈 오양균 박사, 서성배 교수 〉
우리 대학 생명과학과 서성배 교수와 뉴욕대학교(NYU) 오양균 박사 공동연구팀이 초파리 모델 시스템을 이용해 뇌 속에 체내 혈당에 직접적인 기능을 하는 포도당 감지 신경세포를 발견하고 그 구체적인 원리를 밝혔다.
이번 연구는 초파리 뇌 속의 포도당 감지 신경세포가 인슐린 생산 조직 활성화, 글루카곤 생산 조직 활동 억제 등을 통해 체내 혈당 조절에 어떻게 관여하는지를 처음으로 밝혀낸 중요한 단서로, 당뇨병의 진단 및 치료에 새로운 가능성을 열 것으로 기대된다.
생명과학과 출신의 오양균 박사가 1 저자로 참여하고 서성배 교수가 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘네이처(Nature)’ 10월 23일 자 온라인판에 게재됐다. (논문명 :A glucose-sensing neuron pair regulates insulin and glucagon in Drosophila)
한국인의 당뇨병 유병률은 14%로 2018년 기준 환자 500만 명을 돌파했다. 당뇨병 증가속도 세계 1위, 잠재적 환자는 4명 중 1명꼴이지만 발병원인은 정확하게 규명되지 않았다. 유전적 요인과 환경적 요인이 존재하지만 대부분 췌장 인슐린 분비세포 기능이 저하되면서 병이 시작되는 것으로 알려져 있다.
최근에는 뇌가 당뇨병의 정도에 영향을 미칠 수 있다는 사실이 밝혀지기도 했다. 대부분 당뇨병 환자에게 스트레스가 당뇨병 증세에 영향을 미치고 혈당 조절을 어렵게 하는데 뇌 어딘가에 존재하는, 알려지지 않은 혈당 조절 능력 때문이라는 것이 학계 주장이다.
서성배 교수 연구팀은 오래전부터 초파리를 이용해 혀나 내장기관뿐 아니라 동물의 뇌 속에도 포도당을 감지하는 세포와 수용체가 존재한다는 사실을 연구해왔다. 인간 두뇌의 시상하부나 후뇌 등에 포도당을 감지하는 신경세포가 존재할 것이라는 점은 예측돼왔지만, 이런 세포들이 어떻게 포도당을 감지해 몸의 각 부위에 명령을 내리는지에 대한 연구는 지금까지 없었다.
연구팀은 초파리 전체 뇌 신경조직을 대상으로 한 광범위한 스크리닝을 통해 초파리가 포도당의 영양적 가치를 판단하는데 필수적인 한 쌍의 신경세포를 발견했다. 이 한 쌍의 신경세포가 체내 포도당 농도 증가에 반응해 활성화되는 특징을 가지고 있음을 파악했다.
연구팀은 약학적, 유전학적 방식을 사용해 이들 세포가 인간의 췌장 세포와 유사한 분자적 시스템을 통해 포도당을 인지한다는 사실을 확인했다. 이를 기반으로 연구팀은 포도당 감지 신경세포가 어떠한 신경세포 및 조직에 신호를 전달하는지에 대해 연구했다.
연구팀은 해당 신경세포가 초파리의 인슐린 생산을 담당하는 신경조직(insulin-producing cells, IPCs)과 글루카곤의 기능을 하는 단백질을 생산하는 조직(AKH-producing cells)에 각각 축삭돌기(Axon, 신경 세포체에서 뻗어 나온 돌기)를 이루고 있음을 확인했다.
이 결과는 한 쌍의 포도당 감지 신경세포가 체내 혈당 조절에 중요한 호르몬을 생산하는 조직들에 직접 체내 영양 정보를 전달할 수 있다는 가능성을 발견한 것이다.
이를 확인하기 위해서 연구팀은 포도당 감지 신경세포와 두 호르몬 분비 조직들 사이의 물리적, 기능적 상호작용들을 확인했다. 그 결과 한 쌍의 포도당 감지 신경세포가 활성화된 경우 인슐린 생산 조직 역시 활성화되며 반면에 글루카곤 생산 조직의 활동은 억제됨을 확인했다.
또한, 연구팀은 포도당 감지 신경세포를 억제할 경우 인슐린 생산 조직의 억제로 인해 혈중 인슐린 농도가 감소하며, 글루카곤 생산 조직에 대한 억제가 사라짐에 따라 혈중 글루카곤 농도가 증가 됨을 확인했다. 이들 호르몬의 변화로 인해 혈중 포도당 농도가 유의미하게 증가함을 최종적으로 확인했다.
뇌 속에 단 한 쌍의 포도당 감지 신경세포만의 활동을 조절함으로써 당뇨병의 증상을 가지는 초파리를 인위적으로 만들 수 있는 것이다.
한발 더 나아가 연구팀은 초파리에서 신경전달 기능을 하는 짧은 단백질의 한 종류인 sNPF(small Neuropeptide F)가 해당 포도당 감지 신경세포에서 발현됨을 파악하고 포도당에 노출됐을 때 이 신경전달물질이 분비됨을 확인했다. 또한, 연구팀은 인슐린 생산 조직과 글루카곤 생산 조직에서 sNPF 의 수용체가 포도당 감지 신경세포의 신호를 받는데 필수적인 역할을 함을 증명했다.
서성배 교수는 “이번 연구 결과는 초파리에서 의미 있는 발견을 했다는 사실을 넘어 당뇨병 원인 규명과 치료의 패러다임을 근본적으로 바꿀 수 있는 계기를 마련한 것이다”라며 “뇌에서 만들어지는 신호가 체내 혈당 조절에 근본적인 역할을 함이 구체적으로 규명되면 한 단계 진보된 당뇨병의 진단 및 치료뿐 아니라 비만, 대사질환 치료도 가능해질 것이다”라고 말했다.
□ 그림 설명
그림1,2. 서성배 교수 연구성과 개념도. 혈당에 반응하는 CN neuron의 Axon이 두 갈래로 갈라지며 갈라진 axonal branch는 인슐린을 만드는 세포를 활성화시키고 다른 갈라진 axonal branch는 글루카곤을 만드는 세포를 억제시킴
2019.10.24 조회수 14869
서성배 교수, 당뇨에 큰 영향 미치는 뇌 혈당조절 신경세포 발견
〈 오양균 박사, 서성배 교수 〉
우리 대학 생명과학과 서성배 교수와 뉴욕대학교(NYU) 오양균 박사 공동연구팀이 초파리 모델 시스템을 이용해 뇌 속에 체내 혈당에 직접적인 기능을 하는 포도당 감지 신경세포를 발견하고 그 구체적인 원리를 밝혔다.
이번 연구는 초파리 뇌 속의 포도당 감지 신경세포가 인슐린 생산 조직 활성화, 글루카곤 생산 조직 활동 억제 등을 통해 체내 혈당 조절에 어떻게 관여하는지를 처음으로 밝혀낸 중요한 단서로, 당뇨병의 진단 및 치료에 새로운 가능성을 열 것으로 기대된다.
생명과학과 출신의 오양균 박사가 1 저자로 참여하고 서성배 교수가 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘네이처(Nature)’ 10월 23일 자 온라인판에 게재됐다. (논문명 :A glucose-sensing neuron pair regulates insulin and glucagon in Drosophila)
한국인의 당뇨병 유병률은 14%로 2018년 기준 환자 500만 명을 돌파했다. 당뇨병 증가속도 세계 1위, 잠재적 환자는 4명 중 1명꼴이지만 발병원인은 정확하게 규명되지 않았다. 유전적 요인과 환경적 요인이 존재하지만 대부분 췌장 인슐린 분비세포 기능이 저하되면서 병이 시작되는 것으로 알려져 있다.
최근에는 뇌가 당뇨병의 정도에 영향을 미칠 수 있다는 사실이 밝혀지기도 했다. 대부분 당뇨병 환자에게 스트레스가 당뇨병 증세에 영향을 미치고 혈당 조절을 어렵게 하는데 뇌 어딘가에 존재하는, 알려지지 않은 혈당 조절 능력 때문이라는 것이 학계 주장이다.
서성배 교수 연구팀은 오래전부터 초파리를 이용해 혀나 내장기관뿐 아니라 동물의 뇌 속에도 포도당을 감지하는 세포와 수용체가 존재한다는 사실을 연구해왔다. 인간 두뇌의 시상하부나 후뇌 등에 포도당을 감지하는 신경세포가 존재할 것이라는 점은 예측돼왔지만, 이런 세포들이 어떻게 포도당을 감지해 몸의 각 부위에 명령을 내리는지에 대한 연구는 지금까지 없었다.
연구팀은 초파리 전체 뇌 신경조직을 대상으로 한 광범위한 스크리닝을 통해 초파리가 포도당의 영양적 가치를 판단하는데 필수적인 한 쌍의 신경세포를 발견했다. 이 한 쌍의 신경세포가 체내 포도당 농도 증가에 반응해 활성화되는 특징을 가지고 있음을 파악했다.
연구팀은 약학적, 유전학적 방식을 사용해 이들 세포가 인간의 췌장 세포와 유사한 분자적 시스템을 통해 포도당을 인지한다는 사실을 확인했다. 이를 기반으로 연구팀은 포도당 감지 신경세포가 어떠한 신경세포 및 조직에 신호를 전달하는지에 대해 연구했다.
연구팀은 해당 신경세포가 초파리의 인슐린 생산을 담당하는 신경조직(insulin-producing cells, IPCs)과 글루카곤의 기능을 하는 단백질을 생산하는 조직(AKH-producing cells)에 각각 축삭돌기(Axon, 신경 세포체에서 뻗어 나온 돌기)를 이루고 있음을 확인했다.
이 결과는 한 쌍의 포도당 감지 신경세포가 체내 혈당 조절에 중요한 호르몬을 생산하는 조직들에 직접 체내 영양 정보를 전달할 수 있다는 가능성을 발견한 것이다.
이를 확인하기 위해서 연구팀은 포도당 감지 신경세포와 두 호르몬 분비 조직들 사이의 물리적, 기능적 상호작용들을 확인했다. 그 결과 한 쌍의 포도당 감지 신경세포가 활성화된 경우 인슐린 생산 조직 역시 활성화되며 반면에 글루카곤 생산 조직의 활동은 억제됨을 확인했다.
또한, 연구팀은 포도당 감지 신경세포를 억제할 경우 인슐린 생산 조직의 억제로 인해 혈중 인슐린 농도가 감소하며, 글루카곤 생산 조직에 대한 억제가 사라짐에 따라 혈중 글루카곤 농도가 증가 됨을 확인했다. 이들 호르몬의 변화로 인해 혈중 포도당 농도가 유의미하게 증가함을 최종적으로 확인했다.
뇌 속에 단 한 쌍의 포도당 감지 신경세포만의 활동을 조절함으로써 당뇨병의 증상을 가지는 초파리를 인위적으로 만들 수 있는 것이다.
한발 더 나아가 연구팀은 초파리에서 신경전달 기능을 하는 짧은 단백질의 한 종류인 sNPF(small Neuropeptide F)가 해당 포도당 감지 신경세포에서 발현됨을 파악하고 포도당에 노출됐을 때 이 신경전달물질이 분비됨을 확인했다. 또한, 연구팀은 인슐린 생산 조직과 글루카곤 생산 조직에서 sNPF 의 수용체가 포도당 감지 신경세포의 신호를 받는데 필수적인 역할을 함을 증명했다.
서성배 교수는 “이번 연구 결과는 초파리에서 의미 있는 발견을 했다는 사실을 넘어 당뇨병 원인 규명과 치료의 패러다임을 근본적으로 바꿀 수 있는 계기를 마련한 것이다”라며 “뇌에서 만들어지는 신호가 체내 혈당 조절에 근본적인 역할을 함이 구체적으로 규명되면 한 단계 진보된 당뇨병의 진단 및 치료뿐 아니라 비만, 대사질환 치료도 가능해질 것이다”라고 말했다.
□ 그림 설명
그림1,2. 서성배 교수 연구성과 개념도. 혈당에 반응하는 CN neuron의 Axon이 두 갈래로 갈라지며 갈라진 axonal branch는 인슐린을 만드는 세포를 활성화시키고 다른 갈라진 axonal branch는 글루카곤을 만드는 세포를 억제시킴
2019.10.24 조회수 14869 심남석 연구원, 난치성 뇌전증의 새로운 유전자 진단법 개발
〈 심남석 연구원 〉
우리 대학 의과학대학원 심남석 박사과정(지도교수 : 이정호 교수), 연세대학교 의료원(의료원장 윤도흠) 세브란스 어린이병원 신경외과 김동석 교수, 소아신경과 강훈철 교수 공동 연구팀이 난치성 뇌전증의 원인 돌연변이를 정확하게 분석할 수 있는 새로운 진단법을 개발했다.
이번 연구를 통해 기초 과학 분야와 임상 진료 영역 간 차이로 환자에게 쉽게 적용하지 못했던 난치성 뇌전증 원인 유전자 진단을 실제 임상 영역에서 시행할 수 있을 것으로 보이며, 이를 통해 환자들에게 더 나은 치료법을 제시할 수 있을 것으로 기대된다.
심남석 박사과정이 1 저자로 참여한 이번 연구는 뇌병리 분야 국제 학술지 ‘악타 뉴로패쏠로지카 (Acta Neuropathologica)’ 8월 3일 자 온라인판에 게재됐다. (논문명 : Precise detection of low-level somatic mutation in resected epilepsy brain tissue)
뇌전증은 전 세계적으로 4번째로 높은 유병률을 보이는 신경학적 질환으로 높은 사회 경제적 비용이 소모된다. 그중 전체 뇌전증의 3~40%를 차지하는 난치성 뇌전증은 약물치료로 조절되지 않고 위험성이 높아 수술 치료가 요구되는 질병이다.
최근 연구팀은 이 난치성 뇌전증이 뇌 체성(사람의 신체적 성질) 돌연변이에 의해 발생한다는 사실을 규명해 새 치료법을 제안한 바 있다. 그러나 뇌 국소 부위에서 발생한 소량의 돌연변이를 찾는 기존 진단법은 정확도가 30% 이하로 매우 낮아 실제 사용에는 어려움이 많다.
연구팀은 세브란스 병원에서 뇌수술을 받은 난치성 뇌전증 환자 232명의 뇌 조직 및 말초 조직(혈액 또는 침)을 분석해 돌연변이가 자주 발생하는 타겟 유전자를 확보했다. 이 타겟 유전자를 대상으로 표적 유전자 복제 염기서열 분석법을 적용해 체성 돌연변이를 분석했다.
연구팀은 고심도 유전체 분석을 통해 최적의 표적 유전자 선별, 고심도 시퀀싱 분석 및 방법의 조합을 찾아 진단 정확도를 50%에서 최대 100%까지 높이는 데 성공했다.
특히 임상에서 쉽게 확보할 수 있는 뇌 조직 절편만으로도 정확도가 100%에 가까운 체성 돌연변이 유전자 진단이 가능함을 확인했다.
1 저자인 심남석 연구원은 “난치성 뇌전증의 유전자 진단은 현재 임상시험 중인 새로운 치료법의 필수적인 과정이다”라며 “높은 효율, 낮은 비용으로 유전자 진단을 할 수 있게 만들어 고통받는 환아들에게 도움을 주고 싶다”라고 말했다.
연구팀은 이번 연구 결과를 바탕으로 교원창업 기업(소바젠, 대표 김병태)을 통해 빠르고 정확한 난치성 뇌전증 원인 유전자 진단 제공할 예정이다.
이번 연구는 서경배 과학재단, 한국연구재단, 보건복지부, 교원창업 기업 소바젠의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구에서 발견한 체세포성 돌연변이
2019.08.13 조회수 14831
심남석 연구원, 난치성 뇌전증의 새로운 유전자 진단법 개발
〈 심남석 연구원 〉
우리 대학 의과학대학원 심남석 박사과정(지도교수 : 이정호 교수), 연세대학교 의료원(의료원장 윤도흠) 세브란스 어린이병원 신경외과 김동석 교수, 소아신경과 강훈철 교수 공동 연구팀이 난치성 뇌전증의 원인 돌연변이를 정확하게 분석할 수 있는 새로운 진단법을 개발했다.
이번 연구를 통해 기초 과학 분야와 임상 진료 영역 간 차이로 환자에게 쉽게 적용하지 못했던 난치성 뇌전증 원인 유전자 진단을 실제 임상 영역에서 시행할 수 있을 것으로 보이며, 이를 통해 환자들에게 더 나은 치료법을 제시할 수 있을 것으로 기대된다.
심남석 박사과정이 1 저자로 참여한 이번 연구는 뇌병리 분야 국제 학술지 ‘악타 뉴로패쏠로지카 (Acta Neuropathologica)’ 8월 3일 자 온라인판에 게재됐다. (논문명 : Precise detection of low-level somatic mutation in resected epilepsy brain tissue)
뇌전증은 전 세계적으로 4번째로 높은 유병률을 보이는 신경학적 질환으로 높은 사회 경제적 비용이 소모된다. 그중 전체 뇌전증의 3~40%를 차지하는 난치성 뇌전증은 약물치료로 조절되지 않고 위험성이 높아 수술 치료가 요구되는 질병이다.
최근 연구팀은 이 난치성 뇌전증이 뇌 체성(사람의 신체적 성질) 돌연변이에 의해 발생한다는 사실을 규명해 새 치료법을 제안한 바 있다. 그러나 뇌 국소 부위에서 발생한 소량의 돌연변이를 찾는 기존 진단법은 정확도가 30% 이하로 매우 낮아 실제 사용에는 어려움이 많다.
연구팀은 세브란스 병원에서 뇌수술을 받은 난치성 뇌전증 환자 232명의 뇌 조직 및 말초 조직(혈액 또는 침)을 분석해 돌연변이가 자주 발생하는 타겟 유전자를 확보했다. 이 타겟 유전자를 대상으로 표적 유전자 복제 염기서열 분석법을 적용해 체성 돌연변이를 분석했다.
연구팀은 고심도 유전체 분석을 통해 최적의 표적 유전자 선별, 고심도 시퀀싱 분석 및 방법의 조합을 찾아 진단 정확도를 50%에서 최대 100%까지 높이는 데 성공했다.
특히 임상에서 쉽게 확보할 수 있는 뇌 조직 절편만으로도 정확도가 100%에 가까운 체성 돌연변이 유전자 진단이 가능함을 확인했다.
1 저자인 심남석 연구원은 “난치성 뇌전증의 유전자 진단은 현재 임상시험 중인 새로운 치료법의 필수적인 과정이다”라며 “높은 효율, 낮은 비용으로 유전자 진단을 할 수 있게 만들어 고통받는 환아들에게 도움을 주고 싶다”라고 말했다.
연구팀은 이번 연구 결과를 바탕으로 교원창업 기업(소바젠, 대표 김병태)을 통해 빠르고 정확한 난치성 뇌전증 원인 유전자 진단 제공할 예정이다.
이번 연구는 서경배 과학재단, 한국연구재단, 보건복지부, 교원창업 기업 소바젠의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구에서 발견한 체세포성 돌연변이
2019.08.13 조회수 14831 정재웅 교수, 스마트폰으로 뇌 신경회로 무선 제어 기술 개발
〈 김충연, 변상혁 박사과정, 정재웅 교수〉
우리 대학 전기및전자공학부 정재웅 교수와 미국 워싱턴대(University of Washington) 마이클 브루카스(Michael Bruchas) 교수 공동 연구팀이 스마트폰 앱 조작을 통해 약물과 빛을 뇌 특정 부위에 전달함으로써 신경회로를 정교하게 조절할 수 있는 뇌 이식용 무선 기기를 개발했다.
이번 기술 개발을 통해 장기간의 동물 실험이 필요한 신약 개발뿐 아니라 치매, 파킨슨병 등 뇌 질환 치료에도 적용할 수 있을 것으로 기대된다.
라자 콰지(Raza Qazi, 1저자), 김충연, 변상혁 연구원이 개발하고 워싱턴대 신경과학 연구원들이 공동으로 참여한 이번 연구는 의공학 분야 국제 학술지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 8월 6일 자에 게재됐다. (논문명 : Wireless optofluidic brain probes for chronic neuropharmacology and photostimulation).
광유전학과 신경약물학은 주변 신경회로에 영향을 주지 않고 목표로 하는 뉴런이나 신경회로만을 빛 또는 약물, 혹은 그 둘의 조합을 이용해 정교하게 제어할 수 있다. 기존의 전기자극을 활용한 방법에 비해 훨씬 더 높은 시공간적 해상도를 가져 최근 뇌 연구 및 뇌 질병 치료 목적으로 주목받고 있다.
하지만 현재 뇌 연구에 일반적으로 쓰는 기기는 상대적으로 크기가 커 뇌 조직 손상, 정교한 선택적 신경회로 제어 불가, 하나의 다기능성 프로브(probe) 형태로 구현이 어렵다. 또한, 기존 기기는 실리카(silica)와 금속 등 고강성 재료로 제작돼 부드러운 뇌 조직과의 기계 특성적 간극이 있다. 이러한 특성으로 인해 염증반응을 악화시켜 장기간 이식용으로 적합하지 않다.
무엇보다 일반적으로 연구실에서 쓰이고 있는 광섬유, 약물주입관 등은 뇌 이식 후 외부기기에 선이 연결된 형태로 사용해야 해 자유로운 행동을 크게 제약하게 된다.
연구팀은 중합체(polymer) 미세유체관과 마이크로 LED를 결합해 머리카락 두께의 유연한 탐침을 만들고, 이를 소형 블루투스 기반 제어 회로와 교체 가능한 약물 카트리지와 결합했다. 이를 통해 스마트폰 앱을 통해 무선으로 마이크로 LED와 약물 전달을 제어할 수 있는 무게 2g의 뇌 이식용 기기를 구현했다.
특히 약물 카트리지는 레고의 원리를 모사해 탐침 부분과 쉽게 조립 및 분리할 수 있도록 제작해, 필요할 때마다 새로운 약물 카트리지를 결합함으로써 원하는 약물을 장기간에 걸쳐 뇌의 특정 부위에 반복 전달할 수 있도록 만들었다.
연구팀은 이 기기를 쥐의 뇌 보상회로에 이식한 후 도파민 활성 약물과 억제 약물이 든 카트리지를 기기와 결합했다. 그 후 간단한 스마트폰 앱 제어와 도파민 활성 약물을 이용해 원하는 타이밍에 자유롭게 움직이는 쥐의 행동을 증가, 억제하는 데 성공했다.
또한, 연구팀은 쥐의 뇌에서 장소 선호도를 유도할 수 있는 부위에 빛에 반응하는 단백질을 주입해 신경세포가 빛에 반응하도록 처리했다.
그 후 쥐가 특정 장소로 이동했을 때 마이크로 LED를 켜 빛 자극을 통해 쥐가 그 장소에 계속 머물고 싶게 만들었다. 반대로 약물 전달을 통해 뇌 신경회로를 제어함으로써 쥐의 특정 장소 선호도를 없애는 데도 성공했다.
정 교수는 “빛과 약물을 이용한 신경회로 제어는 기존의 전기자극 방법보다 훨씬 더 정교해 부작용 없는 뇌 제어가 가능하다”라며 “개발된 기기는 간단한 스마트폰 조작으로 뇌의 특정 회로를 빛과 약물을 이용해 반복적, 장기적으로 무선 제어가 가능해 뇌 기능을 밝혀내기 위한 연구나 향후 뇌 질환의 치료에도 유용하게 적용할 수 있을 것이다”라고 말했다.
연구팀은 이 기술을 인체에 적용하기 위해 두개골 내에 완전히 이식할 수 있고 반영구적 사용이 가능한 형태로 디자인을 발전시키는 확장 연구를 계획하고 있다.
이번 연구는 한국연구재단 신진연구자지원사업(완전 이식 가능한 무선 유연성 광유체 뉴럴 임플랜트 개발 및 뇌 연구를 위한 광유전학/광약물학에의 적용) 및 기초연구실 지원사업(유전자 및 신경회로 조절 기반 중독 행동 제어 기초연구실)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 디바이스가 이식된 쥐의 사진
그림2. 스마트폰앱을 이용한 마이크로 LED 컨트롤
그림3. 개발된 뇌 이식용 무선 디바이스
2019.08.08 조회수 24693
정재웅 교수, 스마트폰으로 뇌 신경회로 무선 제어 기술 개발
〈 김충연, 변상혁 박사과정, 정재웅 교수〉
우리 대학 전기및전자공학부 정재웅 교수와 미국 워싱턴대(University of Washington) 마이클 브루카스(Michael Bruchas) 교수 공동 연구팀이 스마트폰 앱 조작을 통해 약물과 빛을 뇌 특정 부위에 전달함으로써 신경회로를 정교하게 조절할 수 있는 뇌 이식용 무선 기기를 개발했다.
이번 기술 개발을 통해 장기간의 동물 실험이 필요한 신약 개발뿐 아니라 치매, 파킨슨병 등 뇌 질환 치료에도 적용할 수 있을 것으로 기대된다.
라자 콰지(Raza Qazi, 1저자), 김충연, 변상혁 연구원이 개발하고 워싱턴대 신경과학 연구원들이 공동으로 참여한 이번 연구는 의공학 분야 국제 학술지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 8월 6일 자에 게재됐다. (논문명 : Wireless optofluidic brain probes for chronic neuropharmacology and photostimulation).
광유전학과 신경약물학은 주변 신경회로에 영향을 주지 않고 목표로 하는 뉴런이나 신경회로만을 빛 또는 약물, 혹은 그 둘의 조합을 이용해 정교하게 제어할 수 있다. 기존의 전기자극을 활용한 방법에 비해 훨씬 더 높은 시공간적 해상도를 가져 최근 뇌 연구 및 뇌 질병 치료 목적으로 주목받고 있다.
하지만 현재 뇌 연구에 일반적으로 쓰는 기기는 상대적으로 크기가 커 뇌 조직 손상, 정교한 선택적 신경회로 제어 불가, 하나의 다기능성 프로브(probe) 형태로 구현이 어렵다. 또한, 기존 기기는 실리카(silica)와 금속 등 고강성 재료로 제작돼 부드러운 뇌 조직과의 기계 특성적 간극이 있다. 이러한 특성으로 인해 염증반응을 악화시켜 장기간 이식용으로 적합하지 않다.
무엇보다 일반적으로 연구실에서 쓰이고 있는 광섬유, 약물주입관 등은 뇌 이식 후 외부기기에 선이 연결된 형태로 사용해야 해 자유로운 행동을 크게 제약하게 된다.
연구팀은 중합체(polymer) 미세유체관과 마이크로 LED를 결합해 머리카락 두께의 유연한 탐침을 만들고, 이를 소형 블루투스 기반 제어 회로와 교체 가능한 약물 카트리지와 결합했다. 이를 통해 스마트폰 앱을 통해 무선으로 마이크로 LED와 약물 전달을 제어할 수 있는 무게 2g의 뇌 이식용 기기를 구현했다.
특히 약물 카트리지는 레고의 원리를 모사해 탐침 부분과 쉽게 조립 및 분리할 수 있도록 제작해, 필요할 때마다 새로운 약물 카트리지를 결합함으로써 원하는 약물을 장기간에 걸쳐 뇌의 특정 부위에 반복 전달할 수 있도록 만들었다.
연구팀은 이 기기를 쥐의 뇌 보상회로에 이식한 후 도파민 활성 약물과 억제 약물이 든 카트리지를 기기와 결합했다. 그 후 간단한 스마트폰 앱 제어와 도파민 활성 약물을 이용해 원하는 타이밍에 자유롭게 움직이는 쥐의 행동을 증가, 억제하는 데 성공했다.
또한, 연구팀은 쥐의 뇌에서 장소 선호도를 유도할 수 있는 부위에 빛에 반응하는 단백질을 주입해 신경세포가 빛에 반응하도록 처리했다.
그 후 쥐가 특정 장소로 이동했을 때 마이크로 LED를 켜 빛 자극을 통해 쥐가 그 장소에 계속 머물고 싶게 만들었다. 반대로 약물 전달을 통해 뇌 신경회로를 제어함으로써 쥐의 특정 장소 선호도를 없애는 데도 성공했다.
정 교수는 “빛과 약물을 이용한 신경회로 제어는 기존의 전기자극 방법보다 훨씬 더 정교해 부작용 없는 뇌 제어가 가능하다”라며 “개발된 기기는 간단한 스마트폰 조작으로 뇌의 특정 회로를 빛과 약물을 이용해 반복적, 장기적으로 무선 제어가 가능해 뇌 기능을 밝혀내기 위한 연구나 향후 뇌 질환의 치료에도 유용하게 적용할 수 있을 것이다”라고 말했다.
연구팀은 이 기술을 인체에 적용하기 위해 두개골 내에 완전히 이식할 수 있고 반영구적 사용이 가능한 형태로 디자인을 발전시키는 확장 연구를 계획하고 있다.
이번 연구는 한국연구재단 신진연구자지원사업(완전 이식 가능한 무선 유연성 광유체 뉴럴 임플랜트 개발 및 뇌 연구를 위한 광유전학/광약물학에의 적용) 및 기초연구실 지원사업(유전자 및 신경회로 조절 기반 중독 행동 제어 기초연구실)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 디바이스가 이식된 쥐의 사진
그림2. 스마트폰앱을 이용한 마이크로 LED 컨트롤
그림3. 개발된 뇌 이식용 무선 디바이스
2019.08.08 조회수 24693 박준성 연구원, 알츠하이머병의 새로운 원인 규명
〈 박준성 박사 〉
우리 대학 의과학대학원 박준성 박사(지도교수 : 이정호 교수), KISTI(한국과학기술정보연구원) 국가슈퍼컴퓨팅본부 유석종 박사 공동 연구팀이 노화 과정에서 발생하는 후천적 뇌 돌연변이가 알츠하이머병의 새 원인이 될 수 있다는 이론을 제시했다.
연구팀은 52명의 알츠하이머병 환자에게 얻은 사후 뇌 조직에서 전장 엑솜 유전체 서열(whole-exome sequencing) 데이터 분석을 통해 알츠하이머병에 존재하는 뇌 체성 유전변이를 찾아냈다. 또한, 뇌 체성 돌연변이가 알츠하이머병의 중요 원인으로 알려진 신경섬유다발 형성을 비정상적으로 증가시킴을 확인했다.
박준성 박사와 KISTI 이준학 박사가 공동 1 저자로 참여한 이번 연구는 국제 학술지 네이처 커뮤니케이션(Nature Communications) 7월 12일자 온라인판에 게재됐다. (논문명 : Brain somatic mutations observed in Alzheimer's disease associated with aging and dysregulation of tau phosphorylation)
노인성 치매의 가장 흔한 원인으로 알려진 알츠하이머병은 전 세계 GDP의 1%를 차지할 정도로 사회, 경제적 소모비용이 큰 질환이다. 하지만 여전히 알츠하이머병을 일으키는 분자 유전학적 원인은 명확하게 규명되지 않고 있다.
기존의 알츠하이머병 유전체 연구는 주로 환자의 말초조직인 혈액에서 전장유전체 연관분석(Genome-wide association study)을 하거나, 이미 가족력이 있는 환자에서 발견된 일부 유전자들(e.g., APP, PSEN1/2)에 대한 유전자 패널 분석 등이 주를 이루었다.
연구팀은 산발성 알츠하이머병 환자들에게 내후각피질에서 신경섬유다발이 공통으로 나타나는 현상에 주목해 알츠하이머병 환자의 뇌 조직에서 직접 엑솜 유전체 데이터를 생성해 알츠하이머병 뇌-특이적 체성 유전변이를 발굴했다.
연구팀은 알츠하이머병 환자와 정상인의 해마 형성체 부위를 레이저 현미 해부법을 통해 정밀하게 오려냈고, 저빈도의 체성 유전변이(Somatic mutation)를 정확하게 찾아내기 위해 대용량 고심도 엑솜 시퀀싱 데이터를 생성하고 저빈도 체성 유전변이 분석에 특화된 분석 파이프라인을 독자적으로 구축했다.
이러한 새 방법론을 통해 실제로 알츠하이머병 환자의 뇌에 체성 유전변이가 실제로 존재함을 체계적으로 규명함과 동시에 체성 유전변이의 누적속도 및 신경섬유다발 형성과의 관련성도 함께 밝혀냈다.
연구팀의 발견은 알츠하이머병의 발병에 체성 유전변이가 주요한 역할을 할 수 있음을 강력하게 시사하는 것으로, 알츠하이머병 유전체 연구에 대한 새로운 틀을 제시함과 동시에 향후 다른 신경퇴행성뇌질환의 연구에도 기여할 수 있을 것으로 기대된다.
연구팀은 이번 연구 결과를 바탕으로 교원 창업 기업(소바젠, 대표 김병태)을 통해 알츠하이머 질환의 진단과 치료제 개발에 나설 예정이다.
KISTI 유석종 박사는 연구팀이 구축한 저빈도 체성 유전변이 분석 파이프라인 및 빅데이터 분석을 위한 슈퍼컴퓨팅 기술을 통해 알츠하이머병의 새로운 발병 원리를 밝혀냈다라며 타 유전체 기반 연구에 활용할 수 있는 기반을 마련했다라고 말했다.
이번 연구는 서경배 과학재단, 보건복지부 및 한국과학기술정보연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
□ 그림 설명
그림1. 본 연구에서 사용된 체성 유전변이 분석 파이프라인
그림2. 신경섬유성다발 형성에 관여하는 체성 유전변이
그림3. PIN1 유전자에 발생한 병원성 뇌 체성유전변이와 신경섬유다발 형성과의 관계 규명
2019.07.17 조회수 17215
박준성 연구원, 알츠하이머병의 새로운 원인 규명
〈 박준성 박사 〉
우리 대학 의과학대학원 박준성 박사(지도교수 : 이정호 교수), KISTI(한국과학기술정보연구원) 국가슈퍼컴퓨팅본부 유석종 박사 공동 연구팀이 노화 과정에서 발생하는 후천적 뇌 돌연변이가 알츠하이머병의 새 원인이 될 수 있다는 이론을 제시했다.
연구팀은 52명의 알츠하이머병 환자에게 얻은 사후 뇌 조직에서 전장 엑솜 유전체 서열(whole-exome sequencing) 데이터 분석을 통해 알츠하이머병에 존재하는 뇌 체성 유전변이를 찾아냈다. 또한, 뇌 체성 돌연변이가 알츠하이머병의 중요 원인으로 알려진 신경섬유다발 형성을 비정상적으로 증가시킴을 확인했다.
박준성 박사와 KISTI 이준학 박사가 공동 1 저자로 참여한 이번 연구는 국제 학술지 네이처 커뮤니케이션(Nature Communications) 7월 12일자 온라인판에 게재됐다. (논문명 : Brain somatic mutations observed in Alzheimer's disease associated with aging and dysregulation of tau phosphorylation)
노인성 치매의 가장 흔한 원인으로 알려진 알츠하이머병은 전 세계 GDP의 1%를 차지할 정도로 사회, 경제적 소모비용이 큰 질환이다. 하지만 여전히 알츠하이머병을 일으키는 분자 유전학적 원인은 명확하게 규명되지 않고 있다.
기존의 알츠하이머병 유전체 연구는 주로 환자의 말초조직인 혈액에서 전장유전체 연관분석(Genome-wide association study)을 하거나, 이미 가족력이 있는 환자에서 발견된 일부 유전자들(e.g., APP, PSEN1/2)에 대한 유전자 패널 분석 등이 주를 이루었다.
연구팀은 산발성 알츠하이머병 환자들에게 내후각피질에서 신경섬유다발이 공통으로 나타나는 현상에 주목해 알츠하이머병 환자의 뇌 조직에서 직접 엑솜 유전체 데이터를 생성해 알츠하이머병 뇌-특이적 체성 유전변이를 발굴했다.
연구팀은 알츠하이머병 환자와 정상인의 해마 형성체 부위를 레이저 현미 해부법을 통해 정밀하게 오려냈고, 저빈도의 체성 유전변이(Somatic mutation)를 정확하게 찾아내기 위해 대용량 고심도 엑솜 시퀀싱 데이터를 생성하고 저빈도 체성 유전변이 분석에 특화된 분석 파이프라인을 독자적으로 구축했다.
이러한 새 방법론을 통해 실제로 알츠하이머병 환자의 뇌에 체성 유전변이가 실제로 존재함을 체계적으로 규명함과 동시에 체성 유전변이의 누적속도 및 신경섬유다발 형성과의 관련성도 함께 밝혀냈다.
연구팀의 발견은 알츠하이머병의 발병에 체성 유전변이가 주요한 역할을 할 수 있음을 강력하게 시사하는 것으로, 알츠하이머병 유전체 연구에 대한 새로운 틀을 제시함과 동시에 향후 다른 신경퇴행성뇌질환의 연구에도 기여할 수 있을 것으로 기대된다.
연구팀은 이번 연구 결과를 바탕으로 교원 창업 기업(소바젠, 대표 김병태)을 통해 알츠하이머 질환의 진단과 치료제 개발에 나설 예정이다.
KISTI 유석종 박사는 연구팀이 구축한 저빈도 체성 유전변이 분석 파이프라인 및 빅데이터 분석을 위한 슈퍼컴퓨팅 기술을 통해 알츠하이머병의 새로운 발병 원리를 밝혀냈다라며 타 유전체 기반 연구에 활용할 수 있는 기반을 마련했다라고 말했다.
이번 연구는 서경배 과학재단, 보건복지부 및 한국과학기술정보연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
□ 그림 설명
그림1. 본 연구에서 사용된 체성 유전변이 분석 파이프라인
그림2. 신경섬유성다발 형성에 관여하는 체성 유전변이
그림3. PIN1 유전자에 발생한 병원성 뇌 체성유전변이와 신경섬유다발 형성과의 관계 규명
2019.07.17 조회수 17215 조광현 교수, 뇌의 제어구조 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌 영역 간 복잡한 연결 네트워크에 내재된 뇌의 제어구조를 규명했다.
이번 연구를 통해 뇌의 동작 원리에 대한 이해를 높이고, 뇌의 제어구조 분석을 통해 뇌 질환 연구 및 치료에 응용될 수 있을 것으로 기대된다. 또한 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학을 통해 규명했다는 의의가 있다.
이병욱 박사, 강의룡, 장홍준 박사과정이 참여한 이번 연구는 셀(Cell) 출판사가 펴내는 융합과학 국제학술지 ‘아이사이언스(iScience)’ 3월 29일 자에 게재됐다.
뇌의 다양한 인지기능은 뇌 영역들 사이의 복잡한 연결을 통한 영역 간 상호작용으로 이뤄진다. 최근 뇌의 연결성에 대한 정보가 뇌의 동작 원리를 파악하는 핵심이라는 의견이 대두되면서 세계적으로 뇌 연결성을 파악하기 위한 커넥톰(Connectome) 연구가 활발히 이뤄지고 있다.
이를 통해 뇌 영역 사이의 구체적 연결성이 파악되고 있지만 복잡한 연결성에 내재된 뇌의 동작 원리에 대한 이해는 아직 매우 부족한 상황이다. 특히 뇌의 강건하면서 효율적 정보처리 능력의 기반이 되는 뇌의 숨겨진 제어구조는 파악된 내용이 없다.
조 교수 연구팀은 뇌의 제어구조 분석을 위해 ‘미국국립보건원(NIH) 휴먼 커넥톰 프로젝트(Human Connectome Project)’에서 제공하는 정상인의 뇌 영상 이미지 데이터를 활용해 뇌 영영 간 네트워크를 구축했다.
이후 연구팀은 그래프 이론의 최소지배집합(minimum dominating set) 개념을 활용해 뇌 영역 간 복잡한 연결 네트워크의 제어구조를 분석했다.
최소지배집합이란 네트워크의 각 노드(뇌의 각 영역)가 링크(뇌의 서로 다른 영역간의 연결)로 연결된 이웃 노드에 직접적 영향을 줘 기능을 제어할 수 있다고 가정할 때, 네트워크를 구성하는 모든 노드를 제어하는 데 필요한 최소한의 노드 집합을 말한다.
기존 여러 연구를 통해 다양한 생체 네트워크 및 통신망, 전력망 등의 복잡계 네트워크를 제어하는 데 있어서 최소지배집합이 핵심적인 역할을 한다는 것이 보고된 바 있다.
연구팀은 최소지배집합을 기반으로 ‘제어영역의 분포(distribution of control)’와 ‘제어영역의 중첩(overlap in control area)’이라는 두 가지 지표를 정의한 뒤 이를 기준으로 총 네 종류의 제어구조를 정의했다.
이후 연구팀은 브레인 네트워크를 비롯해 도로망, 통신망, 소셜 네트워크 등 실존하는 다양한 복잡계 네트워크가 어떤 제어구조를 갖는지 분석했다. 분석 결과 뇌는 다른 대부분 네트워크와는 달리 제어영역이 분산된 동시에 서로 중첩된 특이한 구조로 이뤄짐을 밝혀냈다.
뇌의 이러한 제어구조는 외부 섭동에 의한 네트워크의 높은 강건성을 유지하면서 동시에 여러 인지기능을 효율적으로 수행하기 위한 영역들의 상호 활성화를 다양하게 하기 위한 것임을 밝혔다.
IT와 BT가 융합된 시스템생물학 접근을 통한 브레인 네트워크의 구조분석은 인공지능의 발전에도 기여할 것으로 보인다. 브레인 네트워크의 진화적 설계원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다.
조 교수는 “지금껏 뇌의 제어구조가 밝혀진 바가 없었다”라며 “복잡한 연결성에 숨겨진 브레인 네트워크의 진화적 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작 원리를 파악할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뇌의 제어구조 규명
그림2. 뇌 영역 간 네트워크 구축
2019.04.10 조회수 20938
조광현 교수, 뇌의 제어구조 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌 영역 간 복잡한 연결 네트워크에 내재된 뇌의 제어구조를 규명했다.
이번 연구를 통해 뇌의 동작 원리에 대한 이해를 높이고, 뇌의 제어구조 분석을 통해 뇌 질환 연구 및 치료에 응용될 수 있을 것으로 기대된다. 또한 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학을 통해 규명했다는 의의가 있다.
이병욱 박사, 강의룡, 장홍준 박사과정이 참여한 이번 연구는 셀(Cell) 출판사가 펴내는 융합과학 국제학술지 ‘아이사이언스(iScience)’ 3월 29일 자에 게재됐다.
뇌의 다양한 인지기능은 뇌 영역들 사이의 복잡한 연결을 통한 영역 간 상호작용으로 이뤄진다. 최근 뇌의 연결성에 대한 정보가 뇌의 동작 원리를 파악하는 핵심이라는 의견이 대두되면서 세계적으로 뇌 연결성을 파악하기 위한 커넥톰(Connectome) 연구가 활발히 이뤄지고 있다.
이를 통해 뇌 영역 사이의 구체적 연결성이 파악되고 있지만 복잡한 연결성에 내재된 뇌의 동작 원리에 대한 이해는 아직 매우 부족한 상황이다. 특히 뇌의 강건하면서 효율적 정보처리 능력의 기반이 되는 뇌의 숨겨진 제어구조는 파악된 내용이 없다.
조 교수 연구팀은 뇌의 제어구조 분석을 위해 ‘미국국립보건원(NIH) 휴먼 커넥톰 프로젝트(Human Connectome Project)’에서 제공하는 정상인의 뇌 영상 이미지 데이터를 활용해 뇌 영영 간 네트워크를 구축했다.
이후 연구팀은 그래프 이론의 최소지배집합(minimum dominating set) 개념을 활용해 뇌 영역 간 복잡한 연결 네트워크의 제어구조를 분석했다.
최소지배집합이란 네트워크의 각 노드(뇌의 각 영역)가 링크(뇌의 서로 다른 영역간의 연결)로 연결된 이웃 노드에 직접적 영향을 줘 기능을 제어할 수 있다고 가정할 때, 네트워크를 구성하는 모든 노드를 제어하는 데 필요한 최소한의 노드 집합을 말한다.
기존 여러 연구를 통해 다양한 생체 네트워크 및 통신망, 전력망 등의 복잡계 네트워크를 제어하는 데 있어서 최소지배집합이 핵심적인 역할을 한다는 것이 보고된 바 있다.
연구팀은 최소지배집합을 기반으로 ‘제어영역의 분포(distribution of control)’와 ‘제어영역의 중첩(overlap in control area)’이라는 두 가지 지표를 정의한 뒤 이를 기준으로 총 네 종류의 제어구조를 정의했다.
이후 연구팀은 브레인 네트워크를 비롯해 도로망, 통신망, 소셜 네트워크 등 실존하는 다양한 복잡계 네트워크가 어떤 제어구조를 갖는지 분석했다. 분석 결과 뇌는 다른 대부분 네트워크와는 달리 제어영역이 분산된 동시에 서로 중첩된 특이한 구조로 이뤄짐을 밝혀냈다.
뇌의 이러한 제어구조는 외부 섭동에 의한 네트워크의 높은 강건성을 유지하면서 동시에 여러 인지기능을 효율적으로 수행하기 위한 영역들의 상호 활성화를 다양하게 하기 위한 것임을 밝혔다.
IT와 BT가 융합된 시스템생물학 접근을 통한 브레인 네트워크의 구조분석은 인공지능의 발전에도 기여할 것으로 보인다. 브레인 네트워크의 진화적 설계원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다.
조 교수는 “지금껏 뇌의 제어구조가 밝혀진 바가 없었다”라며 “복잡한 연결성에 숨겨진 브레인 네트워크의 진화적 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작 원리를 파악할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뇌의 제어구조 규명
그림2. 뇌 영역 간 네트워크 구축
2019.04.10 조회수 20938 이현주 교수(전기및전자공학부), 움직이는 쥐에 초음파 뇌 자극 실험 성공
우리 대학 전기및전자공학부 이현주 교수 연구팀이 초소형화 및 초경량화한 미세 초음파 소자(CMUT)를 통해 자유롭게 움직이는 쥐의 뇌에 초음파 자극을 줄 수 있는 기술을 개발했다.
이 교수 연구팀은 1g 미만의 초경량 초음파 소자 개발을 통해 움직이는 쥐의 뇌 초음파 결과를 얻는 데 성공했다. 이는 쥐 무게의 6배에 달하는 초음파 변환기를 사용해 움직이는 쥐에 적용할 수 없었던 기존 기술의 한계를 극복한 것이다.
김형국 석사가 주도하고 김성연 석사과정과 덴마크 공과대학교 (DTU) 티어샤(Thielscher) 교수 연구팀이 참여한 이번 연구는 국제 학술지 ‘브레인 스티뮬레이션(Brain Stimulation)’ 11월 17일자 온라인판에 게재됐고, 3월자 12권 2호에 출판될 예정이다. (논문명 : 자유롭게 움직이는 동물에서 비침습 뇌자극이 가능한 초소형 초음파 링 변환자 어레이, Miniature ultrasound ring array transducers for transcranial ultrasound neuromodulation of freely-moving small animals)
최근 뇌 자극 기술로 비침습적이고 집속이 가능한 초음파 자극 기술이 차세대 뇌 자극 기술로 주목받고 있다.
뇌를 자극하는 기존 방법에는 뇌의 특정 영역을 미세 자극할 수 있는 심부뇌자극술(DBS)과 광유전학 기반의 광 자극이 있지만 침습도가 높아 임상에 적용이 어렵다. 경두개전기자극술(TES)과 경두개자기자극술(TMS) 등은 비침습적이지만 자극 부위가 넓고 심부 자극이 불가능해 적용 범위에 한계가 있다.
초음파는 비침습적이기 때문에 동물실험뿐만 아니라 인체에도 안전하게 적용할 수 있어 임상 시험에 활용된다. 또한 초음파 집속을 통해 국소부위 자극과 심부 자극이 모두 가능해 타 기술 대비 이점이 많다.
초음파 뇌 자극 기술은 개발 초기 단계이기 때문에 지금까지는 쥐를 고정한 상태에서의 연구 결과만 발표됐다. 뇌 자극 관련 연구는 동물의 행동실험이 필수적임에도 불구하고 무거운 초음파 소자 때문에 쥐를 고정 및 마취해야만 했다.
연구팀은 미소 전자 기계 시스템(MEMS) 기술을 통한 정전용량 미세 초음파 소자(CMUT)의 초소형, 초경량화를 연구했다. 쥐의 구조에 맞는 중심 주파수, 크기, 초점 거리, 초음파 세기를 갖는 1g 미만의 소자와 행동실험에 적합한 실험 장치를 제작했다.
연구팀은 초음파 소자의 성능 평가를 위해 쥐 뇌의 운동 피질 (motor cortex)을 자극해 쥐의 앞발이 움직이는 운동 반응을 확인하고 승모근의 근전도를 측정했다.
연구팀은 초음파의 강도를 높일수록 운동 피질을 자극할 때 나오는 쥐의 앞발이 움직이는 현상이 더 자주 발생함을 확인했다. 결과적으로 초음파가 세지면서 반응의 성공률이 높아지는 결과를 얻어냈다.
연구팀의 초음파 소자는 쥐 뇌의 3~4mm 깊이까지 초음파가 전달되고 쥐 뇌 전체 크기의 25% 영역을 자극할 수 있다. 이 교수 연구팀은 향후 자극 범위를 국소화해 소형 동물 뇌의 단일 영역도 특이적으로 자극할 수 있는 차세대 뉴로툴 기술을 개발할 계획이다.
연구팀은 움직이는 쥐의 결과를 실시간으로 얻어낸 이번 연구 결과를 토대로 초음파가 수면에 미치는 영향을 연구 중이다. 향후 수면 연구뿐 아니라 다양한 행동실험 연구에 초음파 자극 기술을 적용할 수 있을 것으로 예상된다.
이 교수는 “머리를 고정하고 마취를 매번 시켰던 동물실험 방식을 벗어나 움직이는 쥐의 초음파 뇌 자극이 처음으로 가능해졌다”라며 “향후 수면장애, 파킨슨병, 치매, 우울증 등 여러 뇌 질환의 새로운 치료법 연구와 특이적 뇌 회로 규명에 광범위하게 적용될 수 있을 것이다”라고 말했다.
이번 연구는 과학기술정보통신부 뇌과학원천기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 행동실험이 가능한 초소형 비침습 초음파 자극 장치
그림2. 정전용량형 미세 초음파 소자의 (a-c) 구조 및 (d) 2D 시뮬레이션 빔 형
2019.02.11 조회수 14683
이현주 교수(전기및전자공학부), 움직이는 쥐에 초음파 뇌 자극 실험 성공
우리 대학 전기및전자공학부 이현주 교수 연구팀이 초소형화 및 초경량화한 미세 초음파 소자(CMUT)를 통해 자유롭게 움직이는 쥐의 뇌에 초음파 자극을 줄 수 있는 기술을 개발했다.
이 교수 연구팀은 1g 미만의 초경량 초음파 소자 개발을 통해 움직이는 쥐의 뇌 초음파 결과를 얻는 데 성공했다. 이는 쥐 무게의 6배에 달하는 초음파 변환기를 사용해 움직이는 쥐에 적용할 수 없었던 기존 기술의 한계를 극복한 것이다.
김형국 석사가 주도하고 김성연 석사과정과 덴마크 공과대학교 (DTU) 티어샤(Thielscher) 교수 연구팀이 참여한 이번 연구는 국제 학술지 ‘브레인 스티뮬레이션(Brain Stimulation)’ 11월 17일자 온라인판에 게재됐고, 3월자 12권 2호에 출판될 예정이다. (논문명 : 자유롭게 움직이는 동물에서 비침습 뇌자극이 가능한 초소형 초음파 링 변환자 어레이, Miniature ultrasound ring array transducers for transcranial ultrasound neuromodulation of freely-moving small animals)
최근 뇌 자극 기술로 비침습적이고 집속이 가능한 초음파 자극 기술이 차세대 뇌 자극 기술로 주목받고 있다.
뇌를 자극하는 기존 방법에는 뇌의 특정 영역을 미세 자극할 수 있는 심부뇌자극술(DBS)과 광유전학 기반의 광 자극이 있지만 침습도가 높아 임상에 적용이 어렵다. 경두개전기자극술(TES)과 경두개자기자극술(TMS) 등은 비침습적이지만 자극 부위가 넓고 심부 자극이 불가능해 적용 범위에 한계가 있다.
초음파는 비침습적이기 때문에 동물실험뿐만 아니라 인체에도 안전하게 적용할 수 있어 임상 시험에 활용된다. 또한 초음파 집속을 통해 국소부위 자극과 심부 자극이 모두 가능해 타 기술 대비 이점이 많다.
초음파 뇌 자극 기술은 개발 초기 단계이기 때문에 지금까지는 쥐를 고정한 상태에서의 연구 결과만 발표됐다. 뇌 자극 관련 연구는 동물의 행동실험이 필수적임에도 불구하고 무거운 초음파 소자 때문에 쥐를 고정 및 마취해야만 했다.
연구팀은 미소 전자 기계 시스템(MEMS) 기술을 통한 정전용량 미세 초음파 소자(CMUT)의 초소형, 초경량화를 연구했다. 쥐의 구조에 맞는 중심 주파수, 크기, 초점 거리, 초음파 세기를 갖는 1g 미만의 소자와 행동실험에 적합한 실험 장치를 제작했다.
연구팀은 초음파 소자의 성능 평가를 위해 쥐 뇌의 운동 피질 (motor cortex)을 자극해 쥐의 앞발이 움직이는 운동 반응을 확인하고 승모근의 근전도를 측정했다.
연구팀은 초음파의 강도를 높일수록 운동 피질을 자극할 때 나오는 쥐의 앞발이 움직이는 현상이 더 자주 발생함을 확인했다. 결과적으로 초음파가 세지면서 반응의 성공률이 높아지는 결과를 얻어냈다.
연구팀의 초음파 소자는 쥐 뇌의 3~4mm 깊이까지 초음파가 전달되고 쥐 뇌 전체 크기의 25% 영역을 자극할 수 있다. 이 교수 연구팀은 향후 자극 범위를 국소화해 소형 동물 뇌의 단일 영역도 특이적으로 자극할 수 있는 차세대 뉴로툴 기술을 개발할 계획이다.
연구팀은 움직이는 쥐의 결과를 실시간으로 얻어낸 이번 연구 결과를 토대로 초음파가 수면에 미치는 영향을 연구 중이다. 향후 수면 연구뿐 아니라 다양한 행동실험 연구에 초음파 자극 기술을 적용할 수 있을 것으로 예상된다.
이 교수는 “머리를 고정하고 마취를 매번 시켰던 동물실험 방식을 벗어나 움직이는 쥐의 초음파 뇌 자극이 처음으로 가능해졌다”라며 “향후 수면장애, 파킨슨병, 치매, 우울증 등 여러 뇌 질환의 새로운 치료법 연구와 특이적 뇌 회로 규명에 광범위하게 적용될 수 있을 것이다”라고 말했다.
이번 연구는 과학기술정보통신부 뇌과학원천기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 행동실험이 가능한 초소형 비침습 초음파 자극 장치
그림2. 정전용량형 미세 초음파 소자의 (a-c) 구조 및 (d) 2D 시뮬레이션 빔 형
2019.02.11 조회수 14683 조광현 교수, 뇌파 생성, 변조 담당하는 신경회로 원리 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌파의 생성 및 변조를 담당하는 핵심 신경회로를 규명하는 데 성공했다.
이를 통해 뇌의 동작원리를 밝힐 뿐 아니라 향후 여러 뇌질환 환자에게서 발생하는 비정상적 뇌파활동을 신경세포 네트워크 수준에서 규명하는 데 활용 가능할 것으로 기대된다. 이번 연구는 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명했다는 의미를 갖는다.
이병욱 박사과정, 신동관 박사, 스티븐 그로스 박사가 함께 참여한 이번 연구는 국제 학술지 ‘셀 리포트(Cell Reports)’ 11월 6일자 온라인 판에 게재됐다.
뇌의 다양한 기능은 신경세포(뉴런) 사이의 복잡한 상호작용을 통해 이뤄진다. 특히 뉴런들의 동시다발적인 발화에 의해 형성되는 뇌파는 뇌의 활동 상태를 측정하는 가장 중요한 지표이며, 특정 기능을 수행하기 위해 영역 간 선택적 통신의 매개체 역할을 하는 것으로 알려져 있다.
또한 뇌파의 비정상적인 생성 및 변조 현상은 다양한 뇌질환과 밀접한 관계를 갖는 것으로 밝혀지고 있다. 이에 따라 전 세계 신경생물학 연구자들은 뇌파의 생성 및 변조 원리를 파악하기 위해 노력해 왔다.
그러나 뇌파의 생성 및 변조는 수많은 뉴런 사이의 복잡한 상호작용을 통해 발생하는 예측할 수 없는 창발적 특성(emergent property)을 갖기 때문에 기존의 신경 생물학 실험을 통해 그 원리를 규명하기에는 한계가 있었다.
조 교수 연구팀은 시스템생물학 기반의 연구방법을 통해 뇌파의 생성 및 변조 원리를 분석했다. 연구팀은 여러 뇌 영역 중 특히 감각 피질(sensory cortex)에 주목했다. 감각 피질은 외부 감각 정보를 처리하고 통합, 조절하는 핵심 영역으로 여러 주파수 대역의 뇌파와 변조를 관측할 수 있다.
연구팀은 최근 커넥토믹스 (connectomics) 연구를 통해 밝혀진 쥐의 감각피질 내 뉴런의 종류 및 뉴런 간 연결성 정보를 이용해 감각피질을 구성하는 뉴런들과 이들을 연결하는 시냅스를 수학 모델을 통해 표현하고 이로부터 신경회로를 구축해 뇌파의 생성 및 변조 과정을 분석했다.
연구팀은 대규모 컴퓨터 시뮬레이션 분석을 통해 흥분성 뉴런과 억제성 뉴런으로 구성된 양성피드백과 음성피드백의 중첩된 구조(interlinked positive and negative feedback)가 뇌파의 생성 및 주파수 변조 현상의 핵심회로임을 최초로 규명했다.
특히 연구팀은 기존의 전기생리학 실험을 통해 측정된 뉴런 간 시냅스의 특정 연결강도가 신경회로의 뇌파 생성 및 변조 기능을 극대화시킬 수 있는 최적의 조합임을 밝혀냈다.
이번에 개발한 수학모형을 활용하면 전통적 생물학 실험을 통해 파악이 어려웠던 뉴런들 간의 다양한 상호작용을 이해하고 신경회로의 복잡한 설계원리를 파악할 수 있을 것으로 기대된다.
또한 여러 뇌질환 환자의 뇌에서 관측되는 비정상적인 뇌파 활동을 신경네트워크 차원에서 분석하고 규명할 수 있을 것으로 예상된다.
시스템생물학 접근을 통한 신경회로의 구조 및 기능 분석은 인공지능의 발전에도 기여할 것으로 기대된다. 두뇌 신경회로의 작동원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다. 자폐증이나 집중력 조절장애 등과 관련된 신경회로 규명, 두뇌 치료 기술 개발 등의 원천 의료기술 개발에도 혁신으로 이어질 수 있다.
조 교수는 “지금껏 뇌파의 생성 및 변조를 담당하는 핵심 신경회로가 밝혀진 바가 없었다”며 “이번 연구에서는 최근 커넥토믹스 (connectomcis) 연구를 통해 점차 밝혀지고 있는 뉴런간의 복잡한 연결성에 숨겨진 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작원리를 파악할 수 있는 새로운 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, 그리고 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뉴런 간 연결 강도에 내제된 기능적 설계원리 파악
그림2. 뇌파의 생성 및 변조를 담당하는 핵심 신경회로
2018.11.14 조회수 18788
조광현 교수, 뇌파 생성, 변조 담당하는 신경회로 원리 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌파의 생성 및 변조를 담당하는 핵심 신경회로를 규명하는 데 성공했다.
이를 통해 뇌의 동작원리를 밝힐 뿐 아니라 향후 여러 뇌질환 환자에게서 발생하는 비정상적 뇌파활동을 신경세포 네트워크 수준에서 규명하는 데 활용 가능할 것으로 기대된다. 이번 연구는 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명했다는 의미를 갖는다.
이병욱 박사과정, 신동관 박사, 스티븐 그로스 박사가 함께 참여한 이번 연구는 국제 학술지 ‘셀 리포트(Cell Reports)’ 11월 6일자 온라인 판에 게재됐다.
뇌의 다양한 기능은 신경세포(뉴런) 사이의 복잡한 상호작용을 통해 이뤄진다. 특히 뉴런들의 동시다발적인 발화에 의해 형성되는 뇌파는 뇌의 활동 상태를 측정하는 가장 중요한 지표이며, 특정 기능을 수행하기 위해 영역 간 선택적 통신의 매개체 역할을 하는 것으로 알려져 있다.
또한 뇌파의 비정상적인 생성 및 변조 현상은 다양한 뇌질환과 밀접한 관계를 갖는 것으로 밝혀지고 있다. 이에 따라 전 세계 신경생물학 연구자들은 뇌파의 생성 및 변조 원리를 파악하기 위해 노력해 왔다.
그러나 뇌파의 생성 및 변조는 수많은 뉴런 사이의 복잡한 상호작용을 통해 발생하는 예측할 수 없는 창발적 특성(emergent property)을 갖기 때문에 기존의 신경 생물학 실험을 통해 그 원리를 규명하기에는 한계가 있었다.
조 교수 연구팀은 시스템생물학 기반의 연구방법을 통해 뇌파의 생성 및 변조 원리를 분석했다. 연구팀은 여러 뇌 영역 중 특히 감각 피질(sensory cortex)에 주목했다. 감각 피질은 외부 감각 정보를 처리하고 통합, 조절하는 핵심 영역으로 여러 주파수 대역의 뇌파와 변조를 관측할 수 있다.
연구팀은 최근 커넥토믹스 (connectomics) 연구를 통해 밝혀진 쥐의 감각피질 내 뉴런의 종류 및 뉴런 간 연결성 정보를 이용해 감각피질을 구성하는 뉴런들과 이들을 연결하는 시냅스를 수학 모델을 통해 표현하고 이로부터 신경회로를 구축해 뇌파의 생성 및 변조 과정을 분석했다.
연구팀은 대규모 컴퓨터 시뮬레이션 분석을 통해 흥분성 뉴런과 억제성 뉴런으로 구성된 양성피드백과 음성피드백의 중첩된 구조(interlinked positive and negative feedback)가 뇌파의 생성 및 주파수 변조 현상의 핵심회로임을 최초로 규명했다.
특히 연구팀은 기존의 전기생리학 실험을 통해 측정된 뉴런 간 시냅스의 특정 연결강도가 신경회로의 뇌파 생성 및 변조 기능을 극대화시킬 수 있는 최적의 조합임을 밝혀냈다.
이번에 개발한 수학모형을 활용하면 전통적 생물학 실험을 통해 파악이 어려웠던 뉴런들 간의 다양한 상호작용을 이해하고 신경회로의 복잡한 설계원리를 파악할 수 있을 것으로 기대된다.
또한 여러 뇌질환 환자의 뇌에서 관측되는 비정상적인 뇌파 활동을 신경네트워크 차원에서 분석하고 규명할 수 있을 것으로 예상된다.
시스템생물학 접근을 통한 신경회로의 구조 및 기능 분석은 인공지능의 발전에도 기여할 것으로 기대된다. 두뇌 신경회로의 작동원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다. 자폐증이나 집중력 조절장애 등과 관련된 신경회로 규명, 두뇌 치료 기술 개발 등의 원천 의료기술 개발에도 혁신으로 이어질 수 있다.
조 교수는 “지금껏 뇌파의 생성 및 변조를 담당하는 핵심 신경회로가 밝혀진 바가 없었다”며 “이번 연구에서는 최근 커넥토믹스 (connectomcis) 연구를 통해 점차 밝혀지고 있는 뉴런간의 복잡한 연결성에 숨겨진 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작원리를 파악할 수 있는 새로운 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, 그리고 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뉴런 간 연결 강도에 내제된 기능적 설계원리 파악
그림2. 뇌파의 생성 및 변조를 담당하는 핵심 신경회로
2018.11.14 조회수 18788 고현용 연구원, 뇌전증 동반하는 소아 뇌종양 근본원인 밝혀
〈 고 현 용 연구원 〉
우리 대학 의과학대학원 고현용 연구원(지도교수 : 이정호 교수)이 난치성 뇌전증(간질 발작)을 일으키는 소아 뇌종양의 근본 원인과 뇌전증 발생의 원리를 규명해 새로운 치료법을 제시했다.
이번 연구 결과를 통해 수술 치료에 어려움이 있는 소아 뇌종양 기반의 난치성 뇌전증 치료에 큰 기여를 할 수 있을 것으로 기대된다.
고현용 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 메디슨(Nature Medicine)’ 9월 17일자 온라인 판에 게재됐다. (논문명: 비라프 체성 돌연변이가 소아뇌종양의 본질적 뇌전증 발생에 기여함; BRAF somatic mutation contributes to intrinsic epileptogenicity in pediatric brain tumors)
소아 뇌종양은 성인 뇌종양에 비해 난치성 뇌전증이 빈번하게 동반되는 특징을 갖고 있다. 그러나 소아 뇌종양에서 특이적으로 난치성 뇌전증이 발생하는 원인에 대해서는 밝혀진 바가 없으며 현존하는 항 뇌전증 약물에 반응하지 않기 때문에 환자의 치료에 많은 어려움을 겪고 있다.
연구팀은 소아 뇌종양 환지 뇌 조직 및 동물 모델의 분자 유전학적 분석을 통해 태아의 뇌 발달과정 중 신경 줄기 세포에 ‘비라프 (BRAF V600E)’라는 돌연변이가 발생하면서 난치성 뇌전증이 동반된 소아 뇌종양이 발생하는 것을 규명했다.
연구팀은 뇌전증이 동반된 소아 뇌종양 중 하나인 신경절 교세포종 환자의 종양 조직을 분자 유전학적으로 분석한 결과 비라프 유전변이가 태아 뇌 발달 과정 중 발생함을 확인했다.
이 변이를 동물 모델에서 구현해 신경절 교세포종의 병리 양상을 재현하고 발작을 관찰해 소아 뇌종양 기반의 뇌전증 치료용 동물 모델을 최초로 확립했다.
이를 이용해 면역 염색 분석과 전사체 분석을 실시했다. 소아 뇌종양에서 발생하는 난치성 뇌전증이 신경세포에 존재하는 비라프 변이로 인해 발생하고, 교세포에 존재하는 변이는 종양 덩어리를 형성하는데 중요한 역할을 하는 것을 확인했다.
특히 현재 임상에서 항암제로 사용되고 있는 비라프의 저해제를 동물 모델에 주입해 난치성 뇌전증 치료 효과를 확인했다.
1저자인 고현용 연구원은 “소아 뇌종양 환자의 경 줄기 세포에서 발생한 특정 돌연변이가 난치성 뇌전증 발생에 핵심적 역할을 한다는 것을 국내 연구진이 최초로 발견해냈다는 것에 큰 의미가 있다”며 “소아 뇌종양으로 인해 발생한 난치성 뇌전증의 근본 원인을 규명해 과적 치료의 가능성을 처음으로 보여준 것이다”고 말했다.
연구팀은 교원창업기업(소바젠, 대표 김병태)을 통해 소아 뇌종양 기반의 난치성 뇌전증 치료약 개발에 나설 예정이다.
이번 연구는 연세대학교 의과대학 세브란스 병원 김동석, 김세훈, 강훈철 교수 연구팀과 공동 연구 및 서경배과학재단, 보건복지부 세계선도과학자육성사업의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 수술전 (PreOP) 과 수술후 (PostOP) 의 신경절 교세포종의 MRI사진과 이형성이 동반된 신경세포가 있는 병리 조직 사진
그림2. BRAF V600E 돌연변이가 발생하여 뇌전증 동반 소아 뇌종양을 유발하는 과정 모식도
2018.09.18 조회수 12384
고현용 연구원, 뇌전증 동반하는 소아 뇌종양 근본원인 밝혀
〈 고 현 용 연구원 〉
우리 대학 의과학대학원 고현용 연구원(지도교수 : 이정호 교수)이 난치성 뇌전증(간질 발작)을 일으키는 소아 뇌종양의 근본 원인과 뇌전증 발생의 원리를 규명해 새로운 치료법을 제시했다.
이번 연구 결과를 통해 수술 치료에 어려움이 있는 소아 뇌종양 기반의 난치성 뇌전증 치료에 큰 기여를 할 수 있을 것으로 기대된다.
고현용 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 메디슨(Nature Medicine)’ 9월 17일자 온라인 판에 게재됐다. (논문명: 비라프 체성 돌연변이가 소아뇌종양의 본질적 뇌전증 발생에 기여함; BRAF somatic mutation contributes to intrinsic epileptogenicity in pediatric brain tumors)
소아 뇌종양은 성인 뇌종양에 비해 난치성 뇌전증이 빈번하게 동반되는 특징을 갖고 있다. 그러나 소아 뇌종양에서 특이적으로 난치성 뇌전증이 발생하는 원인에 대해서는 밝혀진 바가 없으며 현존하는 항 뇌전증 약물에 반응하지 않기 때문에 환자의 치료에 많은 어려움을 겪고 있다.
연구팀은 소아 뇌종양 환지 뇌 조직 및 동물 모델의 분자 유전학적 분석을 통해 태아의 뇌 발달과정 중 신경 줄기 세포에 ‘비라프 (BRAF V600E)’라는 돌연변이가 발생하면서 난치성 뇌전증이 동반된 소아 뇌종양이 발생하는 것을 규명했다.
연구팀은 뇌전증이 동반된 소아 뇌종양 중 하나인 신경절 교세포종 환자의 종양 조직을 분자 유전학적으로 분석한 결과 비라프 유전변이가 태아 뇌 발달 과정 중 발생함을 확인했다.
이 변이를 동물 모델에서 구현해 신경절 교세포종의 병리 양상을 재현하고 발작을 관찰해 소아 뇌종양 기반의 뇌전증 치료용 동물 모델을 최초로 확립했다.
이를 이용해 면역 염색 분석과 전사체 분석을 실시했다. 소아 뇌종양에서 발생하는 난치성 뇌전증이 신경세포에 존재하는 비라프 변이로 인해 발생하고, 교세포에 존재하는 변이는 종양 덩어리를 형성하는데 중요한 역할을 하는 것을 확인했다.
특히 현재 임상에서 항암제로 사용되고 있는 비라프의 저해제를 동물 모델에 주입해 난치성 뇌전증 치료 효과를 확인했다.
1저자인 고현용 연구원은 “소아 뇌종양 환자의 경 줄기 세포에서 발생한 특정 돌연변이가 난치성 뇌전증 발생에 핵심적 역할을 한다는 것을 국내 연구진이 최초로 발견해냈다는 것에 큰 의미가 있다”며 “소아 뇌종양으로 인해 발생한 난치성 뇌전증의 근본 원인을 규명해 과적 치료의 가능성을 처음으로 보여준 것이다”고 말했다.
연구팀은 교원창업기업(소바젠, 대표 김병태)을 통해 소아 뇌종양 기반의 난치성 뇌전증 치료약 개발에 나설 예정이다.
이번 연구는 연세대학교 의과대학 세브란스 병원 김동석, 김세훈, 강훈철 교수 연구팀과 공동 연구 및 서경배과학재단, 보건복지부 세계선도과학자육성사업의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 수술전 (PreOP) 과 수술후 (PostOP) 의 신경절 교세포종의 MRI사진과 이형성이 동반된 신경세포가 있는 병리 조직 사진
그림2. BRAF V600E 돌연변이가 발생하여 뇌전증 동반 소아 뇌종양을 유발하는 과정 모식도
2018.09.18 조회수 12384