-
 숨겨진 다자 간 관계를 추적·복원하는 AI '마리오' 개발
회의실에 여러 사람이 동시에 모여 회의하는 경우처럼, 다수의 객체가 동시에 상호작용하는 고차원 상호작용(higher-order interaction)은 다양한 분야에서 발생하며, 실세계의 복잡한 관계를 담고 있다. 하지만 기술적 제약으로 인해 많은 분야에서는 주로 개별 쌍 간의 저차원 정보만 수집돼, 전체 맥락이 손실되고 활용에 제약이 따랐다. KAIST 연구진이 이처럼 불완전한 정보만으로도 고차원 상호작용을 정밀하게 복원*하는 AI ‘마리오(MARIOH)’를 개발하며, 소셜 네트워크, 뇌과학, 생명과학 등 다양한 분야에서 혁신적 분석 가능성을 열었다.
*복원: 사라지거나 관측되지 않은 원래 구조를 추정/재구성하는 것
우리 대학 김재철AI대학원의 신기정 교수 연구팀이 저차원 상호작용 정보만으로 고차원 상호작용 구조를 높은 정확도로 복원할 수 있는 인공지능 기술인 ‘마리오(이하 MARIOH, Multiplicity-Aware Hypergraph Reconstruction)’를 개발했다고 5일 밝혔다.
고차원 상호작용 복원이 어려운 이유는 동일한 저차원 상호작용 구조로부터 파생될 수 있는 고차원 상호작용의 가능성이 무수히 많기 때문이다.
연구팀이 개발한 MARIOH의 핵심 아이디어는 저차원 상호작용의 다중도(multiplicity) 정보를 활용해, 해당 구조로부터 파생될 수 있는 고차원 상호작용의 후보 수를 획기적으로 줄이는 데 있다.
더불어, 효율적인 탐색 기법을 통해 유망한 상호작용 후보를 신속하게 식별하고, 다중도 기반의 심층 학습 기술을 활용해 각 후보가 실제 고차원 상호작용일 가능성을 정확하게 예측한다.
연구팀은 10개의 다양한 실세계 데이터 셋을 대상으로 한 실험 결과, MARIOH는 기존 기술 대비 최대 74% 높은 정확도로 고차원 상호작용을 복원하는 데 성공했다.
예를 들어, 논문 공저 관계 데이터(출처: DBLP)에서는 98% 이상의 복원 정확도를 달성해, 약 86% 수준에 머무는 기존 기술을 크게 앞질렀다. 또한, 복원된 고차원 구조를 활용할 경우, 예측, 분류 등 다양한 작업에서의 성능이 향상되는 것으로 나타났다.
신기정 교수는 “MARIOH는 단순화된 연결 정보 정보에만 의존하던 기존 접근에서 벗어나, 실제 세계의 복잡한 연결 관계를 정밀하게 활용할 가능성을 열어 준다”라며, “단체 대화나 협업 네트워크를 다루는 소셜 네트워크 분석, 단백질 복합체나 유전자 간 상호작용을 분석하는 생명과학, 다중 뇌 영역 간 동시 활동을 추적하는 뇌과학 등 다양한 분야에서 폭넓게 활용될 수 있을 것”이라고 밝혔다.
김재철AI대학원의 이규한 석박통합과정(現 GraphAI 소프트웨어 엔지니어)과 이건 석박사통합과정, 신기정 교수가 저자로 참여한 이번 연구는 지난 5월에 홍콩에서 열린 제41회 IEEE 국제 데이터공학 학회(IEEE International Conference on Data Engineering, IEEE ICDE)에서 발표됐다.
※논문명: MARIOH: Multiplicity-Aware Hypergraph Reconstruction
※DOI: https://doi.ieeecomputersociety.org/10.1109/ICDE65448.2025.00233
한편, 이번 연구는 정보통신기획평가원의 지원을 받은 ‘EntireDB2AI: 전체 관계형 데이터베이스를 종합적으로 활용하는 심층 표현 학습 및 예측 원천기술과 소프트웨어 개발’ 과제와 한국연구재단의 지원을 받은 ‘그래프 파운데이션 모델: 다양한 모달리티 및 도메인에 적용 가능한 그래프 기반 기계 학습’과제의 성과다.
숨겨진 다자 간 관계를 추적·복원하는 AI '마리오' 개발
회의실에 여러 사람이 동시에 모여 회의하는 경우처럼, 다수의 객체가 동시에 상호작용하는 고차원 상호작용(higher-order interaction)은 다양한 분야에서 발생하며, 실세계의 복잡한 관계를 담고 있다. 하지만 기술적 제약으로 인해 많은 분야에서는 주로 개별 쌍 간의 저차원 정보만 수집돼, 전체 맥락이 손실되고 활용에 제약이 따랐다. KAIST 연구진이 이처럼 불완전한 정보만으로도 고차원 상호작용을 정밀하게 복원*하는 AI ‘마리오(MARIOH)’를 개발하며, 소셜 네트워크, 뇌과학, 생명과학 등 다양한 분야에서 혁신적 분석 가능성을 열었다.
*복원: 사라지거나 관측되지 않은 원래 구조를 추정/재구성하는 것
우리 대학 김재철AI대학원의 신기정 교수 연구팀이 저차원 상호작용 정보만으로 고차원 상호작용 구조를 높은 정확도로 복원할 수 있는 인공지능 기술인 ‘마리오(이하 MARIOH, Multiplicity-Aware Hypergraph Reconstruction)’를 개발했다고 5일 밝혔다.
고차원 상호작용 복원이 어려운 이유는 동일한 저차원 상호작용 구조로부터 파생될 수 있는 고차원 상호작용의 가능성이 무수히 많기 때문이다.
연구팀이 개발한 MARIOH의 핵심 아이디어는 저차원 상호작용의 다중도(multiplicity) 정보를 활용해, 해당 구조로부터 파생될 수 있는 고차원 상호작용의 후보 수를 획기적으로 줄이는 데 있다.
더불어, 효율적인 탐색 기법을 통해 유망한 상호작용 후보를 신속하게 식별하고, 다중도 기반의 심층 학습 기술을 활용해 각 후보가 실제 고차원 상호작용일 가능성을 정확하게 예측한다.
연구팀은 10개의 다양한 실세계 데이터 셋을 대상으로 한 실험 결과, MARIOH는 기존 기술 대비 최대 74% 높은 정확도로 고차원 상호작용을 복원하는 데 성공했다.
예를 들어, 논문 공저 관계 데이터(출처: DBLP)에서는 98% 이상의 복원 정확도를 달성해, 약 86% 수준에 머무는 기존 기술을 크게 앞질렀다. 또한, 복원된 고차원 구조를 활용할 경우, 예측, 분류 등 다양한 작업에서의 성능이 향상되는 것으로 나타났다.
신기정 교수는 “MARIOH는 단순화된 연결 정보 정보에만 의존하던 기존 접근에서 벗어나, 실제 세계의 복잡한 연결 관계를 정밀하게 활용할 가능성을 열어 준다”라며, “단체 대화나 협업 네트워크를 다루는 소셜 네트워크 분석, 단백질 복합체나 유전자 간 상호작용을 분석하는 생명과학, 다중 뇌 영역 간 동시 활동을 추적하는 뇌과학 등 다양한 분야에서 폭넓게 활용될 수 있을 것”이라고 밝혔다.
김재철AI대학원의 이규한 석박통합과정(現 GraphAI 소프트웨어 엔지니어)과 이건 석박사통합과정, 신기정 교수가 저자로 참여한 이번 연구는 지난 5월에 홍콩에서 열린 제41회 IEEE 국제 데이터공학 학회(IEEE International Conference on Data Engineering, IEEE ICDE)에서 발표됐다.
※논문명: MARIOH: Multiplicity-Aware Hypergraph Reconstruction
※DOI: https://doi.ieeecomputersociety.org/10.1109/ICDE65448.2025.00233
한편, 이번 연구는 정보통신기획평가원의 지원을 받은 ‘EntireDB2AI: 전체 관계형 데이터베이스를 종합적으로 활용하는 심층 표현 학습 및 예측 원천기술과 소프트웨어 개발’ 과제와 한국연구재단의 지원을 받은 ‘그래프 파운데이션 모델: 다양한 모달리티 및 도메인에 적용 가능한 그래프 기반 기계 학습’과제의 성과다.
2025.08.05
조회수 616
-
 왜 식물이 스스로 공격하나? 유전 충돌 비밀 밝혀
고유의 면역 시스템을 지닌 식물은 때때로 자신의 단백질 구조를 병원균으로 오인해 스스로를 공격하는 ‘자가면역 반응’을 일으키기도 한다. 특히 서로 다른 품종 간 교배 후, 후손 식물이 건강하게 자라지 못하고 스스로 고사하는‘잡종 괴사(hybrid necrosis)’현상은 오랫동안 식물학자와 농업 연구자들에게 해결이 어려운 난제로 여겨져 왔다. 이에 KAIST를 포함한 국내외 연구진은 식물 자가면역 반응의 유발 메커니즘을 규명하고, 이를 사전에 예측·회피할 수 있는 신개념 품종 개량 전략을 제시하는 데 성공했다.
우리 대학 송지준 교수 연구팀이 국립싱가포르대학(NUS), 옥스퍼드대학 연구팀과 공동연구를 통해, 초저온 전자현미경(Cryo-EM) 기술을 활용, 식물 자가면역 반응을 유발하는 단백질 복합체‘DM3’의 구조와 기능을 규명했다고 21일 밝혔다.
이번 연구는 식물 잡종 간 교배 시 면역 수용체의 비정상적 반응으로 발생하는‘잡종 괴사(hybrid necrosis)’의 원인을 ‘단백질 구조의 결함’에서 찾았다는 점에서 주목을 받고 있다.
이 단백질(DM3)은 원래 식물의 면역 반응에 관여하는 효소인데, ‘위험 조합(DANGEROUS MIX, DM)’이라 불리는 특정 단백질 조합에서 DM3 단백질의 구조가 망가지면서 문제를 일으킨다.
특히, DM3의 변이체 중 하나는 ‘DM3Col-0’ 변이체는 6개의 단백질이 안정적으로 결합하며 정상으로 인식되어 면역 반응을 일으키지 않는다. 이에 반해 또 다른 ‘DM3Hh-0’변이체는 6개 단백질 간의 결합이 제대로 안되어 식물은 이를 ‘비정상적인 상태’로 인식하고 면역 경보를 울리며 자가 면역을 유발한다.
연구팀은 해당 구조를 원자 해상도의 초저온 전자현미경(Cryo-EM)을 통해 시각화했으며, 면역 유도 능력은 DM3 단백질의 효소 기능 때문이 아닌, ‘단백질 결합력의 차이’때문임을 밝혀냈다.
이는 식물이 ‘외부 병원균’뿐만 아니라‘내부 단백질 구조’가 비정상적으로 변화하는 경우에도 이를 병균으로 인식해 면역반응을 일으킬 수 있음을 보여준다.
해당 연구는 서로 다른 품종의 식물을 교배하면서 유전자가 섞이고 단백질 구조가 변할 경우, 식물 면역계가 얼마나 민감하게 변화하며 자가면역반응을 일으키는지 보여주며, 자연교배 및 품종개량 과정에서 발생할 수 있는 유전적 충돌(Genetic Incompatibility)에 대한 이해를 크게 높였다.
제1 저자인 김기정 박사는 “국제적 연구 협력을 통해 구조생화학, 유전학, 세포생물학적 실험을 망라해 완성도 높은 연구로 자가면역현상을 이용, 식물 면역계를 이해하는 새로운 관점을 제시했다”라고 말했다.
연구를 주도한 생명과학과 송지준 교수는 “면역 시스템이 외부 병원균뿐 아니라 자기 단백질의 구조적 이상까지 감지할 수 있다는 사실은 식물 생명공학 및 작물 교배 전략에 새로운 기준을 제시할 것”이라며, “초저온 전자현미경 기반의 구조 분석이 유전자 간 상호작용의 본질을 이해하는 데 중요한 도구가 될 것”이라고 말했다.
송지준 교수와 옥스퍼드대 최은영 교수가 공동 책임저자로, 생명과학과 김기정 박사(現 취리히 대학교 박사후 연구원)과 국립싱가폴 대학 웨이린 완(Wei-Lin Wan) 박사가 공동 제1 저자로, 김나윤 박사과정 학생이 제2 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’의 자매지인 `분자 세포(Molecular Cell)' 7월 17일 자에 출판됐다.
※논문명: Structural determinants of DANGEROUS MIX 3, an alpha/beta hydrolase that triggers NLR-mediated genetic incompatibility in plants
※DOI: https://doi.org/10.1016/j.molcel.2025.06.021
한편, 이번 연구는 KAIST 그랜드챌린지 30(Grand Challenge 30) 과제 지원을 받아 수행됐다.
왜 식물이 스스로 공격하나? 유전 충돌 비밀 밝혀
고유의 면역 시스템을 지닌 식물은 때때로 자신의 단백질 구조를 병원균으로 오인해 스스로를 공격하는 ‘자가면역 반응’을 일으키기도 한다. 특히 서로 다른 품종 간 교배 후, 후손 식물이 건강하게 자라지 못하고 스스로 고사하는‘잡종 괴사(hybrid necrosis)’현상은 오랫동안 식물학자와 농업 연구자들에게 해결이 어려운 난제로 여겨져 왔다. 이에 KAIST를 포함한 국내외 연구진은 식물 자가면역 반응의 유발 메커니즘을 규명하고, 이를 사전에 예측·회피할 수 있는 신개념 품종 개량 전략을 제시하는 데 성공했다.
우리 대학 송지준 교수 연구팀이 국립싱가포르대학(NUS), 옥스퍼드대학 연구팀과 공동연구를 통해, 초저온 전자현미경(Cryo-EM) 기술을 활용, 식물 자가면역 반응을 유발하는 단백질 복합체‘DM3’의 구조와 기능을 규명했다고 21일 밝혔다.
이번 연구는 식물 잡종 간 교배 시 면역 수용체의 비정상적 반응으로 발생하는‘잡종 괴사(hybrid necrosis)’의 원인을 ‘단백질 구조의 결함’에서 찾았다는 점에서 주목을 받고 있다.
이 단백질(DM3)은 원래 식물의 면역 반응에 관여하는 효소인데, ‘위험 조합(DANGEROUS MIX, DM)’이라 불리는 특정 단백질 조합에서 DM3 단백질의 구조가 망가지면서 문제를 일으킨다.
특히, DM3의 변이체 중 하나는 ‘DM3Col-0’ 변이체는 6개의 단백질이 안정적으로 결합하며 정상으로 인식되어 면역 반응을 일으키지 않는다. 이에 반해 또 다른 ‘DM3Hh-0’변이체는 6개 단백질 간의 결합이 제대로 안되어 식물은 이를 ‘비정상적인 상태’로 인식하고 면역 경보를 울리며 자가 면역을 유발한다.
연구팀은 해당 구조를 원자 해상도의 초저온 전자현미경(Cryo-EM)을 통해 시각화했으며, 면역 유도 능력은 DM3 단백질의 효소 기능 때문이 아닌, ‘단백질 결합력의 차이’때문임을 밝혀냈다.
이는 식물이 ‘외부 병원균’뿐만 아니라‘내부 단백질 구조’가 비정상적으로 변화하는 경우에도 이를 병균으로 인식해 면역반응을 일으킬 수 있음을 보여준다.
해당 연구는 서로 다른 품종의 식물을 교배하면서 유전자가 섞이고 단백질 구조가 변할 경우, 식물 면역계가 얼마나 민감하게 변화하며 자가면역반응을 일으키는지 보여주며, 자연교배 및 품종개량 과정에서 발생할 수 있는 유전적 충돌(Genetic Incompatibility)에 대한 이해를 크게 높였다.
제1 저자인 김기정 박사는 “국제적 연구 협력을 통해 구조생화학, 유전학, 세포생물학적 실험을 망라해 완성도 높은 연구로 자가면역현상을 이용, 식물 면역계를 이해하는 새로운 관점을 제시했다”라고 말했다.
연구를 주도한 생명과학과 송지준 교수는 “면역 시스템이 외부 병원균뿐 아니라 자기 단백질의 구조적 이상까지 감지할 수 있다는 사실은 식물 생명공학 및 작물 교배 전략에 새로운 기준을 제시할 것”이라며, “초저온 전자현미경 기반의 구조 분석이 유전자 간 상호작용의 본질을 이해하는 데 중요한 도구가 될 것”이라고 말했다.
송지준 교수와 옥스퍼드대 최은영 교수가 공동 책임저자로, 생명과학과 김기정 박사(現 취리히 대학교 박사후 연구원)과 국립싱가폴 대학 웨이린 완(Wei-Lin Wan) 박사가 공동 제1 저자로, 김나윤 박사과정 학생이 제2 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’의 자매지인 `분자 세포(Molecular Cell)' 7월 17일 자에 출판됐다.
※논문명: Structural determinants of DANGEROUS MIX 3, an alpha/beta hydrolase that triggers NLR-mediated genetic incompatibility in plants
※DOI: https://doi.org/10.1016/j.molcel.2025.06.021
한편, 이번 연구는 KAIST 그랜드챌린지 30(Grand Challenge 30) 과제 지원을 받아 수행됐다.
2025.07.21
조회수 802
-
 고온 실험 없이 AI로 '최적 합금' 예측 시대 연다
자동차와 기계 부품 등에 사용되는 강철 합금은 일반적으로 고온에서 녹이는(융해) 공정을 거쳐 제조된다. 이때 성분이 변하지 않고 그대로 녹는 현상을 ‘합치 융해(congruent melting)’라고 한다. 우리 연구진은 이처럼 고온 실험을 통해서만 가능했던 합금의 융해 특성을 인공지능(AI)으로 해결했다. 이번 연구는 고질적인 난제였던 합금이 녹을 때 서로 얼마나 잘 섞이는지를 미리 예측함으로써, 미래 합금 개발의 방향성을 제시한다는 점에서 주목받고 있다.
우리 대학 신소재공학과 홍승범 교수 연구팀이 미국 노스웨스턴대 크리스 울버튼(Chris Wolverton) 교수팀과 국제 공동연구를 통해, 밀도범함수이론(DFT)* 기반의 형성에너지(합금이 얼마나 안정적인지를 나타내는 값) 데이터를 활용해 합금이 녹을 때 성분이 유지되는지를 예측하는 고정확도 머신러닝 모델을 개발했다고 14일 밝혔다.
*밀도범함수이론(Density Functional Theory, DFT): 전자 밀도(electron density)를 기반으로 시스템의 전체 에너지를 계산하는 방법
연구팀은 밀도범함수이론을 통해 계산한 형성에너지와, 기존의 실험적 융해 반응 데이터를 머신러닝에 결합해 4,536개의 이원계 화합물에 대한 융해 반응 유형을 학습한 후, 그 예측 모델을 구성했다.
다양한 머신러닝 알고리즘 중 특히 ‘XGBoost’ 기반 분류 모델이 합금이 잘 섞이는지 여부에 대해 가장 높은 정확도를 보였으며, 약 82.5%의 예측 정확도를 달성했다.
연구팀은 또한 샤플리(Shapley) 기법*을 활용해 모델의 주요 특징(feature)들을 분석했으며, 이 중에서도 기울기 변화가 크다는 것은 그 조성에서 에너지적으로 매우 유리한(=안정한) 상태가 형성된다는 뜻으로 ‘형성에너지 곡선의 기울기 변화(convex hull sharpness)’가 가장 중요한 인자로 도출됐다.
*샤플리기법: AI가 어떤 이유로 그렇게 판단했는지를 알려주는 설명 도구
이번 연구의 가장 큰 의의는 고온 실험 없이도 소재의 융해 반응 경향성을 예측할 수 있다는 점이다. 이는 특히 고엔트로피 합금이나 초내열 합금 등 실험이 어려운 소재 군에서 매우 유용하며, 향후 복잡한 다성분계 합금 설계에도 확장될 수 있다.
또한, AI 모델이 도출한 주요 물리량은 합금이 잘 변하고, 안정적인지 등에 대한 실제 실험 결과와 높은 일치도를 보였고, 향후 다양한 금속재료 개발 및 구조 안정성 예측 등 널리 활용될 수 있을 것으로 기대된다.
홍승범 교수는 “이번 연구는 계산과 실험 데이터, 그리고 머신러닝의 융합을 통해 기존의 경험적 합금 설계 방식에서 벗어나 데이터 기반의 예측적 소재 개발이 가능하다는 가능성을 보여준 사례”라며 “향후 생성형 모델, 강화학습 등의 최신 AI 기술을 접목하면 완전히 새로운 합금을 자동으로 설계하는 시대가 열릴 것”이라고 말했다.
신소재공학과 최영우 박사과정 연구원이 제1 저자로 참여한 이번 연구는 미국물리협회(American Institute of Physics, AIP)에서 발간하는 머신러닝 분야의 권위 있는 학술지인 ‘APL 머신러닝(Machine Learning)’ 5월호에 게재 및 ‘특집 논문(Featured article)’로 선정됐다.
※ 논문 제목: Machine learning-based melting congruency prediction of binary compounds using density functional theory-calculated formation energy
※ DOI: https://doi.org/10.1063/5.0247514
한편, 이번 연구는 과학기술정보통신부와 한국연구재단의 지원으로 수행됐다.
고온 실험 없이 AI로 '최적 합금' 예측 시대 연다
자동차와 기계 부품 등에 사용되는 강철 합금은 일반적으로 고온에서 녹이는(융해) 공정을 거쳐 제조된다. 이때 성분이 변하지 않고 그대로 녹는 현상을 ‘합치 융해(congruent melting)’라고 한다. 우리 연구진은 이처럼 고온 실험을 통해서만 가능했던 합금의 융해 특성을 인공지능(AI)으로 해결했다. 이번 연구는 고질적인 난제였던 합금이 녹을 때 서로 얼마나 잘 섞이는지를 미리 예측함으로써, 미래 합금 개발의 방향성을 제시한다는 점에서 주목받고 있다.
우리 대학 신소재공학과 홍승범 교수 연구팀이 미국 노스웨스턴대 크리스 울버튼(Chris Wolverton) 교수팀과 국제 공동연구를 통해, 밀도범함수이론(DFT)* 기반의 형성에너지(합금이 얼마나 안정적인지를 나타내는 값) 데이터를 활용해 합금이 녹을 때 성분이 유지되는지를 예측하는 고정확도 머신러닝 모델을 개발했다고 14일 밝혔다.
*밀도범함수이론(Density Functional Theory, DFT): 전자 밀도(electron density)를 기반으로 시스템의 전체 에너지를 계산하는 방법
연구팀은 밀도범함수이론을 통해 계산한 형성에너지와, 기존의 실험적 융해 반응 데이터를 머신러닝에 결합해 4,536개의 이원계 화합물에 대한 융해 반응 유형을 학습한 후, 그 예측 모델을 구성했다.
다양한 머신러닝 알고리즘 중 특히 ‘XGBoost’ 기반 분류 모델이 합금이 잘 섞이는지 여부에 대해 가장 높은 정확도를 보였으며, 약 82.5%의 예측 정확도를 달성했다.
연구팀은 또한 샤플리(Shapley) 기법*을 활용해 모델의 주요 특징(feature)들을 분석했으며, 이 중에서도 기울기 변화가 크다는 것은 그 조성에서 에너지적으로 매우 유리한(=안정한) 상태가 형성된다는 뜻으로 ‘형성에너지 곡선의 기울기 변화(convex hull sharpness)’가 가장 중요한 인자로 도출됐다.
*샤플리기법: AI가 어떤 이유로 그렇게 판단했는지를 알려주는 설명 도구
이번 연구의 가장 큰 의의는 고온 실험 없이도 소재의 융해 반응 경향성을 예측할 수 있다는 점이다. 이는 특히 고엔트로피 합금이나 초내열 합금 등 실험이 어려운 소재 군에서 매우 유용하며, 향후 복잡한 다성분계 합금 설계에도 확장될 수 있다.
또한, AI 모델이 도출한 주요 물리량은 합금이 잘 변하고, 안정적인지 등에 대한 실제 실험 결과와 높은 일치도를 보였고, 향후 다양한 금속재료 개발 및 구조 안정성 예측 등 널리 활용될 수 있을 것으로 기대된다.
홍승범 교수는 “이번 연구는 계산과 실험 데이터, 그리고 머신러닝의 융합을 통해 기존의 경험적 합금 설계 방식에서 벗어나 데이터 기반의 예측적 소재 개발이 가능하다는 가능성을 보여준 사례”라며 “향후 생성형 모델, 강화학습 등의 최신 AI 기술을 접목하면 완전히 새로운 합금을 자동으로 설계하는 시대가 열릴 것”이라고 말했다.
신소재공학과 최영우 박사과정 연구원이 제1 저자로 참여한 이번 연구는 미국물리협회(American Institute of Physics, AIP)에서 발간하는 머신러닝 분야의 권위 있는 학술지인 ‘APL 머신러닝(Machine Learning)’ 5월호에 게재 및 ‘특집 논문(Featured article)’로 선정됐다.
※ 논문 제목: Machine learning-based melting congruency prediction of binary compounds using density functional theory-calculated formation energy
※ DOI: https://doi.org/10.1063/5.0247514
한편, 이번 연구는 과학기술정보통신부와 한국연구재단의 지원으로 수행됐다.
2025.07.14
조회수 985
-
 AI로 방사성 오염 '아이오딘' 제거용 최적 신소재 발굴
원자력 에너지 활용에 있어 방사성 폐기물 관리는 핵심적인 과제 중 하나다. 특히 방사성 ‘아이오딘(요오드)’는 반감기가 길고(I-129의 경우 1,570만 년), 이동성 및 생체 유독성이 높아 환경 및 인체에 심각한 위험을 초래할 수 있다. 한국 연구진이 인공지능을 활용해 아이오딘을 제거할 원자력 환경 정화용 신소재 발굴에 성공했다. 연구팀은 향후 방사성 오염 흡착용 분말부터 오염수 처리 필터까지 다양한 산학협력을 통해 상용화를 추진할 예정이다.
우리 대학 원자력및양자공학과 류호진 교수 연구팀이 한국화학연구원 디지털화학연구센터 노주환 박사가 협력하여, 인공지능을 활용해 방사성 오염 물질이 될 수 있는 아이오딘을 효과적으로 제거하는 신소재를 발굴하는 기술을 개발했다고 2일 밝혔다.
최근 보고에 따르면 방사능 오염 물질인 아이오딘이 수용액 환경에서 아이오딘산염(IO3-) 형태로 존재하는 것으로 밝혀졌으나, 기존의 은 기반 흡착제는 이에 대해 낮은 화학적 흡착력을 가져 비효율적이었다. 따라서 아이오딘산염을 효과적으로 제거할 수 있는 새로운 흡착제 신소재 개발이 시급한 실정이다.
류호진 교수 연구팀은 기계학습을 활용한 실험 전략을 통해 다양한 금속원소를 함유한 ‘이중층 수산화물(Layered Double Hydroxide, 이하 LDH)’이라는 화합물 중 최적의 아이오딘산염 흡착제를 발굴했다.
이번 연구에서 개발된 구리-크롬-철-알루미늄 기반의 다중금속 이중층 수산화물 Cu3(CrFeAl)은 아이오딘산염에 대해 90% 이상의 뛰어난 흡착 성능을 보였다. 이는 기존의 시행착오 실험 방식으로는 탐색이 어려운 방대한 물질 조성 공간을 인공지능 기반의 능동학습법을 통해 효율적으로 탐색해 얻어낸 성과다.
연구팀은 이중층 수산화물(이하 LDH)이 고엔트로피 재료와 같이 다양한 금속 조성을 가질 수 있고 음이온 흡착에 유리한 구조를 지녔다는 점에 주목했다. 그러나 다중금속 LDH의 경우 가능한 금속 조합이 너무 많아 기존의 실험 방식으로는 최적의 조합을 찾기 어려웠다.
이를 해결하기 위해 연구팀은 인공지능(기계학습)을 도입했다. 초기 24개의 2원계 및 96개의 3원계 LDH 실험 데이터로 학습을 시작해, 4원계 및 5원계 후보 물질로 탐색을 확장했다. 이 결과 전체 후보 물질 중 단 16%에 대해서만 실험을 수행하고도 아이오딘산염 제거에 최적인 신소재 물질을 찾아낼 수 있었다.
류호진 교수는 “인공지능을 활용하면 방대한 신소재 후보 물질 군에서 방사성 오염 제거용 물질을 효율적으로 찾아낼 가능성을 보여, 원자력 환경 정화용 신소재 개발에 필요한 연구를 가속화하는데 기여할 것으로 기대된다”고 말했다.
류 교수 연구팀은 개발된 분말 기술에 대한 국내 특허를 출원했으며 이를 기반으로 해외 특허 출원을 진행 중이다. 연구팀은 향후 방사성 오염 흡착용 분말의 다양한 사용 환경에서의 성능을 고도화하고, 오염수 처리 필터 개발 분야에서 산학 협력을 통한 상용화 방안을 추진할 예정이다.
우리 대학 신소재공학과를 졸업한 이수정 박사와 한국화학연구원 디지털화학연구센터 노주환 박사가 제1 저자로 참여한 이번 연구는 이번 연구 결과는 환경 분야 국제 저명 학술지인 ‘위험물질 저널(Journal of Hazardous Materials)'에 5월 26일 온라인 게재됐다.
※논문명: Discovery of multi-metal-layered double hydroxides for decontamination of iodate by machine learning-assisted experiments
※DOI: https://doi.org/10.1016/j.jhazmat.2025.138735
이번 연구는 과학기술정보통신부 한국연구재단의 원자력기초연구지원사업과 나노·소재기술개발사업의 지원으로 수행됐다.
AI로 방사성 오염 '아이오딘' 제거용 최적 신소재 발굴
원자력 에너지 활용에 있어 방사성 폐기물 관리는 핵심적인 과제 중 하나다. 특히 방사성 ‘아이오딘(요오드)’는 반감기가 길고(I-129의 경우 1,570만 년), 이동성 및 생체 유독성이 높아 환경 및 인체에 심각한 위험을 초래할 수 있다. 한국 연구진이 인공지능을 활용해 아이오딘을 제거할 원자력 환경 정화용 신소재 발굴에 성공했다. 연구팀은 향후 방사성 오염 흡착용 분말부터 오염수 처리 필터까지 다양한 산학협력을 통해 상용화를 추진할 예정이다.
우리 대학 원자력및양자공학과 류호진 교수 연구팀이 한국화학연구원 디지털화학연구센터 노주환 박사가 협력하여, 인공지능을 활용해 방사성 오염 물질이 될 수 있는 아이오딘을 효과적으로 제거하는 신소재를 발굴하는 기술을 개발했다고 2일 밝혔다.
최근 보고에 따르면 방사능 오염 물질인 아이오딘이 수용액 환경에서 아이오딘산염(IO3-) 형태로 존재하는 것으로 밝혀졌으나, 기존의 은 기반 흡착제는 이에 대해 낮은 화학적 흡착력을 가져 비효율적이었다. 따라서 아이오딘산염을 효과적으로 제거할 수 있는 새로운 흡착제 신소재 개발이 시급한 실정이다.
류호진 교수 연구팀은 기계학습을 활용한 실험 전략을 통해 다양한 금속원소를 함유한 ‘이중층 수산화물(Layered Double Hydroxide, 이하 LDH)’이라는 화합물 중 최적의 아이오딘산염 흡착제를 발굴했다.
이번 연구에서 개발된 구리-크롬-철-알루미늄 기반의 다중금속 이중층 수산화물 Cu3(CrFeAl)은 아이오딘산염에 대해 90% 이상의 뛰어난 흡착 성능을 보였다. 이는 기존의 시행착오 실험 방식으로는 탐색이 어려운 방대한 물질 조성 공간을 인공지능 기반의 능동학습법을 통해 효율적으로 탐색해 얻어낸 성과다.
연구팀은 이중층 수산화물(이하 LDH)이 고엔트로피 재료와 같이 다양한 금속 조성을 가질 수 있고 음이온 흡착에 유리한 구조를 지녔다는 점에 주목했다. 그러나 다중금속 LDH의 경우 가능한 금속 조합이 너무 많아 기존의 실험 방식으로는 최적의 조합을 찾기 어려웠다.
이를 해결하기 위해 연구팀은 인공지능(기계학습)을 도입했다. 초기 24개의 2원계 및 96개의 3원계 LDH 실험 데이터로 학습을 시작해, 4원계 및 5원계 후보 물질로 탐색을 확장했다. 이 결과 전체 후보 물질 중 단 16%에 대해서만 실험을 수행하고도 아이오딘산염 제거에 최적인 신소재 물질을 찾아낼 수 있었다.
류호진 교수는 “인공지능을 활용하면 방대한 신소재 후보 물질 군에서 방사성 오염 제거용 물질을 효율적으로 찾아낼 가능성을 보여, 원자력 환경 정화용 신소재 개발에 필요한 연구를 가속화하는데 기여할 것으로 기대된다”고 말했다.
류 교수 연구팀은 개발된 분말 기술에 대한 국내 특허를 출원했으며 이를 기반으로 해외 특허 출원을 진행 중이다. 연구팀은 향후 방사성 오염 흡착용 분말의 다양한 사용 환경에서의 성능을 고도화하고, 오염수 처리 필터 개발 분야에서 산학 협력을 통한 상용화 방안을 추진할 예정이다.
우리 대학 신소재공학과를 졸업한 이수정 박사와 한국화학연구원 디지털화학연구센터 노주환 박사가 제1 저자로 참여한 이번 연구는 이번 연구 결과는 환경 분야 국제 저명 학술지인 ‘위험물질 저널(Journal of Hazardous Materials)'에 5월 26일 온라인 게재됐다.
※논문명: Discovery of multi-metal-layered double hydroxides for decontamination of iodate by machine learning-assisted experiments
※DOI: https://doi.org/10.1016/j.jhazmat.2025.138735
이번 연구는 과학기술정보통신부 한국연구재단의 원자력기초연구지원사업과 나노·소재기술개발사업의 지원으로 수행됐다.
2025.07.02
조회수 1531
-
 코로나바이러스 전염 메커니즘 규명
중증급성호흡기증후군(이하 SARS) 코로나바이러스와 같은 코로나 19(COVID-19)는 전 세계적 팬데믹으로 짧은 시간 안에 확산되었지만 왜 급격히 복제돼 빠르게 전염되는지 기전이 아직까지 규명되지 않았다. 우리 연구진이 코로나바이러스 핵심 효소 단백질(헬리케이스)의 복제과정이 급격히 촉진되어 전염되는 메커니즘을 밝혀내며 바이러스 백신 및 치료제 개발에 새로운 가능성을 제시했다.
우리 대학 생명과학과 이광록 교수 연구팀이 nsp13 단백질*은 두 가지 활성을 가지고 있어 시너지 효과를 내며, 이를 통해 SARS 코로나바이러스의 유전물질인 RNA 복제를 촉진한다는 기전을 규명했다고 17일 밝혔다.
*nsp13 단백질: SARS 코로나바이러스의 헬리케이스로, 바이러스가 증식하는 데 필수적인 유전자 복제와 전사 과정에 중요한 효소이다. 헬리케이스는 마치 지퍼를 열고 닫는 것처럼 DNA나 RNA의 꼬인 구조를 풀어주는데, 유전정보를 읽거나 복제할 때 유전물질을 먼저 풀려야 하므로 필수적이다. 쉽게 말해, 헬리케이스는 엉킨 실타래를 푸는 효소단백질이다.
여기 두 가지 활성에 해당되는 첫번째 헬리케이스 활성은 DNA 또는 RNA와 같은 이중 가닥 핵산을 단일 가닥으로 풀어주는 효소 기능이며, 복제나 전사 과정을 촉진시킨다. 두번째 RNA 샤페론 활성은 핵산 구조의 올바른 접힘(folding)과 풀림 기능을 돕는 단백질로, 잘못된 RNA를 교정하거나 안정성을 향상시켜 세포 내 RNA 대사과정을 돕는 역할을 한다.
코로나바이러스가 빠르게 전파하기 위해서는 바이러스의 유전물질을 빠르게 복제하고 구성성분인 단백질을 생산해서 이들을 조합하는 것이 필수적이다.
연구팀은 첫 번째 단계인 유전물질의 RNA 복제가 다른 바이러스에 비해 왜 빠르게 일어나는지 알려지지 않았으나, nsp13 단백질이 기존의 헬리케이스 활성과 이제까지 알려지지 않은 새로운 샤페론 활성으로 유전자 복제 과정을 빠르게 촉진한다는 것을 규명했다.
nsp13 단백질은 유전적으로 잘 보존되어 다양한 변이 코로나바이러스에 대응하는 백신이나 감염 치료의 중요 표적이지만, 정확한 작용 메커니즘에 대해서는 완전한 이해가 부족했다.
연구팀은 nsp13 헬리케이스가 ATP(아데노신 삼인산)*를 분해하여 나온 화학에너지를 이용하여 유전물질인 RNA의 꼬인 구조를 단일 가닥으로 풀어주고 부산물로 ADP(아데노신 이인산)*가 생성하게 된다. 이때 생성된 ADP가 nsp13와 재결합하게 되면 샤페론 기능을 활성화시켜 RNA 이차구조를 추가로 불안정화한다는 사실을 알아냈다.
*ATP(아데노신 삼인산)는 충전된 배터리처럼 에너지를 담고 있고 효소가 일을 할 때는 에너지를 공급해준다. ATP는 인산 3개를 가지고 있어 인산이 분해 될 때 에너지를 방출하고 인산 2개를 가진 ADP(아데노신 이인산)를 부산물로 생성한다.
결론적으로 헬리케이스 활성과 샤페론 활성이 시공간적으로 동시에 협력해 RNA 복제를 촉진하게 된다는 새로운 방식의 작용기전을 규명했다.
이광록 교수는 “이번 연구는 대표적 핵산-효소 단백질인 헬리케이스가 ADP를 통해 샤페론적 활성을 나타내는 새로운 발견이며, 이를 통해 헬리케이스의 기능 다양성에 대한 이해의 폭을 넓혀주고, SARS 코로나바이러스의 다양한 변이에 대응할 효과적 치료제 및 백신 개발의 실마리를 제공할 것으로 기대한다”라고 연구 결과의 의의를 밝혔다.
이 연구는 유정민 박사가 제 1저자로 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF: 16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 29일 게재됐다. (논문명 : A novel ADP-directed chaperone function facilitates the ATP-driven motor activity of SARS-CoV helicase) (doi: 10.1093/nar/gkaf034)
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구지원, 선도연구센터 지원사업, 글로벌 기초연구 지원사업과 합성생물학핵심기술개발사업의 지원을 받아 수행됐다.
코로나바이러스 전염 메커니즘 규명
중증급성호흡기증후군(이하 SARS) 코로나바이러스와 같은 코로나 19(COVID-19)는 전 세계적 팬데믹으로 짧은 시간 안에 확산되었지만 왜 급격히 복제돼 빠르게 전염되는지 기전이 아직까지 규명되지 않았다. 우리 연구진이 코로나바이러스 핵심 효소 단백질(헬리케이스)의 복제과정이 급격히 촉진되어 전염되는 메커니즘을 밝혀내며 바이러스 백신 및 치료제 개발에 새로운 가능성을 제시했다.
우리 대학 생명과학과 이광록 교수 연구팀이 nsp13 단백질*은 두 가지 활성을 가지고 있어 시너지 효과를 내며, 이를 통해 SARS 코로나바이러스의 유전물질인 RNA 복제를 촉진한다는 기전을 규명했다고 17일 밝혔다.
*nsp13 단백질: SARS 코로나바이러스의 헬리케이스로, 바이러스가 증식하는 데 필수적인 유전자 복제와 전사 과정에 중요한 효소이다. 헬리케이스는 마치 지퍼를 열고 닫는 것처럼 DNA나 RNA의 꼬인 구조를 풀어주는데, 유전정보를 읽거나 복제할 때 유전물질을 먼저 풀려야 하므로 필수적이다. 쉽게 말해, 헬리케이스는 엉킨 실타래를 푸는 효소단백질이다.
여기 두 가지 활성에 해당되는 첫번째 헬리케이스 활성은 DNA 또는 RNA와 같은 이중 가닥 핵산을 단일 가닥으로 풀어주는 효소 기능이며, 복제나 전사 과정을 촉진시킨다. 두번째 RNA 샤페론 활성은 핵산 구조의 올바른 접힘(folding)과 풀림 기능을 돕는 단백질로, 잘못된 RNA를 교정하거나 안정성을 향상시켜 세포 내 RNA 대사과정을 돕는 역할을 한다.
코로나바이러스가 빠르게 전파하기 위해서는 바이러스의 유전물질을 빠르게 복제하고 구성성분인 단백질을 생산해서 이들을 조합하는 것이 필수적이다.
연구팀은 첫 번째 단계인 유전물질의 RNA 복제가 다른 바이러스에 비해 왜 빠르게 일어나는지 알려지지 않았으나, nsp13 단백질이 기존의 헬리케이스 활성과 이제까지 알려지지 않은 새로운 샤페론 활성으로 유전자 복제 과정을 빠르게 촉진한다는 것을 규명했다.
nsp13 단백질은 유전적으로 잘 보존되어 다양한 변이 코로나바이러스에 대응하는 백신이나 감염 치료의 중요 표적이지만, 정확한 작용 메커니즘에 대해서는 완전한 이해가 부족했다.
연구팀은 nsp13 헬리케이스가 ATP(아데노신 삼인산)*를 분해하여 나온 화학에너지를 이용하여 유전물질인 RNA의 꼬인 구조를 단일 가닥으로 풀어주고 부산물로 ADP(아데노신 이인산)*가 생성하게 된다. 이때 생성된 ADP가 nsp13와 재결합하게 되면 샤페론 기능을 활성화시켜 RNA 이차구조를 추가로 불안정화한다는 사실을 알아냈다.
*ATP(아데노신 삼인산)는 충전된 배터리처럼 에너지를 담고 있고 효소가 일을 할 때는 에너지를 공급해준다. ATP는 인산 3개를 가지고 있어 인산이 분해 될 때 에너지를 방출하고 인산 2개를 가진 ADP(아데노신 이인산)를 부산물로 생성한다.
결론적으로 헬리케이스 활성과 샤페론 활성이 시공간적으로 동시에 협력해 RNA 복제를 촉진하게 된다는 새로운 방식의 작용기전을 규명했다.
이광록 교수는 “이번 연구는 대표적 핵산-효소 단백질인 헬리케이스가 ADP를 통해 샤페론적 활성을 나타내는 새로운 발견이며, 이를 통해 헬리케이스의 기능 다양성에 대한 이해의 폭을 넓혀주고, SARS 코로나바이러스의 다양한 변이에 대응할 효과적 치료제 및 백신 개발의 실마리를 제공할 것으로 기대한다”라고 연구 결과의 의의를 밝혔다.
이 연구는 유정민 박사가 제 1저자로 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF: 16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 29일 게재됐다. (논문명 : A novel ADP-directed chaperone function facilitates the ATP-driven motor activity of SARS-CoV helicase) (doi: 10.1093/nar/gkaf034)
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구지원, 선도연구센터 지원사업, 글로벌 기초연구 지원사업과 합성생물학핵심기술개발사업의 지원을 받아 수행됐다.
2025.02.17
조회수 4732
-
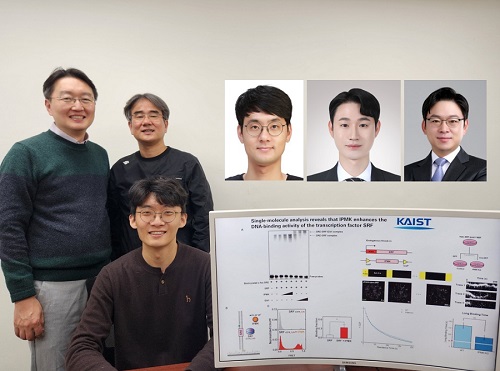 암 발생 현상 등 유전자 발현 조절 원리 규명
다양한 암 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포의 활성화 과정 등을 근본적으로 일으키는 유전자 발현 조절 단백질의 핵심 유전자 발현 네트워크를 발견했다. 우리 연구진은 이 발견을 기초로 하여 혁신적인 치료 기술 개발에 활용 가능성을 높였다.
우리 대학 생명과학과 김세윤 교수, 이광록 교수, 조원기 교수 공동연구팀이 동물 세포의 유전자 발현을 조절하는 핵심적인 원리를 규명했다고 22일 밝혔다.
이노시톨 대사 효소에 의해 만들어지는 이노시톨 인산 대사체는 진핵 세포의 신호전달 시스템에 필요한 다양한 이차 신호전달물질로 작용하며 암, 비만, 당뇨, 신경계 질환들에 폭넓게 관여한다.
연구팀은 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자로 작용함을 규명했다.
포도당과 유사한 영양소로 알려진 이노시톨의 대사 반응에 핵심적으로 작용하는 효소인 IPMK 단백질(inositol polyphosphate multikinase)은 유전자 발현을 직접적으로 조절하는 기능을 가지고 있다. 특히 IPMK 효소는 동물 세포의 대표적인 전사 인자(transcription factor)인 혈청 반응 인자(serum response factor, 이하 SRF)에 의한 유전자 전사 과정에 중요하다고 보고된 바 있으나 작용하는 기전에 대하여 알려진 바는 없었다.
SRF 전사 인자는 최소 200~300여 개의 유전자 발현을 직접적으로 조절하는 단백질로서, 동물 세포의 성장과 증식, 세포 사멸, 세포의 이동성 등을 조절하며 심장과 같은 장기 발생에 필수적이다.
연구팀은 IPMK 단백질이 SRF 전사 인자와 직접적으로 결합한다는 사실을 발견하고 이를 통해 SRF 전사 인자의 3차원적 단백질 구조를 변화시킨다는 것을 밝혔다.
연구팀은 IPMK 효소에 의하여 활성화된 SRF 전사 인자를 통해 다양한 유전자들의 전사 과정이 촉진된다는 것을 밝혔다. 즉, IPMK 단백질은 SRF 전사 인자의 단백질 활성을 높이는 데 반드시 필요한 조절 스위치와 같은 역할을 수행하는 것임을 연구팀은 규명했다.
연구팀은 IPMK 효소와 SRF 전사 인자 사이의 직접적인 결합에 문제가 발생할 경우, SRF 전사 인자의 기능과 활성이 낮아져 유전자 발현에 심각한 장애가 발생한다는 점을 최종적으로 검증하였다.
특히 SRF 전사 인자가 가지고 있는 비정형 영역(Intrinsically disordered region, IDR)이 중요한 조절 부위라는 점을 밝힘으로써 비정형 단백질의 생물학적 중요성을 제시했다. 보통 단백질은 접힘을 통해 고유의 구조를 나타내지만 비정형 영역을 포함하게 되는 경우에는 특정한 단백질 구조가 관찰되지 않는다. 학계에서는 이러한 비정형 영역을 가지고 있는 단백질들을 비정형 단백질이라고 구분하고 어떠한 기능을 수행하는지 주목하고 있다.
김세윤 교수는 “이번 연구는 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자이며 이를 증명하는 핵심 메커니즘을 제시한 중요한 발견”이라며, “SRF 전사 인자로부터 파생되는 다양한 암의 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포 활성화 과정 등을 근본적으로 이해함으로써 혁신적인 치료 기술 개발 등에 폭넓게 활용되기를 바란다”라는 기대를 전했다.
이 연구는 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF=16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 7일 게재됐다. (논문명 : Single-molecule analysis reveals that IPMK enhances the DNA-binding activity of the transcription factor SRF) (doi: 10.1093/nar/gkae1281)
한편 이번 연구는 한국연구재단의 중견연구사업, 선도연구센터 지원사업, 글로벌 기초연구실 지원사업과 서경배과학재단, 삼성미래기술육성사업의 지원을 받아 수행됐다.
암 발생 현상 등 유전자 발현 조절 원리 규명
다양한 암 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포의 활성화 과정 등을 근본적으로 일으키는 유전자 발현 조절 단백질의 핵심 유전자 발현 네트워크를 발견했다. 우리 연구진은 이 발견을 기초로 하여 혁신적인 치료 기술 개발에 활용 가능성을 높였다.
우리 대학 생명과학과 김세윤 교수, 이광록 교수, 조원기 교수 공동연구팀이 동물 세포의 유전자 발현을 조절하는 핵심적인 원리를 규명했다고 22일 밝혔다.
이노시톨 대사 효소에 의해 만들어지는 이노시톨 인산 대사체는 진핵 세포의 신호전달 시스템에 필요한 다양한 이차 신호전달물질로 작용하며 암, 비만, 당뇨, 신경계 질환들에 폭넓게 관여한다.
연구팀은 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자로 작용함을 규명했다.
포도당과 유사한 영양소로 알려진 이노시톨의 대사 반응에 핵심적으로 작용하는 효소인 IPMK 단백질(inositol polyphosphate multikinase)은 유전자 발현을 직접적으로 조절하는 기능을 가지고 있다. 특히 IPMK 효소는 동물 세포의 대표적인 전사 인자(transcription factor)인 혈청 반응 인자(serum response factor, 이하 SRF)에 의한 유전자 전사 과정에 중요하다고 보고된 바 있으나 작용하는 기전에 대하여 알려진 바는 없었다.
SRF 전사 인자는 최소 200~300여 개의 유전자 발현을 직접적으로 조절하는 단백질로서, 동물 세포의 성장과 증식, 세포 사멸, 세포의 이동성 등을 조절하며 심장과 같은 장기 발생에 필수적이다.
연구팀은 IPMK 단백질이 SRF 전사 인자와 직접적으로 결합한다는 사실을 발견하고 이를 통해 SRF 전사 인자의 3차원적 단백질 구조를 변화시킨다는 것을 밝혔다.
연구팀은 IPMK 효소에 의하여 활성화된 SRF 전사 인자를 통해 다양한 유전자들의 전사 과정이 촉진된다는 것을 밝혔다. 즉, IPMK 단백질은 SRF 전사 인자의 단백질 활성을 높이는 데 반드시 필요한 조절 스위치와 같은 역할을 수행하는 것임을 연구팀은 규명했다.
연구팀은 IPMK 효소와 SRF 전사 인자 사이의 직접적인 결합에 문제가 발생할 경우, SRF 전사 인자의 기능과 활성이 낮아져 유전자 발현에 심각한 장애가 발생한다는 점을 최종적으로 검증하였다.
특히 SRF 전사 인자가 가지고 있는 비정형 영역(Intrinsically disordered region, IDR)이 중요한 조절 부위라는 점을 밝힘으로써 비정형 단백질의 생물학적 중요성을 제시했다. 보통 단백질은 접힘을 통해 고유의 구조를 나타내지만 비정형 영역을 포함하게 되는 경우에는 특정한 단백질 구조가 관찰되지 않는다. 학계에서는 이러한 비정형 영역을 가지고 있는 단백질들을 비정형 단백질이라고 구분하고 어떠한 기능을 수행하는지 주목하고 있다.
김세윤 교수는 “이번 연구는 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자이며 이를 증명하는 핵심 메커니즘을 제시한 중요한 발견”이라며, “SRF 전사 인자로부터 파생되는 다양한 암의 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포 활성화 과정 등을 근본적으로 이해함으로써 혁신적인 치료 기술 개발 등에 폭넓게 활용되기를 바란다”라는 기대를 전했다.
이 연구는 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF=16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 7일 게재됐다. (논문명 : Single-molecule analysis reveals that IPMK enhances the DNA-binding activity of the transcription factor SRF) (doi: 10.1093/nar/gkae1281)
한편 이번 연구는 한국연구재단의 중견연구사업, 선도연구센터 지원사업, 글로벌 기초연구실 지원사업과 서경배과학재단, 삼성미래기술육성사업의 지원을 받아 수행됐다.
2025.01.22
조회수 5635
-
 스트레스 위험 혈관 변화 실시간으로 잡아낸다
심혈관 질환은 전 세계 사망 원인 1위로 매우 심각한 건강 문제다. 특히, 정신적 스트레스가 심혈관 질환을 더 악화시킨다는 것이 보고되어 왔다. 한국 연구진이 그동안 관찰하기 어려웠던 스트레스로 인한 혈관 변화를 실시간으로 알아내는 데 성공했다.
우리 대학 기계공학과 유홍기 교수 연구팀이 고려대학교 구로병원 심혈관센터 김진원 교수 연구팀과 협력해 심장 박동으로 인한 혈관의 움직임을 보상해 실시간으로 혈관 내 세포의 움직임을 관찰할 수 있는 새로운 생체 내 영상 획득 기술을 개발했다고 20일 밝혔다.
연구팀은 초점 가변 렌즈를 생체 내 광학 현미경에 도입해 동맥의 움직임을 추정했고, 이를 현미경의 초점 평면과 동기화하는 기법을 개발했다. 이 기술을 통해 동맥의 움직임으로 인한 이미지 간의 상관 계수(이미지들 간의 유사성을 나타내는 통계적 지표)를 4배 높일 수 있었고, 시간해상도(단위 시간당 촬영 가능한 이미지 수)를 57% 향상해 혈관 내 면역세포의 빠른 움직임을 실시간으로 관찰했다.
즉, 이 기술을 통해 동맥의 움직임으로 인한 영상 왜곡을 크게 줄이고 초점을 안정적으로 유지함으로써, 영상을 놓치지 않고 혈관 내에서 빠르게 움직이는 면역세포를 실시간으로 관찰하는 데 성공했다.
연구팀은 만성 스트레스에 노출된 실험군 쥐와 대조군 쥐의 경동맥에서 생체 내 영상 획득에 본 기술을 적용했고, 동맥경화 병변의 진행 정도를 세포 수준의 해상도에서 정량적으로 평가할 수 있었다.
만성 스트레스에 노출된 쥐의 경동맥에서 골수 세포의 침윤이 대조군 대비 6.09배 증가했으며, 추적 영상에서는 골수 세포가 2.45배 더 증가하는 것을 확인했다. 또한, 조직학적 분석을 통해 스트레스가 동맥경화반의 크기와 염증을 증가시키고, 섬유성 막을 얇게 만들어 경화반의 불안정성을 높인다는 것을 입증했다.
유홍기 교수는 “이번 연구를 통해 비접촉 방법으로 동맥의 움직임을 정확하게 추정할 수 있었고, 이 방법은 실험동물의 높은 생존율을 보장할 수 있어 만성 스트레스가 미치는 영향을 종단 연구로 입증할 수 있었다”라고 말했다.
이어 유 교수는 “이 기술은 우수한 시간 해상도를 제공해 스트레스가 심혈관 질환에 미치는 영향을 세포 수준에서 실시간으로 관찰할 수 있어 앞으로 스트레스 관련 심혈관 질환의 발병 기전을 규명하고 새로운 치료법을 개발하는 데 중요한 도구로 활용될 것으로 기대하고 있다”라고 강조했다.
기계공학과 장민석 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘동맥경화, 혈전, 혈관 생물학(Arteriosclerosis, Thrombosis, and Vascular Biology)’에 지난해 10월 10일 온라인판 게재됐고, 44권 12호에 표지논문과 에디터픽으로 선정됐다.
(논문명: Real-time imaging assessment of stress-induced vascular inflammation using heartbeat-synchronized motion compensation)
한편 이번 연구는 한국연구재단, 범부처전주기의료기기연구개발사업단의 지원을 받아 수행됐다.
스트레스 위험 혈관 변화 실시간으로 잡아낸다
심혈관 질환은 전 세계 사망 원인 1위로 매우 심각한 건강 문제다. 특히, 정신적 스트레스가 심혈관 질환을 더 악화시킨다는 것이 보고되어 왔다. 한국 연구진이 그동안 관찰하기 어려웠던 스트레스로 인한 혈관 변화를 실시간으로 알아내는 데 성공했다.
우리 대학 기계공학과 유홍기 교수 연구팀이 고려대학교 구로병원 심혈관센터 김진원 교수 연구팀과 협력해 심장 박동으로 인한 혈관의 움직임을 보상해 실시간으로 혈관 내 세포의 움직임을 관찰할 수 있는 새로운 생체 내 영상 획득 기술을 개발했다고 20일 밝혔다.
연구팀은 초점 가변 렌즈를 생체 내 광학 현미경에 도입해 동맥의 움직임을 추정했고, 이를 현미경의 초점 평면과 동기화하는 기법을 개발했다. 이 기술을 통해 동맥의 움직임으로 인한 이미지 간의 상관 계수(이미지들 간의 유사성을 나타내는 통계적 지표)를 4배 높일 수 있었고, 시간해상도(단위 시간당 촬영 가능한 이미지 수)를 57% 향상해 혈관 내 면역세포의 빠른 움직임을 실시간으로 관찰했다.
즉, 이 기술을 통해 동맥의 움직임으로 인한 영상 왜곡을 크게 줄이고 초점을 안정적으로 유지함으로써, 영상을 놓치지 않고 혈관 내에서 빠르게 움직이는 면역세포를 실시간으로 관찰하는 데 성공했다.
연구팀은 만성 스트레스에 노출된 실험군 쥐와 대조군 쥐의 경동맥에서 생체 내 영상 획득에 본 기술을 적용했고, 동맥경화 병변의 진행 정도를 세포 수준의 해상도에서 정량적으로 평가할 수 있었다.
만성 스트레스에 노출된 쥐의 경동맥에서 골수 세포의 침윤이 대조군 대비 6.09배 증가했으며, 추적 영상에서는 골수 세포가 2.45배 더 증가하는 것을 확인했다. 또한, 조직학적 분석을 통해 스트레스가 동맥경화반의 크기와 염증을 증가시키고, 섬유성 막을 얇게 만들어 경화반의 불안정성을 높인다는 것을 입증했다.
유홍기 교수는 “이번 연구를 통해 비접촉 방법으로 동맥의 움직임을 정확하게 추정할 수 있었고, 이 방법은 실험동물의 높은 생존율을 보장할 수 있어 만성 스트레스가 미치는 영향을 종단 연구로 입증할 수 있었다”라고 말했다.
이어 유 교수는 “이 기술은 우수한 시간 해상도를 제공해 스트레스가 심혈관 질환에 미치는 영향을 세포 수준에서 실시간으로 관찰할 수 있어 앞으로 스트레스 관련 심혈관 질환의 발병 기전을 규명하고 새로운 치료법을 개발하는 데 중요한 도구로 활용될 것으로 기대하고 있다”라고 강조했다.
기계공학과 장민석 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘동맥경화, 혈전, 혈관 생물학(Arteriosclerosis, Thrombosis, and Vascular Biology)’에 지난해 10월 10일 온라인판 게재됐고, 44권 12호에 표지논문과 에디터픽으로 선정됐다.
(논문명: Real-time imaging assessment of stress-induced vascular inflammation using heartbeat-synchronized motion compensation)
한편 이번 연구는 한국연구재단, 범부처전주기의료기기연구개발사업단의 지원을 받아 수행됐다.
2025.01.22
조회수 4012
-
 원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18
조회수 5295
-
 홀로토모그래피로 오가노이드 실시간 관찰 성공
인체 장기의 구조와 기능을 모사한 3차원 미니 장기인 오가노이드는 다양한 질병 연구와 신약 개발에 필수적인 역할을 하고 있다. 한국 연구진이 기존 이미징 기술의 한계를 극복하고 살아있는 오가노이드를 고해상도로 실시간 동적 변화를 관찰하는 데 성공했다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영) 유전체 교정 연구단(단장 구본경) 연구팀과 ㈜토모큐브의 협력으로, 홀로토모그래피 (holotomography) 기술을 활용해 살아있는 소장 오가노이드를 실시간으로 고해상도로 관찰할 수 있는 이미징 기술을 개발했다고 14일 밝혔다.
기존의 이미징 기법들은 살아있는 오가노이드를 장기간 고해상도로 관찰하는 데 한계가 있었고, 형광 염색 등의 추가적인 처리가 필요한 경우가 많았다.
연구팀은 이러한 문제를 해결하기 위해 형광 등 염색 없이도 고해상도의 이미지를 제공하고, 세포 손상 없이 오랜 시간 동안 실시간으로 동적 변화를 관찰할 수 있는 홀로토모그래피 기술을 도입했다.
연구진은 실험용 쥐(마우스) 소장 오가노이드를 이용해 이 기술을 검증했으며, 그 결과 홀로토모그래피를 통해 오가노이드 내부의 다양한 세포 구조를 세밀하게 관찰할 수 있었고, 오가노이드의 성장 과정과 세포 분열, 세포 사멸 등의 동적 변화를 실시간으로 포착할 수 있었다.
또한, 약물 처리에 따른 오가노이드의 반응을 정밀하게 분석해 세포 생존 여부를 확인할 수 있었다.
연구진은 이번 연구를 통해 오가노이드 연구의 새로운 지평을 열었으며, 이를 통해 신약 개발, 맞춤형 치료, 재생 의학 등 다양한 분야에서 오가노이드의 활용을 극대화할 수 있을 것이라고 기대하고 있다.
향후 연구는 오가노이드의 생체 내 환경을 더 정확히 재현하고, 더욱 정교한 3차원 이미징을 통해 세포 수준에서의 다양한 생명현상을 이해하는 데 큰 기여를 할 것으로 전망된다.
논문의 제1 저자인 이만재 박사(KAIST 의과학대학원 졸, 現 충남대병원)는 “이번 연구는 기존의 한계를 뛰어넘는 새로운 이미징 기술로, 향후 오가노이드를 활용한 질병 모델링, 환자 맞춤형 치료 및 신약 개발 연구에 크게 기여할 것”이라고 밝혔다.
이번 연구 결과는 2024년 10월 1일 국제 학술지 ‘Experimental & Molecular Medicine’에 온라인 게재됐으며, 해당 기술은 다양한 생명과학 분야에서의 적용 가능성을 인정받고 있다.
(논문명: Long-term three-dimensional high-resolution imaging of live unlabeled small intestinal organoids via low-coherence holotomography)
본 연구는 한국연구재단 리더연구사업, KAIST 연구소 및 기초과학연구원의 지원을 받아 수행됐다.
홀로토모그래피로 오가노이드 실시간 관찰 성공
인체 장기의 구조와 기능을 모사한 3차원 미니 장기인 오가노이드는 다양한 질병 연구와 신약 개발에 필수적인 역할을 하고 있다. 한국 연구진이 기존 이미징 기술의 한계를 극복하고 살아있는 오가노이드를 고해상도로 실시간 동적 변화를 관찰하는 데 성공했다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영) 유전체 교정 연구단(단장 구본경) 연구팀과 ㈜토모큐브의 협력으로, 홀로토모그래피 (holotomography) 기술을 활용해 살아있는 소장 오가노이드를 실시간으로 고해상도로 관찰할 수 있는 이미징 기술을 개발했다고 14일 밝혔다.
기존의 이미징 기법들은 살아있는 오가노이드를 장기간 고해상도로 관찰하는 데 한계가 있었고, 형광 염색 등의 추가적인 처리가 필요한 경우가 많았다.
연구팀은 이러한 문제를 해결하기 위해 형광 등 염색 없이도 고해상도의 이미지를 제공하고, 세포 손상 없이 오랜 시간 동안 실시간으로 동적 변화를 관찰할 수 있는 홀로토모그래피 기술을 도입했다.
연구진은 실험용 쥐(마우스) 소장 오가노이드를 이용해 이 기술을 검증했으며, 그 결과 홀로토모그래피를 통해 오가노이드 내부의 다양한 세포 구조를 세밀하게 관찰할 수 있었고, 오가노이드의 성장 과정과 세포 분열, 세포 사멸 등의 동적 변화를 실시간으로 포착할 수 있었다.
또한, 약물 처리에 따른 오가노이드의 반응을 정밀하게 분석해 세포 생존 여부를 확인할 수 있었다.
연구진은 이번 연구를 통해 오가노이드 연구의 새로운 지평을 열었으며, 이를 통해 신약 개발, 맞춤형 치료, 재생 의학 등 다양한 분야에서 오가노이드의 활용을 극대화할 수 있을 것이라고 기대하고 있다.
향후 연구는 오가노이드의 생체 내 환경을 더 정확히 재현하고, 더욱 정교한 3차원 이미징을 통해 세포 수준에서의 다양한 생명현상을 이해하는 데 큰 기여를 할 것으로 전망된다.
논문의 제1 저자인 이만재 박사(KAIST 의과학대학원 졸, 現 충남대병원)는 “이번 연구는 기존의 한계를 뛰어넘는 새로운 이미징 기술로, 향후 오가노이드를 활용한 질병 모델링, 환자 맞춤형 치료 및 신약 개발 연구에 크게 기여할 것”이라고 밝혔다.
이번 연구 결과는 2024년 10월 1일 국제 학술지 ‘Experimental & Molecular Medicine’에 온라인 게재됐으며, 해당 기술은 다양한 생명과학 분야에서의 적용 가능성을 인정받고 있다.
(논문명: Long-term three-dimensional high-resolution imaging of live unlabeled small intestinal organoids via low-coherence holotomography)
본 연구는 한국연구재단 리더연구사업, KAIST 연구소 및 기초과학연구원의 지원을 받아 수행됐다.
2024.10.14
조회수 5478
-
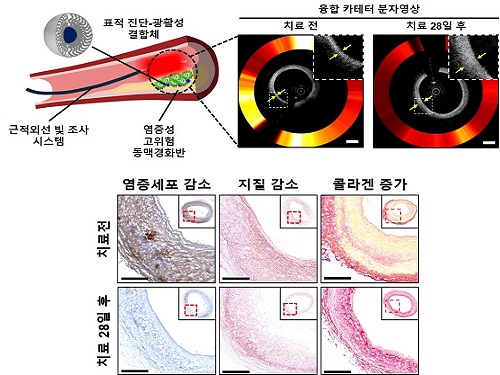 기계공학과 유홍기 교수 연구팀, 빛으로 동맥경화반 동시 진단 및 치료 기술 개발
관상동맥 내 고위험 동맥경화반은 파열과 협착을 유발하여 빠르게 혈관을 막을 수 있어 진단과 동시에 즉각적인 치료가 필요하다.
우리 대학 기계공학과 유홍기 교수 연구팀은 고려대학교구로병원 심혈관센터 김진원 교수팀, 중앙대학교 시스템생명공학과 박경순 교수팀과의 공동연구를 통해, 빛을 이용하여 동맥경화반 진단과 치료를 동시에 할 수 있는 새로운 원천 기술을 개발하였다.
이 기술은 유홍기 교수 연구팀이 개발한 광단층-분자영상 결합 카테터 기반 정밀 영상 시스템과 광치료 카테터를 이용해 빛을 조사하여 고위험 병변을 정확히 진단하고 치료하는 방법이다.
동맥경화반 내 대식세포의 특정 수용체를 표적하는 전달체와 광활성체를 결합한 테라노스틱 제제를 혈관에 투여한 후 혈관내 카테터를 이용해 위험 부위를 찾아내고 그 부위에 빛을 조사하였다. 그 결과, 고위험 동맥경화반을 실시간 정밀 영상으로 진단하였고 동시에 성공적으로 치료할 수 있었다.
치료 후 효과를 정밀 영상 시스템을 통해 생체 내에서 추적 검증했으며, 광활성에 의한 자가소화를 유도해 사멸 세포를 탐식 및 제거, 콜레스테롤 유출로 염증을 해소하고 콜라겐 조직 증가를 유도해 병변이 치료 및 안정화 됨을 밝혔다.
연구진은 “이번 연구를 통해 기존 방법의 한계였던 고위험 동맥경화반의 정밀 진단을 가능케 하였고, 동시에 광치료 시스템을 이용해 빛을 전달하여 고위험 동맥경화반을 치료하고 안정화하는 데 성공했다는 점에서 큰 의의가 있다.”라고 밝혔다. 또한 “기존 동맥경화반 치료법인 스텐트 치료가 가지는 이물질 잔존 위험을 극복할 수 있으며, 심혈관 진단 및 치료 분야에서 새로운 가능성을 제시했다.”고 했다. 연구진은 “이번 연구 결과를 바탕으로, 추후 임상 적용을 위한 시제품 개발을 적극적으로 추진할 계획”이라고 덧붙였다.
이번 연구 결과는 기계공학과 김연훈 박사과정생이 공동 제1저자로, 유홍기 교수가 공동교신저자로 참여하였으며, 국제학술지 Circulation Research (5-year IF: 20.3) 에 게재되었다.
한편 이번 연구는 한국연구재단이 주관하는 원천기술개발사업의 지원을 받아 수행됐다.
기계공학과 유홍기 교수 연구팀, 빛으로 동맥경화반 동시 진단 및 치료 기술 개발
관상동맥 내 고위험 동맥경화반은 파열과 협착을 유발하여 빠르게 혈관을 막을 수 있어 진단과 동시에 즉각적인 치료가 필요하다.
우리 대학 기계공학과 유홍기 교수 연구팀은 고려대학교구로병원 심혈관센터 김진원 교수팀, 중앙대학교 시스템생명공학과 박경순 교수팀과의 공동연구를 통해, 빛을 이용하여 동맥경화반 진단과 치료를 동시에 할 수 있는 새로운 원천 기술을 개발하였다.
이 기술은 유홍기 교수 연구팀이 개발한 광단층-분자영상 결합 카테터 기반 정밀 영상 시스템과 광치료 카테터를 이용해 빛을 조사하여 고위험 병변을 정확히 진단하고 치료하는 방법이다.
동맥경화반 내 대식세포의 특정 수용체를 표적하는 전달체와 광활성체를 결합한 테라노스틱 제제를 혈관에 투여한 후 혈관내 카테터를 이용해 위험 부위를 찾아내고 그 부위에 빛을 조사하였다. 그 결과, 고위험 동맥경화반을 실시간 정밀 영상으로 진단하였고 동시에 성공적으로 치료할 수 있었다.
치료 후 효과를 정밀 영상 시스템을 통해 생체 내에서 추적 검증했으며, 광활성에 의한 자가소화를 유도해 사멸 세포를 탐식 및 제거, 콜레스테롤 유출로 염증을 해소하고 콜라겐 조직 증가를 유도해 병변이 치료 및 안정화 됨을 밝혔다.
연구진은 “이번 연구를 통해 기존 방법의 한계였던 고위험 동맥경화반의 정밀 진단을 가능케 하였고, 동시에 광치료 시스템을 이용해 빛을 전달하여 고위험 동맥경화반을 치료하고 안정화하는 데 성공했다는 점에서 큰 의의가 있다.”라고 밝혔다. 또한 “기존 동맥경화반 치료법인 스텐트 치료가 가지는 이물질 잔존 위험을 극복할 수 있으며, 심혈관 진단 및 치료 분야에서 새로운 가능성을 제시했다.”고 했다. 연구진은 “이번 연구 결과를 바탕으로, 추후 임상 적용을 위한 시제품 개발을 적극적으로 추진할 계획”이라고 덧붙였다.
이번 연구 결과는 기계공학과 김연훈 박사과정생이 공동 제1저자로, 유홍기 교수가 공동교신저자로 참여하였으며, 국제학술지 Circulation Research (5-year IF: 20.3) 에 게재되었다.
한편 이번 연구는 한국연구재단이 주관하는 원천기술개발사업의 지원을 받아 수행됐다.
2024.08.23
조회수 5926
-
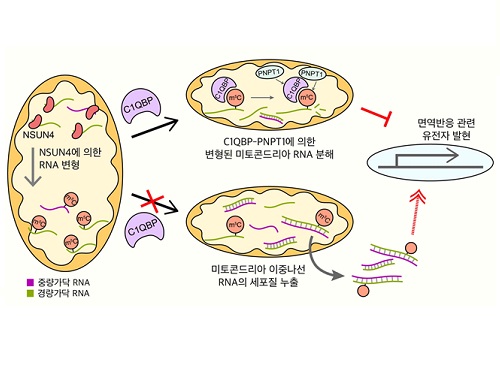 미토콘드리아로 퇴행성 질환까지 제어 가능하다
우리 대학 생명화학공학과 김유식 교수 연구팀이 비정상적 면역 활성을 유발해 염증반응이 동반된 세포 사멸을 일으키는 미토콘드리아 이중나선 RNA의 새로운 조절 기전을 찾아냈다고 22일 밝혔다.
최근 미토콘드리아 이중나선 RNA가 스트레스 환경에서 세포질로 빠져나가 비정상적 면역 활성 및 세포 사멸을 유발한다는 것이 밝혀졌다. 또한 이러한 미토콘드리아 이중나선 RNA로 촉발되는 면역 활성은 관절염 및 헌팅턴 무도병을 비롯한 염증반응이 동반된 퇴행성 질환과 자가면역질환 중 하나인 쇼그렌 증후군의 발병 및 진행에 핵심적인 역할을 한다는 것이 보고됐다.
아직 미토콘드리아 이중나선 RNA의 분자적 조절 기전에 대해서는 보고된 바 없다는 점을 착안해서 연구팀은 미토콘드리아 내에 존재하며 RNA와 결합할 수 있는 단백질에 대해 유전자 가위를 이용해 각 단백질의 발현을 억제한 후 미토콘드리아 이중나선 RNA의 발현량을 조사했다.
이 과정에서 RNA의 구성 물질 중 하나인 시토신의 화학적 변형을 유발하는 엔썬4(NSUN4)*이라는 단백질의 발현을 줄였을 때 미토콘드리아 이중나선 RNA의 발현이 유의미하게 증가하는 것을 확인했다.
*엔썬4 (NSUN4): NOP2/Sun RNA 메틸트랜스퍼라제 4
나아가, 연구팀은 단백질을 생산하지 않는 미토콘드리아 비암호화 RNA의 변형을 가속시키는 것이 동 단백질 엔썬4에 의해서라고 최초로 제시했다.
연구팀은 추가 연구를 통해 미토콘드리아 RNA 단백질들의 발현 감소로 축적된 미토콘드리아 이중나선 RNA의 양이 증가했으며 세포질로 누출된 미토콘드리아 이중나선 RNA는 면역반응을 활성화시켰다. 이를 통해 연구팀은 새로운 세포 내 면역 유발인자로 최근 주목받기 시작한 미토콘드리아 이중나선 RNA의 변형에 의한 발현 조절 기전을 제시했다.
생명화학공학과 김유식 교수는 “이번 연구를 통해 비정상적 면역 활성 유발 인자로 최근 주목받고 있는 미토콘드리아 이중나선 RNA의 형성 및 조절 기전을 밝혔다”면서 “이번 연구의 결과를 바탕으로 면역 계통 질환을 비롯해 다양한 퇴행성 질환의 발병 및 진행 과정을 효과적으로 제어할 수 있는 전략을 제시할 수 있을 것”이라고 말했다.
생명화학공학과 김수진 박사(現 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학(Harvard Medical School) 박사후연구원)와 탄 스테파니(Tan Stephanie) 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 7월 16일 字에 온라인 게재됐다. (논문명 : RNA 5-methylcytosine marks mitochondrial double-stranded RNAs for degradation and cytosolic release).
한편 이번 연구는 한국연구재단 우수신진연구지원사업과 미국 국립보건원의 지원으로 수행됐다.
미토콘드리아로 퇴행성 질환까지 제어 가능하다
우리 대학 생명화학공학과 김유식 교수 연구팀이 비정상적 면역 활성을 유발해 염증반응이 동반된 세포 사멸을 일으키는 미토콘드리아 이중나선 RNA의 새로운 조절 기전을 찾아냈다고 22일 밝혔다.
최근 미토콘드리아 이중나선 RNA가 스트레스 환경에서 세포질로 빠져나가 비정상적 면역 활성 및 세포 사멸을 유발한다는 것이 밝혀졌다. 또한 이러한 미토콘드리아 이중나선 RNA로 촉발되는 면역 활성은 관절염 및 헌팅턴 무도병을 비롯한 염증반응이 동반된 퇴행성 질환과 자가면역질환 중 하나인 쇼그렌 증후군의 발병 및 진행에 핵심적인 역할을 한다는 것이 보고됐다.
아직 미토콘드리아 이중나선 RNA의 분자적 조절 기전에 대해서는 보고된 바 없다는 점을 착안해서 연구팀은 미토콘드리아 내에 존재하며 RNA와 결합할 수 있는 단백질에 대해 유전자 가위를 이용해 각 단백질의 발현을 억제한 후 미토콘드리아 이중나선 RNA의 발현량을 조사했다.
이 과정에서 RNA의 구성 물질 중 하나인 시토신의 화학적 변형을 유발하는 엔썬4(NSUN4)*이라는 단백질의 발현을 줄였을 때 미토콘드리아 이중나선 RNA의 발현이 유의미하게 증가하는 것을 확인했다.
*엔썬4 (NSUN4): NOP2/Sun RNA 메틸트랜스퍼라제 4
나아가, 연구팀은 단백질을 생산하지 않는 미토콘드리아 비암호화 RNA의 변형을 가속시키는 것이 동 단백질 엔썬4에 의해서라고 최초로 제시했다.
연구팀은 추가 연구를 통해 미토콘드리아 RNA 단백질들의 발현 감소로 축적된 미토콘드리아 이중나선 RNA의 양이 증가했으며 세포질로 누출된 미토콘드리아 이중나선 RNA는 면역반응을 활성화시켰다. 이를 통해 연구팀은 새로운 세포 내 면역 유발인자로 최근 주목받기 시작한 미토콘드리아 이중나선 RNA의 변형에 의한 발현 조절 기전을 제시했다.
생명화학공학과 김유식 교수는 “이번 연구를 통해 비정상적 면역 활성 유발 인자로 최근 주목받고 있는 미토콘드리아 이중나선 RNA의 형성 및 조절 기전을 밝혔다”면서 “이번 연구의 결과를 바탕으로 면역 계통 질환을 비롯해 다양한 퇴행성 질환의 발병 및 진행 과정을 효과적으로 제어할 수 있는 전략을 제시할 수 있을 것”이라고 말했다.
생명화학공학과 김수진 박사(現 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학(Harvard Medical School) 박사후연구원)와 탄 스테파니(Tan Stephanie) 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 7월 16일 字에 온라인 게재됐다. (논문명 : RNA 5-methylcytosine marks mitochondrial double-stranded RNAs for degradation and cytosolic release).
한편 이번 연구는 한국연구재단 우수신진연구지원사업과 미국 국립보건원의 지원으로 수행됐다.
2024.07.22
조회수 6095
-
 바이러스와 세균의 진화를 규명하다
바이러스는 특정 세포 안에 침투했을 때만 증식의 생명력을 띠고 그 외에는 무생물 같으며, 사람 세포를 감염시키는 코로나19 바이러스, 세균을 잡아먹으며 증식하는 세균바이러스 등이 있다. 국내 연구진이 세균바이러스가 RNA 합성을 마무리 짓는 방식에 해체종결(1)만 있고 재생종결(2)은 없다는 사실을 밝히고 RNA 의약품 개발에 응용될 가능성을 높였다.
(1)해체종결: 합성 복합체가 중합효소, DNA, RNA로 해체
(2)재생종결: RNA만 분리되고 중합효소는 DNA에 남아 재생
우리 대학 생명과학과 강창원 명예교수(줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동연구팀이 세균의 리보핵산(RNA) 합성방식 두 가지 중 하나가 바이러스에는 없다는 것을 발견해, 세균이 바이러스로부터 진화하면서 획득한 방식을 처음 밝힌 연구 논문을 핵산 분야 최상급 국제학술지에 게재했다고 19일 밝혔다.
유전자 DNA의 유전정보에 따라 RNA를 합성하는 효소가 RNA 중합효소다. 이는 유전정보가 DNA에서 RNA로 옮겨 적히기에 전사(轉寫)라고 부르는 유전자 발현 첫 단계를 수행하며, RNA 백신 등 첨단 RNA 의약품을 개발 생산하는 데에 쓰인다. 연구팀은 세균바이러스의 RNA 중합효소를 연구해서 생물로 진화하기 이전 태초의 RNA 합성(전사) 방식을 밝힌 것이다.
유전자에 따라 다른 게 아니라 어느 유전자든 전사 마무리 방식에 두 가지가 있다는 것을 수년 전 세균에서 발견했었다. 그리고 세균보다 진화한 진핵생물 효모의 유전자 전사에서도 두 방식이 모두 쓰인다는 것이 지난달에 보고됐다. 사람도 진핵생물이어서, 세균과 효모뿐 아니라 사람까지 온갖 생물의 유전자 전사에 두 방식 모두 쓰일 개연성이 커졌다.
그런데 이번 연구에서 세균바이러스의 방식은 세균이나 효모와 사뭇 다르다는 것이 밝혀졌다. 바이러스의 경우 재생종결 없이 해체종결만 일어나는 것이다. 이를 토대로, 연구팀은 RNA 중합효소가 세균에서 바이러스와 달리 적응하면서 해체종결에 재생종결이 추가돼 두 방식이 공존하게 되었고, 최소한 효모로의 진화에서 그대로 보존됐다는 해석을 내놓았다.
이번 연구에서 거푸집 DNA와 전사물 RNA에 각기 다른 형광물질을 부착해 전사 복합체 하나하나의 형광을 실시간으로 측정하는 단일분자 형광기술 연구기법이 사용됐다. 전사 종결로 RNA가 방출될 때 DNA가 효소에 붙어있는지 떨어지는지를 낱낱이 구별할 수 있게 설계한 것이 특장점이다. 특히 형광물질이 전사 반응에 지장을 주지 않도록 하는 게 관건이었다.
송은호 박사후연구원과 한선 박사과정 대학원생이 공동 제1 저자로 참여한 논문(제목: Single-mode termination of phage transcriptions, disclosing bacterial adaptation for facilitated reinitiations)이 학술지 핵산연구(Nucleic Acids Research)에 7월 16일 게재됐다. 이로써 강창원 교수와 홍성철 교수는 2017년부터 총 8편의 논문을 공동으로 발표했다.
강창원 교수는 "이번 연구를 통해 수 초 동안의 분자 반응에서 유구한 진화과정을 밝혀냈고, 앞으로 더 광범위한 진화를 연구할 계획이다”라고 했다. 홍성철 교수는 "분자 하나하나를 관찰하여 복잡한 생물체의 진화를 파악했고, 이런 단일분자 연구기법을 차세대 RNA 의약품과 진단 시약의 개발에 응용하는 연구로 이어가고자 한다”라고 했다.
바이러스와 세균의 진화를 규명하다
바이러스는 특정 세포 안에 침투했을 때만 증식의 생명력을 띠고 그 외에는 무생물 같으며, 사람 세포를 감염시키는 코로나19 바이러스, 세균을 잡아먹으며 증식하는 세균바이러스 등이 있다. 국내 연구진이 세균바이러스가 RNA 합성을 마무리 짓는 방식에 해체종결(1)만 있고 재생종결(2)은 없다는 사실을 밝히고 RNA 의약품 개발에 응용될 가능성을 높였다.
(1)해체종결: 합성 복합체가 중합효소, DNA, RNA로 해체
(2)재생종결: RNA만 분리되고 중합효소는 DNA에 남아 재생
우리 대학 생명과학과 강창원 명예교수(줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동연구팀이 세균의 리보핵산(RNA) 합성방식 두 가지 중 하나가 바이러스에는 없다는 것을 발견해, 세균이 바이러스로부터 진화하면서 획득한 방식을 처음 밝힌 연구 논문을 핵산 분야 최상급 국제학술지에 게재했다고 19일 밝혔다.
유전자 DNA의 유전정보에 따라 RNA를 합성하는 효소가 RNA 중합효소다. 이는 유전정보가 DNA에서 RNA로 옮겨 적히기에 전사(轉寫)라고 부르는 유전자 발현 첫 단계를 수행하며, RNA 백신 등 첨단 RNA 의약품을 개발 생산하는 데에 쓰인다. 연구팀은 세균바이러스의 RNA 중합효소를 연구해서 생물로 진화하기 이전 태초의 RNA 합성(전사) 방식을 밝힌 것이다.
유전자에 따라 다른 게 아니라 어느 유전자든 전사 마무리 방식에 두 가지가 있다는 것을 수년 전 세균에서 발견했었다. 그리고 세균보다 진화한 진핵생물 효모의 유전자 전사에서도 두 방식이 모두 쓰인다는 것이 지난달에 보고됐다. 사람도 진핵생물이어서, 세균과 효모뿐 아니라 사람까지 온갖 생물의 유전자 전사에 두 방식 모두 쓰일 개연성이 커졌다.
그런데 이번 연구에서 세균바이러스의 방식은 세균이나 효모와 사뭇 다르다는 것이 밝혀졌다. 바이러스의 경우 재생종결 없이 해체종결만 일어나는 것이다. 이를 토대로, 연구팀은 RNA 중합효소가 세균에서 바이러스와 달리 적응하면서 해체종결에 재생종결이 추가돼 두 방식이 공존하게 되었고, 최소한 효모로의 진화에서 그대로 보존됐다는 해석을 내놓았다.
이번 연구에서 거푸집 DNA와 전사물 RNA에 각기 다른 형광물질을 부착해 전사 복합체 하나하나의 형광을 실시간으로 측정하는 단일분자 형광기술 연구기법이 사용됐다. 전사 종결로 RNA가 방출될 때 DNA가 효소에 붙어있는지 떨어지는지를 낱낱이 구별할 수 있게 설계한 것이 특장점이다. 특히 형광물질이 전사 반응에 지장을 주지 않도록 하는 게 관건이었다.
송은호 박사후연구원과 한선 박사과정 대학원생이 공동 제1 저자로 참여한 논문(제목: Single-mode termination of phage transcriptions, disclosing bacterial adaptation for facilitated reinitiations)이 학술지 핵산연구(Nucleic Acids Research)에 7월 16일 게재됐다. 이로써 강창원 교수와 홍성철 교수는 2017년부터 총 8편의 논문을 공동으로 발표했다.
강창원 교수는 "이번 연구를 통해 수 초 동안의 분자 반응에서 유구한 진화과정을 밝혀냈고, 앞으로 더 광범위한 진화를 연구할 계획이다”라고 했다. 홍성철 교수는 "분자 하나하나를 관찰하여 복잡한 생물체의 진화를 파악했고, 이런 단일분자 연구기법을 차세대 RNA 의약품과 진단 시약의 개발에 응용하는 연구로 이어가고자 한다”라고 했다.
2024.07.19
조회수 7357
 숨겨진 다자 간 관계를 추적·복원하는 AI '마리오' 개발
회의실에 여러 사람이 동시에 모여 회의하는 경우처럼, 다수의 객체가 동시에 상호작용하는 고차원 상호작용(higher-order interaction)은 다양한 분야에서 발생하며, 실세계의 복잡한 관계를 담고 있다. 하지만 기술적 제약으로 인해 많은 분야에서는 주로 개별 쌍 간의 저차원 정보만 수집돼, 전체 맥락이 손실되고 활용에 제약이 따랐다. KAIST 연구진이 이처럼 불완전한 정보만으로도 고차원 상호작용을 정밀하게 복원*하는 AI ‘마리오(MARIOH)’를 개발하며, 소셜 네트워크, 뇌과학, 생명과학 등 다양한 분야에서 혁신적 분석 가능성을 열었다.
*복원: 사라지거나 관측되지 않은 원래 구조를 추정/재구성하는 것
우리 대학 김재철AI대학원의 신기정 교수 연구팀이 저차원 상호작용 정보만으로 고차원 상호작용 구조를 높은 정확도로 복원할 수 있는 인공지능 기술인 ‘마리오(이하 MARIOH, Multiplicity-Aware Hypergraph Reconstruction)’를 개발했다고 5일 밝혔다.
고차원 상호작용 복원이 어려운 이유는 동일한 저차원 상호작용 구조로부터 파생될 수 있는 고차원 상호작용의 가능성이 무수히 많기 때문이다.
연구팀이 개발한 MARIOH의 핵심 아이디어는 저차원 상호작용의 다중도(multiplicity) 정보를 활용해, 해당 구조로부터 파생될 수 있는 고차원 상호작용의 후보 수를 획기적으로 줄이는 데 있다.
더불어, 효율적인 탐색 기법을 통해 유망한 상호작용 후보를 신속하게 식별하고, 다중도 기반의 심층 학습 기술을 활용해 각 후보가 실제 고차원 상호작용일 가능성을 정확하게 예측한다.
연구팀은 10개의 다양한 실세계 데이터 셋을 대상으로 한 실험 결과, MARIOH는 기존 기술 대비 최대 74% 높은 정확도로 고차원 상호작용을 복원하는 데 성공했다.
예를 들어, 논문 공저 관계 데이터(출처: DBLP)에서는 98% 이상의 복원 정확도를 달성해, 약 86% 수준에 머무는 기존 기술을 크게 앞질렀다. 또한, 복원된 고차원 구조를 활용할 경우, 예측, 분류 등 다양한 작업에서의 성능이 향상되는 것으로 나타났다.
신기정 교수는 “MARIOH는 단순화된 연결 정보 정보에만 의존하던 기존 접근에서 벗어나, 실제 세계의 복잡한 연결 관계를 정밀하게 활용할 가능성을 열어 준다”라며, “단체 대화나 협업 네트워크를 다루는 소셜 네트워크 분석, 단백질 복합체나 유전자 간 상호작용을 분석하는 생명과학, 다중 뇌 영역 간 동시 활동을 추적하는 뇌과학 등 다양한 분야에서 폭넓게 활용될 수 있을 것”이라고 밝혔다.
김재철AI대학원의 이규한 석박통합과정(現 GraphAI 소프트웨어 엔지니어)과 이건 석박사통합과정, 신기정 교수가 저자로 참여한 이번 연구는 지난 5월에 홍콩에서 열린 제41회 IEEE 국제 데이터공학 학회(IEEE International Conference on Data Engineering, IEEE ICDE)에서 발표됐다.
※논문명: MARIOH: Multiplicity-Aware Hypergraph Reconstruction
※DOI: https://doi.ieeecomputersociety.org/10.1109/ICDE65448.2025.00233
한편, 이번 연구는 정보통신기획평가원의 지원을 받은 ‘EntireDB2AI: 전체 관계형 데이터베이스를 종합적으로 활용하는 심층 표현 학습 및 예측 원천기술과 소프트웨어 개발’ 과제와 한국연구재단의 지원을 받은 ‘그래프 파운데이션 모델: 다양한 모달리티 및 도메인에 적용 가능한 그래프 기반 기계 학습’과제의 성과다.
2025.08.05 조회수 616
숨겨진 다자 간 관계를 추적·복원하는 AI '마리오' 개발
회의실에 여러 사람이 동시에 모여 회의하는 경우처럼, 다수의 객체가 동시에 상호작용하는 고차원 상호작용(higher-order interaction)은 다양한 분야에서 발생하며, 실세계의 복잡한 관계를 담고 있다. 하지만 기술적 제약으로 인해 많은 분야에서는 주로 개별 쌍 간의 저차원 정보만 수집돼, 전체 맥락이 손실되고 활용에 제약이 따랐다. KAIST 연구진이 이처럼 불완전한 정보만으로도 고차원 상호작용을 정밀하게 복원*하는 AI ‘마리오(MARIOH)’를 개발하며, 소셜 네트워크, 뇌과학, 생명과학 등 다양한 분야에서 혁신적 분석 가능성을 열었다.
*복원: 사라지거나 관측되지 않은 원래 구조를 추정/재구성하는 것
우리 대학 김재철AI대학원의 신기정 교수 연구팀이 저차원 상호작용 정보만으로 고차원 상호작용 구조를 높은 정확도로 복원할 수 있는 인공지능 기술인 ‘마리오(이하 MARIOH, Multiplicity-Aware Hypergraph Reconstruction)’를 개발했다고 5일 밝혔다.
고차원 상호작용 복원이 어려운 이유는 동일한 저차원 상호작용 구조로부터 파생될 수 있는 고차원 상호작용의 가능성이 무수히 많기 때문이다.
연구팀이 개발한 MARIOH의 핵심 아이디어는 저차원 상호작용의 다중도(multiplicity) 정보를 활용해, 해당 구조로부터 파생될 수 있는 고차원 상호작용의 후보 수를 획기적으로 줄이는 데 있다.
더불어, 효율적인 탐색 기법을 통해 유망한 상호작용 후보를 신속하게 식별하고, 다중도 기반의 심층 학습 기술을 활용해 각 후보가 실제 고차원 상호작용일 가능성을 정확하게 예측한다.
연구팀은 10개의 다양한 실세계 데이터 셋을 대상으로 한 실험 결과, MARIOH는 기존 기술 대비 최대 74% 높은 정확도로 고차원 상호작용을 복원하는 데 성공했다.
예를 들어, 논문 공저 관계 데이터(출처: DBLP)에서는 98% 이상의 복원 정확도를 달성해, 약 86% 수준에 머무는 기존 기술을 크게 앞질렀다. 또한, 복원된 고차원 구조를 활용할 경우, 예측, 분류 등 다양한 작업에서의 성능이 향상되는 것으로 나타났다.
신기정 교수는 “MARIOH는 단순화된 연결 정보 정보에만 의존하던 기존 접근에서 벗어나, 실제 세계의 복잡한 연결 관계를 정밀하게 활용할 가능성을 열어 준다”라며, “단체 대화나 협업 네트워크를 다루는 소셜 네트워크 분석, 단백질 복합체나 유전자 간 상호작용을 분석하는 생명과학, 다중 뇌 영역 간 동시 활동을 추적하는 뇌과학 등 다양한 분야에서 폭넓게 활용될 수 있을 것”이라고 밝혔다.
김재철AI대학원의 이규한 석박통합과정(現 GraphAI 소프트웨어 엔지니어)과 이건 석박사통합과정, 신기정 교수가 저자로 참여한 이번 연구는 지난 5월에 홍콩에서 열린 제41회 IEEE 국제 데이터공학 학회(IEEE International Conference on Data Engineering, IEEE ICDE)에서 발표됐다.
※논문명: MARIOH: Multiplicity-Aware Hypergraph Reconstruction
※DOI: https://doi.ieeecomputersociety.org/10.1109/ICDE65448.2025.00233
한편, 이번 연구는 정보통신기획평가원의 지원을 받은 ‘EntireDB2AI: 전체 관계형 데이터베이스를 종합적으로 활용하는 심층 표현 학습 및 예측 원천기술과 소프트웨어 개발’ 과제와 한국연구재단의 지원을 받은 ‘그래프 파운데이션 모델: 다양한 모달리티 및 도메인에 적용 가능한 그래프 기반 기계 학습’과제의 성과다.
2025.08.05 조회수 616 왜 식물이 스스로 공격하나? 유전 충돌 비밀 밝혀
고유의 면역 시스템을 지닌 식물은 때때로 자신의 단백질 구조를 병원균으로 오인해 스스로를 공격하는 ‘자가면역 반응’을 일으키기도 한다. 특히 서로 다른 품종 간 교배 후, 후손 식물이 건강하게 자라지 못하고 스스로 고사하는‘잡종 괴사(hybrid necrosis)’현상은 오랫동안 식물학자와 농업 연구자들에게 해결이 어려운 난제로 여겨져 왔다. 이에 KAIST를 포함한 국내외 연구진은 식물 자가면역 반응의 유발 메커니즘을 규명하고, 이를 사전에 예측·회피할 수 있는 신개념 품종 개량 전략을 제시하는 데 성공했다.
우리 대학 송지준 교수 연구팀이 국립싱가포르대학(NUS), 옥스퍼드대학 연구팀과 공동연구를 통해, 초저온 전자현미경(Cryo-EM) 기술을 활용, 식물 자가면역 반응을 유발하는 단백질 복합체‘DM3’의 구조와 기능을 규명했다고 21일 밝혔다.
이번 연구는 식물 잡종 간 교배 시 면역 수용체의 비정상적 반응으로 발생하는‘잡종 괴사(hybrid necrosis)’의 원인을 ‘단백질 구조의 결함’에서 찾았다는 점에서 주목을 받고 있다.
이 단백질(DM3)은 원래 식물의 면역 반응에 관여하는 효소인데, ‘위험 조합(DANGEROUS MIX, DM)’이라 불리는 특정 단백질 조합에서 DM3 단백질의 구조가 망가지면서 문제를 일으킨다.
특히, DM3의 변이체 중 하나는 ‘DM3Col-0’ 변이체는 6개의 단백질이 안정적으로 결합하며 정상으로 인식되어 면역 반응을 일으키지 않는다. 이에 반해 또 다른 ‘DM3Hh-0’변이체는 6개 단백질 간의 결합이 제대로 안되어 식물은 이를 ‘비정상적인 상태’로 인식하고 면역 경보를 울리며 자가 면역을 유발한다.
연구팀은 해당 구조를 원자 해상도의 초저온 전자현미경(Cryo-EM)을 통해 시각화했으며, 면역 유도 능력은 DM3 단백질의 효소 기능 때문이 아닌, ‘단백질 결합력의 차이’때문임을 밝혀냈다.
이는 식물이 ‘외부 병원균’뿐만 아니라‘내부 단백질 구조’가 비정상적으로 변화하는 경우에도 이를 병균으로 인식해 면역반응을 일으킬 수 있음을 보여준다.
해당 연구는 서로 다른 품종의 식물을 교배하면서 유전자가 섞이고 단백질 구조가 변할 경우, 식물 면역계가 얼마나 민감하게 변화하며 자가면역반응을 일으키는지 보여주며, 자연교배 및 품종개량 과정에서 발생할 수 있는 유전적 충돌(Genetic Incompatibility)에 대한 이해를 크게 높였다.
제1 저자인 김기정 박사는 “국제적 연구 협력을 통해 구조생화학, 유전학, 세포생물학적 실험을 망라해 완성도 높은 연구로 자가면역현상을 이용, 식물 면역계를 이해하는 새로운 관점을 제시했다”라고 말했다.
연구를 주도한 생명과학과 송지준 교수는 “면역 시스템이 외부 병원균뿐 아니라 자기 단백질의 구조적 이상까지 감지할 수 있다는 사실은 식물 생명공학 및 작물 교배 전략에 새로운 기준을 제시할 것”이라며, “초저온 전자현미경 기반의 구조 분석이 유전자 간 상호작용의 본질을 이해하는 데 중요한 도구가 될 것”이라고 말했다.
송지준 교수와 옥스퍼드대 최은영 교수가 공동 책임저자로, 생명과학과 김기정 박사(現 취리히 대학교 박사후 연구원)과 국립싱가폴 대학 웨이린 완(Wei-Lin Wan) 박사가 공동 제1 저자로, 김나윤 박사과정 학생이 제2 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’의 자매지인 `분자 세포(Molecular Cell)' 7월 17일 자에 출판됐다.
※논문명: Structural determinants of DANGEROUS MIX 3, an alpha/beta hydrolase that triggers NLR-mediated genetic incompatibility in plants
※DOI: https://doi.org/10.1016/j.molcel.2025.06.021
한편, 이번 연구는 KAIST 그랜드챌린지 30(Grand Challenge 30) 과제 지원을 받아 수행됐다.
2025.07.21 조회수 802
왜 식물이 스스로 공격하나? 유전 충돌 비밀 밝혀
고유의 면역 시스템을 지닌 식물은 때때로 자신의 단백질 구조를 병원균으로 오인해 스스로를 공격하는 ‘자가면역 반응’을 일으키기도 한다. 특히 서로 다른 품종 간 교배 후, 후손 식물이 건강하게 자라지 못하고 스스로 고사하는‘잡종 괴사(hybrid necrosis)’현상은 오랫동안 식물학자와 농업 연구자들에게 해결이 어려운 난제로 여겨져 왔다. 이에 KAIST를 포함한 국내외 연구진은 식물 자가면역 반응의 유발 메커니즘을 규명하고, 이를 사전에 예측·회피할 수 있는 신개념 품종 개량 전략을 제시하는 데 성공했다.
우리 대학 송지준 교수 연구팀이 국립싱가포르대학(NUS), 옥스퍼드대학 연구팀과 공동연구를 통해, 초저온 전자현미경(Cryo-EM) 기술을 활용, 식물 자가면역 반응을 유발하는 단백질 복합체‘DM3’의 구조와 기능을 규명했다고 21일 밝혔다.
이번 연구는 식물 잡종 간 교배 시 면역 수용체의 비정상적 반응으로 발생하는‘잡종 괴사(hybrid necrosis)’의 원인을 ‘단백질 구조의 결함’에서 찾았다는 점에서 주목을 받고 있다.
이 단백질(DM3)은 원래 식물의 면역 반응에 관여하는 효소인데, ‘위험 조합(DANGEROUS MIX, DM)’이라 불리는 특정 단백질 조합에서 DM3 단백질의 구조가 망가지면서 문제를 일으킨다.
특히, DM3의 변이체 중 하나는 ‘DM3Col-0’ 변이체는 6개의 단백질이 안정적으로 결합하며 정상으로 인식되어 면역 반응을 일으키지 않는다. 이에 반해 또 다른 ‘DM3Hh-0’변이체는 6개 단백질 간의 결합이 제대로 안되어 식물은 이를 ‘비정상적인 상태’로 인식하고 면역 경보를 울리며 자가 면역을 유발한다.
연구팀은 해당 구조를 원자 해상도의 초저온 전자현미경(Cryo-EM)을 통해 시각화했으며, 면역 유도 능력은 DM3 단백질의 효소 기능 때문이 아닌, ‘단백질 결합력의 차이’때문임을 밝혀냈다.
이는 식물이 ‘외부 병원균’뿐만 아니라‘내부 단백질 구조’가 비정상적으로 변화하는 경우에도 이를 병균으로 인식해 면역반응을 일으킬 수 있음을 보여준다.
해당 연구는 서로 다른 품종의 식물을 교배하면서 유전자가 섞이고 단백질 구조가 변할 경우, 식물 면역계가 얼마나 민감하게 변화하며 자가면역반응을 일으키는지 보여주며, 자연교배 및 품종개량 과정에서 발생할 수 있는 유전적 충돌(Genetic Incompatibility)에 대한 이해를 크게 높였다.
제1 저자인 김기정 박사는 “국제적 연구 협력을 통해 구조생화학, 유전학, 세포생물학적 실험을 망라해 완성도 높은 연구로 자가면역현상을 이용, 식물 면역계를 이해하는 새로운 관점을 제시했다”라고 말했다.
연구를 주도한 생명과학과 송지준 교수는 “면역 시스템이 외부 병원균뿐 아니라 자기 단백질의 구조적 이상까지 감지할 수 있다는 사실은 식물 생명공학 및 작물 교배 전략에 새로운 기준을 제시할 것”이라며, “초저온 전자현미경 기반의 구조 분석이 유전자 간 상호작용의 본질을 이해하는 데 중요한 도구가 될 것”이라고 말했다.
송지준 교수와 옥스퍼드대 최은영 교수가 공동 책임저자로, 생명과학과 김기정 박사(現 취리히 대학교 박사후 연구원)과 국립싱가폴 대학 웨이린 완(Wei-Lin Wan) 박사가 공동 제1 저자로, 김나윤 박사과정 학생이 제2 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’의 자매지인 `분자 세포(Molecular Cell)' 7월 17일 자에 출판됐다.
※논문명: Structural determinants of DANGEROUS MIX 3, an alpha/beta hydrolase that triggers NLR-mediated genetic incompatibility in plants
※DOI: https://doi.org/10.1016/j.molcel.2025.06.021
한편, 이번 연구는 KAIST 그랜드챌린지 30(Grand Challenge 30) 과제 지원을 받아 수행됐다.
2025.07.21 조회수 802 고온 실험 없이 AI로 '최적 합금' 예측 시대 연다
자동차와 기계 부품 등에 사용되는 강철 합금은 일반적으로 고온에서 녹이는(융해) 공정을 거쳐 제조된다. 이때 성분이 변하지 않고 그대로 녹는 현상을 ‘합치 융해(congruent melting)’라고 한다. 우리 연구진은 이처럼 고온 실험을 통해서만 가능했던 합금의 융해 특성을 인공지능(AI)으로 해결했다. 이번 연구는 고질적인 난제였던 합금이 녹을 때 서로 얼마나 잘 섞이는지를 미리 예측함으로써, 미래 합금 개발의 방향성을 제시한다는 점에서 주목받고 있다.
우리 대학 신소재공학과 홍승범 교수 연구팀이 미국 노스웨스턴대 크리스 울버튼(Chris Wolverton) 교수팀과 국제 공동연구를 통해, 밀도범함수이론(DFT)* 기반의 형성에너지(합금이 얼마나 안정적인지를 나타내는 값) 데이터를 활용해 합금이 녹을 때 성분이 유지되는지를 예측하는 고정확도 머신러닝 모델을 개발했다고 14일 밝혔다.
*밀도범함수이론(Density Functional Theory, DFT): 전자 밀도(electron density)를 기반으로 시스템의 전체 에너지를 계산하는 방법
연구팀은 밀도범함수이론을 통해 계산한 형성에너지와, 기존의 실험적 융해 반응 데이터를 머신러닝에 결합해 4,536개의 이원계 화합물에 대한 융해 반응 유형을 학습한 후, 그 예측 모델을 구성했다.
다양한 머신러닝 알고리즘 중 특히 ‘XGBoost’ 기반 분류 모델이 합금이 잘 섞이는지 여부에 대해 가장 높은 정확도를 보였으며, 약 82.5%의 예측 정확도를 달성했다.
연구팀은 또한 샤플리(Shapley) 기법*을 활용해 모델의 주요 특징(feature)들을 분석했으며, 이 중에서도 기울기 변화가 크다는 것은 그 조성에서 에너지적으로 매우 유리한(=안정한) 상태가 형성된다는 뜻으로 ‘형성에너지 곡선의 기울기 변화(convex hull sharpness)’가 가장 중요한 인자로 도출됐다.
*샤플리기법: AI가 어떤 이유로 그렇게 판단했는지를 알려주는 설명 도구
이번 연구의 가장 큰 의의는 고온 실험 없이도 소재의 융해 반응 경향성을 예측할 수 있다는 점이다. 이는 특히 고엔트로피 합금이나 초내열 합금 등 실험이 어려운 소재 군에서 매우 유용하며, 향후 복잡한 다성분계 합금 설계에도 확장될 수 있다.
또한, AI 모델이 도출한 주요 물리량은 합금이 잘 변하고, 안정적인지 등에 대한 실제 실험 결과와 높은 일치도를 보였고, 향후 다양한 금속재료 개발 및 구조 안정성 예측 등 널리 활용될 수 있을 것으로 기대된다.
홍승범 교수는 “이번 연구는 계산과 실험 데이터, 그리고 머신러닝의 융합을 통해 기존의 경험적 합금 설계 방식에서 벗어나 데이터 기반의 예측적 소재 개발이 가능하다는 가능성을 보여준 사례”라며 “향후 생성형 모델, 강화학습 등의 최신 AI 기술을 접목하면 완전히 새로운 합금을 자동으로 설계하는 시대가 열릴 것”이라고 말했다.
신소재공학과 최영우 박사과정 연구원이 제1 저자로 참여한 이번 연구는 미국물리협회(American Institute of Physics, AIP)에서 발간하는 머신러닝 분야의 권위 있는 학술지인 ‘APL 머신러닝(Machine Learning)’ 5월호에 게재 및 ‘특집 논문(Featured article)’로 선정됐다.
※ 논문 제목: Machine learning-based melting congruency prediction of binary compounds using density functional theory-calculated formation energy
※ DOI: https://doi.org/10.1063/5.0247514
한편, 이번 연구는 과학기술정보통신부와 한국연구재단의 지원으로 수행됐다.
2025.07.14 조회수 985
고온 실험 없이 AI로 '최적 합금' 예측 시대 연다
자동차와 기계 부품 등에 사용되는 강철 합금은 일반적으로 고온에서 녹이는(융해) 공정을 거쳐 제조된다. 이때 성분이 변하지 않고 그대로 녹는 현상을 ‘합치 융해(congruent melting)’라고 한다. 우리 연구진은 이처럼 고온 실험을 통해서만 가능했던 합금의 융해 특성을 인공지능(AI)으로 해결했다. 이번 연구는 고질적인 난제였던 합금이 녹을 때 서로 얼마나 잘 섞이는지를 미리 예측함으로써, 미래 합금 개발의 방향성을 제시한다는 점에서 주목받고 있다.
우리 대학 신소재공학과 홍승범 교수 연구팀이 미국 노스웨스턴대 크리스 울버튼(Chris Wolverton) 교수팀과 국제 공동연구를 통해, 밀도범함수이론(DFT)* 기반의 형성에너지(합금이 얼마나 안정적인지를 나타내는 값) 데이터를 활용해 합금이 녹을 때 성분이 유지되는지를 예측하는 고정확도 머신러닝 모델을 개발했다고 14일 밝혔다.
*밀도범함수이론(Density Functional Theory, DFT): 전자 밀도(electron density)를 기반으로 시스템의 전체 에너지를 계산하는 방법
연구팀은 밀도범함수이론을 통해 계산한 형성에너지와, 기존의 실험적 융해 반응 데이터를 머신러닝에 결합해 4,536개의 이원계 화합물에 대한 융해 반응 유형을 학습한 후, 그 예측 모델을 구성했다.
다양한 머신러닝 알고리즘 중 특히 ‘XGBoost’ 기반 분류 모델이 합금이 잘 섞이는지 여부에 대해 가장 높은 정확도를 보였으며, 약 82.5%의 예측 정확도를 달성했다.
연구팀은 또한 샤플리(Shapley) 기법*을 활용해 모델의 주요 특징(feature)들을 분석했으며, 이 중에서도 기울기 변화가 크다는 것은 그 조성에서 에너지적으로 매우 유리한(=안정한) 상태가 형성된다는 뜻으로 ‘형성에너지 곡선의 기울기 변화(convex hull sharpness)’가 가장 중요한 인자로 도출됐다.
*샤플리기법: AI가 어떤 이유로 그렇게 판단했는지를 알려주는 설명 도구
이번 연구의 가장 큰 의의는 고온 실험 없이도 소재의 융해 반응 경향성을 예측할 수 있다는 점이다. 이는 특히 고엔트로피 합금이나 초내열 합금 등 실험이 어려운 소재 군에서 매우 유용하며, 향후 복잡한 다성분계 합금 설계에도 확장될 수 있다.
또한, AI 모델이 도출한 주요 물리량은 합금이 잘 변하고, 안정적인지 등에 대한 실제 실험 결과와 높은 일치도를 보였고, 향후 다양한 금속재료 개발 및 구조 안정성 예측 등 널리 활용될 수 있을 것으로 기대된다.
홍승범 교수는 “이번 연구는 계산과 실험 데이터, 그리고 머신러닝의 융합을 통해 기존의 경험적 합금 설계 방식에서 벗어나 데이터 기반의 예측적 소재 개발이 가능하다는 가능성을 보여준 사례”라며 “향후 생성형 모델, 강화학습 등의 최신 AI 기술을 접목하면 완전히 새로운 합금을 자동으로 설계하는 시대가 열릴 것”이라고 말했다.
신소재공학과 최영우 박사과정 연구원이 제1 저자로 참여한 이번 연구는 미국물리협회(American Institute of Physics, AIP)에서 발간하는 머신러닝 분야의 권위 있는 학술지인 ‘APL 머신러닝(Machine Learning)’ 5월호에 게재 및 ‘특집 논문(Featured article)’로 선정됐다.
※ 논문 제목: Machine learning-based melting congruency prediction of binary compounds using density functional theory-calculated formation energy
※ DOI: https://doi.org/10.1063/5.0247514
한편, 이번 연구는 과학기술정보통신부와 한국연구재단의 지원으로 수행됐다.
2025.07.14 조회수 985 AI로 방사성 오염 '아이오딘' 제거용 최적 신소재 발굴
원자력 에너지 활용에 있어 방사성 폐기물 관리는 핵심적인 과제 중 하나다. 특히 방사성 ‘아이오딘(요오드)’는 반감기가 길고(I-129의 경우 1,570만 년), 이동성 및 생체 유독성이 높아 환경 및 인체에 심각한 위험을 초래할 수 있다. 한국 연구진이 인공지능을 활용해 아이오딘을 제거할 원자력 환경 정화용 신소재 발굴에 성공했다. 연구팀은 향후 방사성 오염 흡착용 분말부터 오염수 처리 필터까지 다양한 산학협력을 통해 상용화를 추진할 예정이다.
우리 대학 원자력및양자공학과 류호진 교수 연구팀이 한국화학연구원 디지털화학연구센터 노주환 박사가 협력하여, 인공지능을 활용해 방사성 오염 물질이 될 수 있는 아이오딘을 효과적으로 제거하는 신소재를 발굴하는 기술을 개발했다고 2일 밝혔다.
최근 보고에 따르면 방사능 오염 물질인 아이오딘이 수용액 환경에서 아이오딘산염(IO3-) 형태로 존재하는 것으로 밝혀졌으나, 기존의 은 기반 흡착제는 이에 대해 낮은 화학적 흡착력을 가져 비효율적이었다. 따라서 아이오딘산염을 효과적으로 제거할 수 있는 새로운 흡착제 신소재 개발이 시급한 실정이다.
류호진 교수 연구팀은 기계학습을 활용한 실험 전략을 통해 다양한 금속원소를 함유한 ‘이중층 수산화물(Layered Double Hydroxide, 이하 LDH)’이라는 화합물 중 최적의 아이오딘산염 흡착제를 발굴했다.
이번 연구에서 개발된 구리-크롬-철-알루미늄 기반의 다중금속 이중층 수산화물 Cu3(CrFeAl)은 아이오딘산염에 대해 90% 이상의 뛰어난 흡착 성능을 보였다. 이는 기존의 시행착오 실험 방식으로는 탐색이 어려운 방대한 물질 조성 공간을 인공지능 기반의 능동학습법을 통해 효율적으로 탐색해 얻어낸 성과다.
연구팀은 이중층 수산화물(이하 LDH)이 고엔트로피 재료와 같이 다양한 금속 조성을 가질 수 있고 음이온 흡착에 유리한 구조를 지녔다는 점에 주목했다. 그러나 다중금속 LDH의 경우 가능한 금속 조합이 너무 많아 기존의 실험 방식으로는 최적의 조합을 찾기 어려웠다.
이를 해결하기 위해 연구팀은 인공지능(기계학습)을 도입했다. 초기 24개의 2원계 및 96개의 3원계 LDH 실험 데이터로 학습을 시작해, 4원계 및 5원계 후보 물질로 탐색을 확장했다. 이 결과 전체 후보 물질 중 단 16%에 대해서만 실험을 수행하고도 아이오딘산염 제거에 최적인 신소재 물질을 찾아낼 수 있었다.
류호진 교수는 “인공지능을 활용하면 방대한 신소재 후보 물질 군에서 방사성 오염 제거용 물질을 효율적으로 찾아낼 가능성을 보여, 원자력 환경 정화용 신소재 개발에 필요한 연구를 가속화하는데 기여할 것으로 기대된다”고 말했다.
류 교수 연구팀은 개발된 분말 기술에 대한 국내 특허를 출원했으며 이를 기반으로 해외 특허 출원을 진행 중이다. 연구팀은 향후 방사성 오염 흡착용 분말의 다양한 사용 환경에서의 성능을 고도화하고, 오염수 처리 필터 개발 분야에서 산학 협력을 통한 상용화 방안을 추진할 예정이다.
우리 대학 신소재공학과를 졸업한 이수정 박사와 한국화학연구원 디지털화학연구센터 노주환 박사가 제1 저자로 참여한 이번 연구는 이번 연구 결과는 환경 분야 국제 저명 학술지인 ‘위험물질 저널(Journal of Hazardous Materials)'에 5월 26일 온라인 게재됐다.
※논문명: Discovery of multi-metal-layered double hydroxides for decontamination of iodate by machine learning-assisted experiments
※DOI: https://doi.org/10.1016/j.jhazmat.2025.138735
이번 연구는 과학기술정보통신부 한국연구재단의 원자력기초연구지원사업과 나노·소재기술개발사업의 지원으로 수행됐다.
2025.07.02 조회수 1531
AI로 방사성 오염 '아이오딘' 제거용 최적 신소재 발굴
원자력 에너지 활용에 있어 방사성 폐기물 관리는 핵심적인 과제 중 하나다. 특히 방사성 ‘아이오딘(요오드)’는 반감기가 길고(I-129의 경우 1,570만 년), 이동성 및 생체 유독성이 높아 환경 및 인체에 심각한 위험을 초래할 수 있다. 한국 연구진이 인공지능을 활용해 아이오딘을 제거할 원자력 환경 정화용 신소재 발굴에 성공했다. 연구팀은 향후 방사성 오염 흡착용 분말부터 오염수 처리 필터까지 다양한 산학협력을 통해 상용화를 추진할 예정이다.
우리 대학 원자력및양자공학과 류호진 교수 연구팀이 한국화학연구원 디지털화학연구센터 노주환 박사가 협력하여, 인공지능을 활용해 방사성 오염 물질이 될 수 있는 아이오딘을 효과적으로 제거하는 신소재를 발굴하는 기술을 개발했다고 2일 밝혔다.
최근 보고에 따르면 방사능 오염 물질인 아이오딘이 수용액 환경에서 아이오딘산염(IO3-) 형태로 존재하는 것으로 밝혀졌으나, 기존의 은 기반 흡착제는 이에 대해 낮은 화학적 흡착력을 가져 비효율적이었다. 따라서 아이오딘산염을 효과적으로 제거할 수 있는 새로운 흡착제 신소재 개발이 시급한 실정이다.
류호진 교수 연구팀은 기계학습을 활용한 실험 전략을 통해 다양한 금속원소를 함유한 ‘이중층 수산화물(Layered Double Hydroxide, 이하 LDH)’이라는 화합물 중 최적의 아이오딘산염 흡착제를 발굴했다.
이번 연구에서 개발된 구리-크롬-철-알루미늄 기반의 다중금속 이중층 수산화물 Cu3(CrFeAl)은 아이오딘산염에 대해 90% 이상의 뛰어난 흡착 성능을 보였다. 이는 기존의 시행착오 실험 방식으로는 탐색이 어려운 방대한 물질 조성 공간을 인공지능 기반의 능동학습법을 통해 효율적으로 탐색해 얻어낸 성과다.
연구팀은 이중층 수산화물(이하 LDH)이 고엔트로피 재료와 같이 다양한 금속 조성을 가질 수 있고 음이온 흡착에 유리한 구조를 지녔다는 점에 주목했다. 그러나 다중금속 LDH의 경우 가능한 금속 조합이 너무 많아 기존의 실험 방식으로는 최적의 조합을 찾기 어려웠다.
이를 해결하기 위해 연구팀은 인공지능(기계학습)을 도입했다. 초기 24개의 2원계 및 96개의 3원계 LDH 실험 데이터로 학습을 시작해, 4원계 및 5원계 후보 물질로 탐색을 확장했다. 이 결과 전체 후보 물질 중 단 16%에 대해서만 실험을 수행하고도 아이오딘산염 제거에 최적인 신소재 물질을 찾아낼 수 있었다.
류호진 교수는 “인공지능을 활용하면 방대한 신소재 후보 물질 군에서 방사성 오염 제거용 물질을 효율적으로 찾아낼 가능성을 보여, 원자력 환경 정화용 신소재 개발에 필요한 연구를 가속화하는데 기여할 것으로 기대된다”고 말했다.
류 교수 연구팀은 개발된 분말 기술에 대한 국내 특허를 출원했으며 이를 기반으로 해외 특허 출원을 진행 중이다. 연구팀은 향후 방사성 오염 흡착용 분말의 다양한 사용 환경에서의 성능을 고도화하고, 오염수 처리 필터 개발 분야에서 산학 협력을 통한 상용화 방안을 추진할 예정이다.
우리 대학 신소재공학과를 졸업한 이수정 박사와 한국화학연구원 디지털화학연구센터 노주환 박사가 제1 저자로 참여한 이번 연구는 이번 연구 결과는 환경 분야 국제 저명 학술지인 ‘위험물질 저널(Journal of Hazardous Materials)'에 5월 26일 온라인 게재됐다.
※논문명: Discovery of multi-metal-layered double hydroxides for decontamination of iodate by machine learning-assisted experiments
※DOI: https://doi.org/10.1016/j.jhazmat.2025.138735
이번 연구는 과학기술정보통신부 한국연구재단의 원자력기초연구지원사업과 나노·소재기술개발사업의 지원으로 수행됐다.
2025.07.02 조회수 1531 코로나바이러스 전염 메커니즘 규명
중증급성호흡기증후군(이하 SARS) 코로나바이러스와 같은 코로나 19(COVID-19)는 전 세계적 팬데믹으로 짧은 시간 안에 확산되었지만 왜 급격히 복제돼 빠르게 전염되는지 기전이 아직까지 규명되지 않았다. 우리 연구진이 코로나바이러스 핵심 효소 단백질(헬리케이스)의 복제과정이 급격히 촉진되어 전염되는 메커니즘을 밝혀내며 바이러스 백신 및 치료제 개발에 새로운 가능성을 제시했다.
우리 대학 생명과학과 이광록 교수 연구팀이 nsp13 단백질*은 두 가지 활성을 가지고 있어 시너지 효과를 내며, 이를 통해 SARS 코로나바이러스의 유전물질인 RNA 복제를 촉진한다는 기전을 규명했다고 17일 밝혔다.
*nsp13 단백질: SARS 코로나바이러스의 헬리케이스로, 바이러스가 증식하는 데 필수적인 유전자 복제와 전사 과정에 중요한 효소이다. 헬리케이스는 마치 지퍼를 열고 닫는 것처럼 DNA나 RNA의 꼬인 구조를 풀어주는데, 유전정보를 읽거나 복제할 때 유전물질을 먼저 풀려야 하므로 필수적이다. 쉽게 말해, 헬리케이스는 엉킨 실타래를 푸는 효소단백질이다.
여기 두 가지 활성에 해당되는 첫번째 헬리케이스 활성은 DNA 또는 RNA와 같은 이중 가닥 핵산을 단일 가닥으로 풀어주는 효소 기능이며, 복제나 전사 과정을 촉진시킨다. 두번째 RNA 샤페론 활성은 핵산 구조의 올바른 접힘(folding)과 풀림 기능을 돕는 단백질로, 잘못된 RNA를 교정하거나 안정성을 향상시켜 세포 내 RNA 대사과정을 돕는 역할을 한다.
코로나바이러스가 빠르게 전파하기 위해서는 바이러스의 유전물질을 빠르게 복제하고 구성성분인 단백질을 생산해서 이들을 조합하는 것이 필수적이다.
연구팀은 첫 번째 단계인 유전물질의 RNA 복제가 다른 바이러스에 비해 왜 빠르게 일어나는지 알려지지 않았으나, nsp13 단백질이 기존의 헬리케이스 활성과 이제까지 알려지지 않은 새로운 샤페론 활성으로 유전자 복제 과정을 빠르게 촉진한다는 것을 규명했다.
nsp13 단백질은 유전적으로 잘 보존되어 다양한 변이 코로나바이러스에 대응하는 백신이나 감염 치료의 중요 표적이지만, 정확한 작용 메커니즘에 대해서는 완전한 이해가 부족했다.
연구팀은 nsp13 헬리케이스가 ATP(아데노신 삼인산)*를 분해하여 나온 화학에너지를 이용하여 유전물질인 RNA의 꼬인 구조를 단일 가닥으로 풀어주고 부산물로 ADP(아데노신 이인산)*가 생성하게 된다. 이때 생성된 ADP가 nsp13와 재결합하게 되면 샤페론 기능을 활성화시켜 RNA 이차구조를 추가로 불안정화한다는 사실을 알아냈다.
*ATP(아데노신 삼인산)는 충전된 배터리처럼 에너지를 담고 있고 효소가 일을 할 때는 에너지를 공급해준다. ATP는 인산 3개를 가지고 있어 인산이 분해 될 때 에너지를 방출하고 인산 2개를 가진 ADP(아데노신 이인산)를 부산물로 생성한다.
결론적으로 헬리케이스 활성과 샤페론 활성이 시공간적으로 동시에 협력해 RNA 복제를 촉진하게 된다는 새로운 방식의 작용기전을 규명했다.
이광록 교수는 “이번 연구는 대표적 핵산-효소 단백질인 헬리케이스가 ADP를 통해 샤페론적 활성을 나타내는 새로운 발견이며, 이를 통해 헬리케이스의 기능 다양성에 대한 이해의 폭을 넓혀주고, SARS 코로나바이러스의 다양한 변이에 대응할 효과적 치료제 및 백신 개발의 실마리를 제공할 것으로 기대한다”라고 연구 결과의 의의를 밝혔다.
이 연구는 유정민 박사가 제 1저자로 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF: 16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 29일 게재됐다. (논문명 : A novel ADP-directed chaperone function facilitates the ATP-driven motor activity of SARS-CoV helicase) (doi: 10.1093/nar/gkaf034)
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구지원, 선도연구센터 지원사업, 글로벌 기초연구 지원사업과 합성생물학핵심기술개발사업의 지원을 받아 수행됐다.
2025.02.17 조회수 4732
코로나바이러스 전염 메커니즘 규명
중증급성호흡기증후군(이하 SARS) 코로나바이러스와 같은 코로나 19(COVID-19)는 전 세계적 팬데믹으로 짧은 시간 안에 확산되었지만 왜 급격히 복제돼 빠르게 전염되는지 기전이 아직까지 규명되지 않았다. 우리 연구진이 코로나바이러스 핵심 효소 단백질(헬리케이스)의 복제과정이 급격히 촉진되어 전염되는 메커니즘을 밝혀내며 바이러스 백신 및 치료제 개발에 새로운 가능성을 제시했다.
우리 대학 생명과학과 이광록 교수 연구팀이 nsp13 단백질*은 두 가지 활성을 가지고 있어 시너지 효과를 내며, 이를 통해 SARS 코로나바이러스의 유전물질인 RNA 복제를 촉진한다는 기전을 규명했다고 17일 밝혔다.
*nsp13 단백질: SARS 코로나바이러스의 헬리케이스로, 바이러스가 증식하는 데 필수적인 유전자 복제와 전사 과정에 중요한 효소이다. 헬리케이스는 마치 지퍼를 열고 닫는 것처럼 DNA나 RNA의 꼬인 구조를 풀어주는데, 유전정보를 읽거나 복제할 때 유전물질을 먼저 풀려야 하므로 필수적이다. 쉽게 말해, 헬리케이스는 엉킨 실타래를 푸는 효소단백질이다.
여기 두 가지 활성에 해당되는 첫번째 헬리케이스 활성은 DNA 또는 RNA와 같은 이중 가닥 핵산을 단일 가닥으로 풀어주는 효소 기능이며, 복제나 전사 과정을 촉진시킨다. 두번째 RNA 샤페론 활성은 핵산 구조의 올바른 접힘(folding)과 풀림 기능을 돕는 단백질로, 잘못된 RNA를 교정하거나 안정성을 향상시켜 세포 내 RNA 대사과정을 돕는 역할을 한다.
코로나바이러스가 빠르게 전파하기 위해서는 바이러스의 유전물질을 빠르게 복제하고 구성성분인 단백질을 생산해서 이들을 조합하는 것이 필수적이다.
연구팀은 첫 번째 단계인 유전물질의 RNA 복제가 다른 바이러스에 비해 왜 빠르게 일어나는지 알려지지 않았으나, nsp13 단백질이 기존의 헬리케이스 활성과 이제까지 알려지지 않은 새로운 샤페론 활성으로 유전자 복제 과정을 빠르게 촉진한다는 것을 규명했다.
nsp13 단백질은 유전적으로 잘 보존되어 다양한 변이 코로나바이러스에 대응하는 백신이나 감염 치료의 중요 표적이지만, 정확한 작용 메커니즘에 대해서는 완전한 이해가 부족했다.
연구팀은 nsp13 헬리케이스가 ATP(아데노신 삼인산)*를 분해하여 나온 화학에너지를 이용하여 유전물질인 RNA의 꼬인 구조를 단일 가닥으로 풀어주고 부산물로 ADP(아데노신 이인산)*가 생성하게 된다. 이때 생성된 ADP가 nsp13와 재결합하게 되면 샤페론 기능을 활성화시켜 RNA 이차구조를 추가로 불안정화한다는 사실을 알아냈다.
*ATP(아데노신 삼인산)는 충전된 배터리처럼 에너지를 담고 있고 효소가 일을 할 때는 에너지를 공급해준다. ATP는 인산 3개를 가지고 있어 인산이 분해 될 때 에너지를 방출하고 인산 2개를 가진 ADP(아데노신 이인산)를 부산물로 생성한다.
결론적으로 헬리케이스 활성과 샤페론 활성이 시공간적으로 동시에 협력해 RNA 복제를 촉진하게 된다는 새로운 방식의 작용기전을 규명했다.
이광록 교수는 “이번 연구는 대표적 핵산-효소 단백질인 헬리케이스가 ADP를 통해 샤페론적 활성을 나타내는 새로운 발견이며, 이를 통해 헬리케이스의 기능 다양성에 대한 이해의 폭을 넓혀주고, SARS 코로나바이러스의 다양한 변이에 대응할 효과적 치료제 및 백신 개발의 실마리를 제공할 것으로 기대한다”라고 연구 결과의 의의를 밝혔다.
이 연구는 유정민 박사가 제 1저자로 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF: 16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 29일 게재됐다. (논문명 : A novel ADP-directed chaperone function facilitates the ATP-driven motor activity of SARS-CoV helicase) (doi: 10.1093/nar/gkaf034)
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구지원, 선도연구센터 지원사업, 글로벌 기초연구 지원사업과 합성생물학핵심기술개발사업의 지원을 받아 수행됐다.
2025.02.17 조회수 4732 암 발생 현상 등 유전자 발현 조절 원리 규명
다양한 암 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포의 활성화 과정 등을 근본적으로 일으키는 유전자 발현 조절 단백질의 핵심 유전자 발현 네트워크를 발견했다. 우리 연구진은 이 발견을 기초로 하여 혁신적인 치료 기술 개발에 활용 가능성을 높였다.
우리 대학 생명과학과 김세윤 교수, 이광록 교수, 조원기 교수 공동연구팀이 동물 세포의 유전자 발현을 조절하는 핵심적인 원리를 규명했다고 22일 밝혔다.
이노시톨 대사 효소에 의해 만들어지는 이노시톨 인산 대사체는 진핵 세포의 신호전달 시스템에 필요한 다양한 이차 신호전달물질로 작용하며 암, 비만, 당뇨, 신경계 질환들에 폭넓게 관여한다.
연구팀은 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자로 작용함을 규명했다.
포도당과 유사한 영양소로 알려진 이노시톨의 대사 반응에 핵심적으로 작용하는 효소인 IPMK 단백질(inositol polyphosphate multikinase)은 유전자 발현을 직접적으로 조절하는 기능을 가지고 있다. 특히 IPMK 효소는 동물 세포의 대표적인 전사 인자(transcription factor)인 혈청 반응 인자(serum response factor, 이하 SRF)에 의한 유전자 전사 과정에 중요하다고 보고된 바 있으나 작용하는 기전에 대하여 알려진 바는 없었다.
SRF 전사 인자는 최소 200~300여 개의 유전자 발현을 직접적으로 조절하는 단백질로서, 동물 세포의 성장과 증식, 세포 사멸, 세포의 이동성 등을 조절하며 심장과 같은 장기 발생에 필수적이다.
연구팀은 IPMK 단백질이 SRF 전사 인자와 직접적으로 결합한다는 사실을 발견하고 이를 통해 SRF 전사 인자의 3차원적 단백질 구조를 변화시킨다는 것을 밝혔다.
연구팀은 IPMK 효소에 의하여 활성화된 SRF 전사 인자를 통해 다양한 유전자들의 전사 과정이 촉진된다는 것을 밝혔다. 즉, IPMK 단백질은 SRF 전사 인자의 단백질 활성을 높이는 데 반드시 필요한 조절 스위치와 같은 역할을 수행하는 것임을 연구팀은 규명했다.
연구팀은 IPMK 효소와 SRF 전사 인자 사이의 직접적인 결합에 문제가 발생할 경우, SRF 전사 인자의 기능과 활성이 낮아져 유전자 발현에 심각한 장애가 발생한다는 점을 최종적으로 검증하였다.
특히 SRF 전사 인자가 가지고 있는 비정형 영역(Intrinsically disordered region, IDR)이 중요한 조절 부위라는 점을 밝힘으로써 비정형 단백질의 생물학적 중요성을 제시했다. 보통 단백질은 접힘을 통해 고유의 구조를 나타내지만 비정형 영역을 포함하게 되는 경우에는 특정한 단백질 구조가 관찰되지 않는다. 학계에서는 이러한 비정형 영역을 가지고 있는 단백질들을 비정형 단백질이라고 구분하고 어떠한 기능을 수행하는지 주목하고 있다.
김세윤 교수는 “이번 연구는 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자이며 이를 증명하는 핵심 메커니즘을 제시한 중요한 발견”이라며, “SRF 전사 인자로부터 파생되는 다양한 암의 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포 활성화 과정 등을 근본적으로 이해함으로써 혁신적인 치료 기술 개발 등에 폭넓게 활용되기를 바란다”라는 기대를 전했다.
이 연구는 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF=16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 7일 게재됐다. (논문명 : Single-molecule analysis reveals that IPMK enhances the DNA-binding activity of the transcription factor SRF) (doi: 10.1093/nar/gkae1281)
한편 이번 연구는 한국연구재단의 중견연구사업, 선도연구센터 지원사업, 글로벌 기초연구실 지원사업과 서경배과학재단, 삼성미래기술육성사업의 지원을 받아 수행됐다.
2025.01.22 조회수 5635
암 발생 현상 등 유전자 발현 조절 원리 규명
다양한 암 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포의 활성화 과정 등을 근본적으로 일으키는 유전자 발현 조절 단백질의 핵심 유전자 발현 네트워크를 발견했다. 우리 연구진은 이 발견을 기초로 하여 혁신적인 치료 기술 개발에 활용 가능성을 높였다.
우리 대학 생명과학과 김세윤 교수, 이광록 교수, 조원기 교수 공동연구팀이 동물 세포의 유전자 발현을 조절하는 핵심적인 원리를 규명했다고 22일 밝혔다.
이노시톨 대사 효소에 의해 만들어지는 이노시톨 인산 대사체는 진핵 세포의 신호전달 시스템에 필요한 다양한 이차 신호전달물질로 작용하며 암, 비만, 당뇨, 신경계 질환들에 폭넓게 관여한다.
연구팀은 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자로 작용함을 규명했다.
포도당과 유사한 영양소로 알려진 이노시톨의 대사 반응에 핵심적으로 작용하는 효소인 IPMK 단백질(inositol polyphosphate multikinase)은 유전자 발현을 직접적으로 조절하는 기능을 가지고 있다. 특히 IPMK 효소는 동물 세포의 대표적인 전사 인자(transcription factor)인 혈청 반응 인자(serum response factor, 이하 SRF)에 의한 유전자 전사 과정에 중요하다고 보고된 바 있으나 작용하는 기전에 대하여 알려진 바는 없었다.
SRF 전사 인자는 최소 200~300여 개의 유전자 발현을 직접적으로 조절하는 단백질로서, 동물 세포의 성장과 증식, 세포 사멸, 세포의 이동성 등을 조절하며 심장과 같은 장기 발생에 필수적이다.
연구팀은 IPMK 단백질이 SRF 전사 인자와 직접적으로 결합한다는 사실을 발견하고 이를 통해 SRF 전사 인자의 3차원적 단백질 구조를 변화시킨다는 것을 밝혔다.
연구팀은 IPMK 효소에 의하여 활성화된 SRF 전사 인자를 통해 다양한 유전자들의 전사 과정이 촉진된다는 것을 밝혔다. 즉, IPMK 단백질은 SRF 전사 인자의 단백질 활성을 높이는 데 반드시 필요한 조절 스위치와 같은 역할을 수행하는 것임을 연구팀은 규명했다.
연구팀은 IPMK 효소와 SRF 전사 인자 사이의 직접적인 결합에 문제가 발생할 경우, SRF 전사 인자의 기능과 활성이 낮아져 유전자 발현에 심각한 장애가 발생한다는 점을 최종적으로 검증하였다.
특히 SRF 전사 인자가 가지고 있는 비정형 영역(Intrinsically disordered region, IDR)이 중요한 조절 부위라는 점을 밝힘으로써 비정형 단백질의 생물학적 중요성을 제시했다. 보통 단백질은 접힘을 통해 고유의 구조를 나타내지만 비정형 영역을 포함하게 되는 경우에는 특정한 단백질 구조가 관찰되지 않는다. 학계에서는 이러한 비정형 영역을 가지고 있는 단백질들을 비정형 단백질이라고 구분하고 어떠한 기능을 수행하는지 주목하고 있다.
김세윤 교수는 “이번 연구는 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자이며 이를 증명하는 핵심 메커니즘을 제시한 중요한 발견”이라며, “SRF 전사 인자로부터 파생되는 다양한 암의 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포 활성화 과정 등을 근본적으로 이해함으로써 혁신적인 치료 기술 개발 등에 폭넓게 활용되기를 바란다”라는 기대를 전했다.
이 연구는 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF=16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 7일 게재됐다. (논문명 : Single-molecule analysis reveals that IPMK enhances the DNA-binding activity of the transcription factor SRF) (doi: 10.1093/nar/gkae1281)
한편 이번 연구는 한국연구재단의 중견연구사업, 선도연구센터 지원사업, 글로벌 기초연구실 지원사업과 서경배과학재단, 삼성미래기술육성사업의 지원을 받아 수행됐다.
2025.01.22 조회수 5635 스트레스 위험 혈관 변화 실시간으로 잡아낸다
심혈관 질환은 전 세계 사망 원인 1위로 매우 심각한 건강 문제다. 특히, 정신적 스트레스가 심혈관 질환을 더 악화시킨다는 것이 보고되어 왔다. 한국 연구진이 그동안 관찰하기 어려웠던 스트레스로 인한 혈관 변화를 실시간으로 알아내는 데 성공했다.
우리 대학 기계공학과 유홍기 교수 연구팀이 고려대학교 구로병원 심혈관센터 김진원 교수 연구팀과 협력해 심장 박동으로 인한 혈관의 움직임을 보상해 실시간으로 혈관 내 세포의 움직임을 관찰할 수 있는 새로운 생체 내 영상 획득 기술을 개발했다고 20일 밝혔다.
연구팀은 초점 가변 렌즈를 생체 내 광학 현미경에 도입해 동맥의 움직임을 추정했고, 이를 현미경의 초점 평면과 동기화하는 기법을 개발했다. 이 기술을 통해 동맥의 움직임으로 인한 이미지 간의 상관 계수(이미지들 간의 유사성을 나타내는 통계적 지표)를 4배 높일 수 있었고, 시간해상도(단위 시간당 촬영 가능한 이미지 수)를 57% 향상해 혈관 내 면역세포의 빠른 움직임을 실시간으로 관찰했다.
즉, 이 기술을 통해 동맥의 움직임으로 인한 영상 왜곡을 크게 줄이고 초점을 안정적으로 유지함으로써, 영상을 놓치지 않고 혈관 내에서 빠르게 움직이는 면역세포를 실시간으로 관찰하는 데 성공했다.
연구팀은 만성 스트레스에 노출된 실험군 쥐와 대조군 쥐의 경동맥에서 생체 내 영상 획득에 본 기술을 적용했고, 동맥경화 병변의 진행 정도를 세포 수준의 해상도에서 정량적으로 평가할 수 있었다.
만성 스트레스에 노출된 쥐의 경동맥에서 골수 세포의 침윤이 대조군 대비 6.09배 증가했으며, 추적 영상에서는 골수 세포가 2.45배 더 증가하는 것을 확인했다. 또한, 조직학적 분석을 통해 스트레스가 동맥경화반의 크기와 염증을 증가시키고, 섬유성 막을 얇게 만들어 경화반의 불안정성을 높인다는 것을 입증했다.
유홍기 교수는 “이번 연구를 통해 비접촉 방법으로 동맥의 움직임을 정확하게 추정할 수 있었고, 이 방법은 실험동물의 높은 생존율을 보장할 수 있어 만성 스트레스가 미치는 영향을 종단 연구로 입증할 수 있었다”라고 말했다.
이어 유 교수는 “이 기술은 우수한 시간 해상도를 제공해 스트레스가 심혈관 질환에 미치는 영향을 세포 수준에서 실시간으로 관찰할 수 있어 앞으로 스트레스 관련 심혈관 질환의 발병 기전을 규명하고 새로운 치료법을 개발하는 데 중요한 도구로 활용될 것으로 기대하고 있다”라고 강조했다.
기계공학과 장민석 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘동맥경화, 혈전, 혈관 생물학(Arteriosclerosis, Thrombosis, and Vascular Biology)’에 지난해 10월 10일 온라인판 게재됐고, 44권 12호에 표지논문과 에디터픽으로 선정됐다.
(논문명: Real-time imaging assessment of stress-induced vascular inflammation using heartbeat-synchronized motion compensation)
한편 이번 연구는 한국연구재단, 범부처전주기의료기기연구개발사업단의 지원을 받아 수행됐다.
2025.01.22 조회수 4012
스트레스 위험 혈관 변화 실시간으로 잡아낸다
심혈관 질환은 전 세계 사망 원인 1위로 매우 심각한 건강 문제다. 특히, 정신적 스트레스가 심혈관 질환을 더 악화시킨다는 것이 보고되어 왔다. 한국 연구진이 그동안 관찰하기 어려웠던 스트레스로 인한 혈관 변화를 실시간으로 알아내는 데 성공했다.
우리 대학 기계공학과 유홍기 교수 연구팀이 고려대학교 구로병원 심혈관센터 김진원 교수 연구팀과 협력해 심장 박동으로 인한 혈관의 움직임을 보상해 실시간으로 혈관 내 세포의 움직임을 관찰할 수 있는 새로운 생체 내 영상 획득 기술을 개발했다고 20일 밝혔다.
연구팀은 초점 가변 렌즈를 생체 내 광학 현미경에 도입해 동맥의 움직임을 추정했고, 이를 현미경의 초점 평면과 동기화하는 기법을 개발했다. 이 기술을 통해 동맥의 움직임으로 인한 이미지 간의 상관 계수(이미지들 간의 유사성을 나타내는 통계적 지표)를 4배 높일 수 있었고, 시간해상도(단위 시간당 촬영 가능한 이미지 수)를 57% 향상해 혈관 내 면역세포의 빠른 움직임을 실시간으로 관찰했다.
즉, 이 기술을 통해 동맥의 움직임으로 인한 영상 왜곡을 크게 줄이고 초점을 안정적으로 유지함으로써, 영상을 놓치지 않고 혈관 내에서 빠르게 움직이는 면역세포를 실시간으로 관찰하는 데 성공했다.
연구팀은 만성 스트레스에 노출된 실험군 쥐와 대조군 쥐의 경동맥에서 생체 내 영상 획득에 본 기술을 적용했고, 동맥경화 병변의 진행 정도를 세포 수준의 해상도에서 정량적으로 평가할 수 있었다.
만성 스트레스에 노출된 쥐의 경동맥에서 골수 세포의 침윤이 대조군 대비 6.09배 증가했으며, 추적 영상에서는 골수 세포가 2.45배 더 증가하는 것을 확인했다. 또한, 조직학적 분석을 통해 스트레스가 동맥경화반의 크기와 염증을 증가시키고, 섬유성 막을 얇게 만들어 경화반의 불안정성을 높인다는 것을 입증했다.
유홍기 교수는 “이번 연구를 통해 비접촉 방법으로 동맥의 움직임을 정확하게 추정할 수 있었고, 이 방법은 실험동물의 높은 생존율을 보장할 수 있어 만성 스트레스가 미치는 영향을 종단 연구로 입증할 수 있었다”라고 말했다.
이어 유 교수는 “이 기술은 우수한 시간 해상도를 제공해 스트레스가 심혈관 질환에 미치는 영향을 세포 수준에서 실시간으로 관찰할 수 있어 앞으로 스트레스 관련 심혈관 질환의 발병 기전을 규명하고 새로운 치료법을 개발하는 데 중요한 도구로 활용될 것으로 기대하고 있다”라고 강조했다.
기계공학과 장민석 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘동맥경화, 혈전, 혈관 생물학(Arteriosclerosis, Thrombosis, and Vascular Biology)’에 지난해 10월 10일 온라인판 게재됐고, 44권 12호에 표지논문과 에디터픽으로 선정됐다.
(논문명: Real-time imaging assessment of stress-induced vascular inflammation using heartbeat-synchronized motion compensation)
한편 이번 연구는 한국연구재단, 범부처전주기의료기기연구개발사업단의 지원을 받아 수행됐다.
2025.01.22 조회수 4012 원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18 조회수 5295
원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18 조회수 5295 홀로토모그래피로 오가노이드 실시간 관찰 성공
인체 장기의 구조와 기능을 모사한 3차원 미니 장기인 오가노이드는 다양한 질병 연구와 신약 개발에 필수적인 역할을 하고 있다. 한국 연구진이 기존 이미징 기술의 한계를 극복하고 살아있는 오가노이드를 고해상도로 실시간 동적 변화를 관찰하는 데 성공했다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영) 유전체 교정 연구단(단장 구본경) 연구팀과 ㈜토모큐브의 협력으로, 홀로토모그래피 (holotomography) 기술을 활용해 살아있는 소장 오가노이드를 실시간으로 고해상도로 관찰할 수 있는 이미징 기술을 개발했다고 14일 밝혔다.
기존의 이미징 기법들은 살아있는 오가노이드를 장기간 고해상도로 관찰하는 데 한계가 있었고, 형광 염색 등의 추가적인 처리가 필요한 경우가 많았다.
연구팀은 이러한 문제를 해결하기 위해 형광 등 염색 없이도 고해상도의 이미지를 제공하고, 세포 손상 없이 오랜 시간 동안 실시간으로 동적 변화를 관찰할 수 있는 홀로토모그래피 기술을 도입했다.
연구진은 실험용 쥐(마우스) 소장 오가노이드를 이용해 이 기술을 검증했으며, 그 결과 홀로토모그래피를 통해 오가노이드 내부의 다양한 세포 구조를 세밀하게 관찰할 수 있었고, 오가노이드의 성장 과정과 세포 분열, 세포 사멸 등의 동적 변화를 실시간으로 포착할 수 있었다.
또한, 약물 처리에 따른 오가노이드의 반응을 정밀하게 분석해 세포 생존 여부를 확인할 수 있었다.
연구진은 이번 연구를 통해 오가노이드 연구의 새로운 지평을 열었으며, 이를 통해 신약 개발, 맞춤형 치료, 재생 의학 등 다양한 분야에서 오가노이드의 활용을 극대화할 수 있을 것이라고 기대하고 있다.
향후 연구는 오가노이드의 생체 내 환경을 더 정확히 재현하고, 더욱 정교한 3차원 이미징을 통해 세포 수준에서의 다양한 생명현상을 이해하는 데 큰 기여를 할 것으로 전망된다.
논문의 제1 저자인 이만재 박사(KAIST 의과학대학원 졸, 現 충남대병원)는 “이번 연구는 기존의 한계를 뛰어넘는 새로운 이미징 기술로, 향후 오가노이드를 활용한 질병 모델링, 환자 맞춤형 치료 및 신약 개발 연구에 크게 기여할 것”이라고 밝혔다.
이번 연구 결과는 2024년 10월 1일 국제 학술지 ‘Experimental & Molecular Medicine’에 온라인 게재됐으며, 해당 기술은 다양한 생명과학 분야에서의 적용 가능성을 인정받고 있다.
(논문명: Long-term three-dimensional high-resolution imaging of live unlabeled small intestinal organoids via low-coherence holotomography)
본 연구는 한국연구재단 리더연구사업, KAIST 연구소 및 기초과학연구원의 지원을 받아 수행됐다.
2024.10.14 조회수 5478
홀로토모그래피로 오가노이드 실시간 관찰 성공
인체 장기의 구조와 기능을 모사한 3차원 미니 장기인 오가노이드는 다양한 질병 연구와 신약 개발에 필수적인 역할을 하고 있다. 한국 연구진이 기존 이미징 기술의 한계를 극복하고 살아있는 오가노이드를 고해상도로 실시간 동적 변화를 관찰하는 데 성공했다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영) 유전체 교정 연구단(단장 구본경) 연구팀과 ㈜토모큐브의 협력으로, 홀로토모그래피 (holotomography) 기술을 활용해 살아있는 소장 오가노이드를 실시간으로 고해상도로 관찰할 수 있는 이미징 기술을 개발했다고 14일 밝혔다.
기존의 이미징 기법들은 살아있는 오가노이드를 장기간 고해상도로 관찰하는 데 한계가 있었고, 형광 염색 등의 추가적인 처리가 필요한 경우가 많았다.
연구팀은 이러한 문제를 해결하기 위해 형광 등 염색 없이도 고해상도의 이미지를 제공하고, 세포 손상 없이 오랜 시간 동안 실시간으로 동적 변화를 관찰할 수 있는 홀로토모그래피 기술을 도입했다.
연구진은 실험용 쥐(마우스) 소장 오가노이드를 이용해 이 기술을 검증했으며, 그 결과 홀로토모그래피를 통해 오가노이드 내부의 다양한 세포 구조를 세밀하게 관찰할 수 있었고, 오가노이드의 성장 과정과 세포 분열, 세포 사멸 등의 동적 변화를 실시간으로 포착할 수 있었다.
또한, 약물 처리에 따른 오가노이드의 반응을 정밀하게 분석해 세포 생존 여부를 확인할 수 있었다.
연구진은 이번 연구를 통해 오가노이드 연구의 새로운 지평을 열었으며, 이를 통해 신약 개발, 맞춤형 치료, 재생 의학 등 다양한 분야에서 오가노이드의 활용을 극대화할 수 있을 것이라고 기대하고 있다.
향후 연구는 오가노이드의 생체 내 환경을 더 정확히 재현하고, 더욱 정교한 3차원 이미징을 통해 세포 수준에서의 다양한 생명현상을 이해하는 데 큰 기여를 할 것으로 전망된다.
논문의 제1 저자인 이만재 박사(KAIST 의과학대학원 졸, 現 충남대병원)는 “이번 연구는 기존의 한계를 뛰어넘는 새로운 이미징 기술로, 향후 오가노이드를 활용한 질병 모델링, 환자 맞춤형 치료 및 신약 개발 연구에 크게 기여할 것”이라고 밝혔다.
이번 연구 결과는 2024년 10월 1일 국제 학술지 ‘Experimental & Molecular Medicine’에 온라인 게재됐으며, 해당 기술은 다양한 생명과학 분야에서의 적용 가능성을 인정받고 있다.
(논문명: Long-term three-dimensional high-resolution imaging of live unlabeled small intestinal organoids via low-coherence holotomography)
본 연구는 한국연구재단 리더연구사업, KAIST 연구소 및 기초과학연구원의 지원을 받아 수행됐다.
2024.10.14 조회수 5478 기계공학과 유홍기 교수 연구팀, 빛으로 동맥경화반 동시 진단 및 치료 기술 개발
관상동맥 내 고위험 동맥경화반은 파열과 협착을 유발하여 빠르게 혈관을 막을 수 있어 진단과 동시에 즉각적인 치료가 필요하다.
우리 대학 기계공학과 유홍기 교수 연구팀은 고려대학교구로병원 심혈관센터 김진원 교수팀, 중앙대학교 시스템생명공학과 박경순 교수팀과의 공동연구를 통해, 빛을 이용하여 동맥경화반 진단과 치료를 동시에 할 수 있는 새로운 원천 기술을 개발하였다.
이 기술은 유홍기 교수 연구팀이 개발한 광단층-분자영상 결합 카테터 기반 정밀 영상 시스템과 광치료 카테터를 이용해 빛을 조사하여 고위험 병변을 정확히 진단하고 치료하는 방법이다.
동맥경화반 내 대식세포의 특정 수용체를 표적하는 전달체와 광활성체를 결합한 테라노스틱 제제를 혈관에 투여한 후 혈관내 카테터를 이용해 위험 부위를 찾아내고 그 부위에 빛을 조사하였다. 그 결과, 고위험 동맥경화반을 실시간 정밀 영상으로 진단하였고 동시에 성공적으로 치료할 수 있었다.
치료 후 효과를 정밀 영상 시스템을 통해 생체 내에서 추적 검증했으며, 광활성에 의한 자가소화를 유도해 사멸 세포를 탐식 및 제거, 콜레스테롤 유출로 염증을 해소하고 콜라겐 조직 증가를 유도해 병변이 치료 및 안정화 됨을 밝혔다.
연구진은 “이번 연구를 통해 기존 방법의 한계였던 고위험 동맥경화반의 정밀 진단을 가능케 하였고, 동시에 광치료 시스템을 이용해 빛을 전달하여 고위험 동맥경화반을 치료하고 안정화하는 데 성공했다는 점에서 큰 의의가 있다.”라고 밝혔다. 또한 “기존 동맥경화반 치료법인 스텐트 치료가 가지는 이물질 잔존 위험을 극복할 수 있으며, 심혈관 진단 및 치료 분야에서 새로운 가능성을 제시했다.”고 했다. 연구진은 “이번 연구 결과를 바탕으로, 추후 임상 적용을 위한 시제품 개발을 적극적으로 추진할 계획”이라고 덧붙였다.
이번 연구 결과는 기계공학과 김연훈 박사과정생이 공동 제1저자로, 유홍기 교수가 공동교신저자로 참여하였으며, 국제학술지 Circulation Research (5-year IF: 20.3) 에 게재되었다.
한편 이번 연구는 한국연구재단이 주관하는 원천기술개발사업의 지원을 받아 수행됐다.
2024.08.23 조회수 5926
기계공학과 유홍기 교수 연구팀, 빛으로 동맥경화반 동시 진단 및 치료 기술 개발
관상동맥 내 고위험 동맥경화반은 파열과 협착을 유발하여 빠르게 혈관을 막을 수 있어 진단과 동시에 즉각적인 치료가 필요하다.
우리 대학 기계공학과 유홍기 교수 연구팀은 고려대학교구로병원 심혈관센터 김진원 교수팀, 중앙대학교 시스템생명공학과 박경순 교수팀과의 공동연구를 통해, 빛을 이용하여 동맥경화반 진단과 치료를 동시에 할 수 있는 새로운 원천 기술을 개발하였다.
이 기술은 유홍기 교수 연구팀이 개발한 광단층-분자영상 결합 카테터 기반 정밀 영상 시스템과 광치료 카테터를 이용해 빛을 조사하여 고위험 병변을 정확히 진단하고 치료하는 방법이다.
동맥경화반 내 대식세포의 특정 수용체를 표적하는 전달체와 광활성체를 결합한 테라노스틱 제제를 혈관에 투여한 후 혈관내 카테터를 이용해 위험 부위를 찾아내고 그 부위에 빛을 조사하였다. 그 결과, 고위험 동맥경화반을 실시간 정밀 영상으로 진단하였고 동시에 성공적으로 치료할 수 있었다.
치료 후 효과를 정밀 영상 시스템을 통해 생체 내에서 추적 검증했으며, 광활성에 의한 자가소화를 유도해 사멸 세포를 탐식 및 제거, 콜레스테롤 유출로 염증을 해소하고 콜라겐 조직 증가를 유도해 병변이 치료 및 안정화 됨을 밝혔다.
연구진은 “이번 연구를 통해 기존 방법의 한계였던 고위험 동맥경화반의 정밀 진단을 가능케 하였고, 동시에 광치료 시스템을 이용해 빛을 전달하여 고위험 동맥경화반을 치료하고 안정화하는 데 성공했다는 점에서 큰 의의가 있다.”라고 밝혔다. 또한 “기존 동맥경화반 치료법인 스텐트 치료가 가지는 이물질 잔존 위험을 극복할 수 있으며, 심혈관 진단 및 치료 분야에서 새로운 가능성을 제시했다.”고 했다. 연구진은 “이번 연구 결과를 바탕으로, 추후 임상 적용을 위한 시제품 개발을 적극적으로 추진할 계획”이라고 덧붙였다.
이번 연구 결과는 기계공학과 김연훈 박사과정생이 공동 제1저자로, 유홍기 교수가 공동교신저자로 참여하였으며, 국제학술지 Circulation Research (5-year IF: 20.3) 에 게재되었다.
한편 이번 연구는 한국연구재단이 주관하는 원천기술개발사업의 지원을 받아 수행됐다.
2024.08.23 조회수 5926 미토콘드리아로 퇴행성 질환까지 제어 가능하다
우리 대학 생명화학공학과 김유식 교수 연구팀이 비정상적 면역 활성을 유발해 염증반응이 동반된 세포 사멸을 일으키는 미토콘드리아 이중나선 RNA의 새로운 조절 기전을 찾아냈다고 22일 밝혔다.
최근 미토콘드리아 이중나선 RNA가 스트레스 환경에서 세포질로 빠져나가 비정상적 면역 활성 및 세포 사멸을 유발한다는 것이 밝혀졌다. 또한 이러한 미토콘드리아 이중나선 RNA로 촉발되는 면역 활성은 관절염 및 헌팅턴 무도병을 비롯한 염증반응이 동반된 퇴행성 질환과 자가면역질환 중 하나인 쇼그렌 증후군의 발병 및 진행에 핵심적인 역할을 한다는 것이 보고됐다.
아직 미토콘드리아 이중나선 RNA의 분자적 조절 기전에 대해서는 보고된 바 없다는 점을 착안해서 연구팀은 미토콘드리아 내에 존재하며 RNA와 결합할 수 있는 단백질에 대해 유전자 가위를 이용해 각 단백질의 발현을 억제한 후 미토콘드리아 이중나선 RNA의 발현량을 조사했다.
이 과정에서 RNA의 구성 물질 중 하나인 시토신의 화학적 변형을 유발하는 엔썬4(NSUN4)*이라는 단백질의 발현을 줄였을 때 미토콘드리아 이중나선 RNA의 발현이 유의미하게 증가하는 것을 확인했다.
*엔썬4 (NSUN4): NOP2/Sun RNA 메틸트랜스퍼라제 4
나아가, 연구팀은 단백질을 생산하지 않는 미토콘드리아 비암호화 RNA의 변형을 가속시키는 것이 동 단백질 엔썬4에 의해서라고 최초로 제시했다.
연구팀은 추가 연구를 통해 미토콘드리아 RNA 단백질들의 발현 감소로 축적된 미토콘드리아 이중나선 RNA의 양이 증가했으며 세포질로 누출된 미토콘드리아 이중나선 RNA는 면역반응을 활성화시켰다. 이를 통해 연구팀은 새로운 세포 내 면역 유발인자로 최근 주목받기 시작한 미토콘드리아 이중나선 RNA의 변형에 의한 발현 조절 기전을 제시했다.
생명화학공학과 김유식 교수는 “이번 연구를 통해 비정상적 면역 활성 유발 인자로 최근 주목받고 있는 미토콘드리아 이중나선 RNA의 형성 및 조절 기전을 밝혔다”면서 “이번 연구의 결과를 바탕으로 면역 계통 질환을 비롯해 다양한 퇴행성 질환의 발병 및 진행 과정을 효과적으로 제어할 수 있는 전략을 제시할 수 있을 것”이라고 말했다.
생명화학공학과 김수진 박사(現 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학(Harvard Medical School) 박사후연구원)와 탄 스테파니(Tan Stephanie) 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 7월 16일 字에 온라인 게재됐다. (논문명 : RNA 5-methylcytosine marks mitochondrial double-stranded RNAs for degradation and cytosolic release).
한편 이번 연구는 한국연구재단 우수신진연구지원사업과 미국 국립보건원의 지원으로 수행됐다.
2024.07.22 조회수 6095
미토콘드리아로 퇴행성 질환까지 제어 가능하다
우리 대학 생명화학공학과 김유식 교수 연구팀이 비정상적 면역 활성을 유발해 염증반응이 동반된 세포 사멸을 일으키는 미토콘드리아 이중나선 RNA의 새로운 조절 기전을 찾아냈다고 22일 밝혔다.
최근 미토콘드리아 이중나선 RNA가 스트레스 환경에서 세포질로 빠져나가 비정상적 면역 활성 및 세포 사멸을 유발한다는 것이 밝혀졌다. 또한 이러한 미토콘드리아 이중나선 RNA로 촉발되는 면역 활성은 관절염 및 헌팅턴 무도병을 비롯한 염증반응이 동반된 퇴행성 질환과 자가면역질환 중 하나인 쇼그렌 증후군의 발병 및 진행에 핵심적인 역할을 한다는 것이 보고됐다.
아직 미토콘드리아 이중나선 RNA의 분자적 조절 기전에 대해서는 보고된 바 없다는 점을 착안해서 연구팀은 미토콘드리아 내에 존재하며 RNA와 결합할 수 있는 단백질에 대해 유전자 가위를 이용해 각 단백질의 발현을 억제한 후 미토콘드리아 이중나선 RNA의 발현량을 조사했다.
이 과정에서 RNA의 구성 물질 중 하나인 시토신의 화학적 변형을 유발하는 엔썬4(NSUN4)*이라는 단백질의 발현을 줄였을 때 미토콘드리아 이중나선 RNA의 발현이 유의미하게 증가하는 것을 확인했다.
*엔썬4 (NSUN4): NOP2/Sun RNA 메틸트랜스퍼라제 4
나아가, 연구팀은 단백질을 생산하지 않는 미토콘드리아 비암호화 RNA의 변형을 가속시키는 것이 동 단백질 엔썬4에 의해서라고 최초로 제시했다.
연구팀은 추가 연구를 통해 미토콘드리아 RNA 단백질들의 발현 감소로 축적된 미토콘드리아 이중나선 RNA의 양이 증가했으며 세포질로 누출된 미토콘드리아 이중나선 RNA는 면역반응을 활성화시켰다. 이를 통해 연구팀은 새로운 세포 내 면역 유발인자로 최근 주목받기 시작한 미토콘드리아 이중나선 RNA의 변형에 의한 발현 조절 기전을 제시했다.
생명화학공학과 김유식 교수는 “이번 연구를 통해 비정상적 면역 활성 유발 인자로 최근 주목받고 있는 미토콘드리아 이중나선 RNA의 형성 및 조절 기전을 밝혔다”면서 “이번 연구의 결과를 바탕으로 면역 계통 질환을 비롯해 다양한 퇴행성 질환의 발병 및 진행 과정을 효과적으로 제어할 수 있는 전략을 제시할 수 있을 것”이라고 말했다.
생명화학공학과 김수진 박사(現 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학(Harvard Medical School) 박사후연구원)와 탄 스테파니(Tan Stephanie) 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 7월 16일 字에 온라인 게재됐다. (논문명 : RNA 5-methylcytosine marks mitochondrial double-stranded RNAs for degradation and cytosolic release).
한편 이번 연구는 한국연구재단 우수신진연구지원사업과 미국 국립보건원의 지원으로 수행됐다.
2024.07.22 조회수 6095 바이러스와 세균의 진화를 규명하다
바이러스는 특정 세포 안에 침투했을 때만 증식의 생명력을 띠고 그 외에는 무생물 같으며, 사람 세포를 감염시키는 코로나19 바이러스, 세균을 잡아먹으며 증식하는 세균바이러스 등이 있다. 국내 연구진이 세균바이러스가 RNA 합성을 마무리 짓는 방식에 해체종결(1)만 있고 재생종결(2)은 없다는 사실을 밝히고 RNA 의약품 개발에 응용될 가능성을 높였다.
(1)해체종결: 합성 복합체가 중합효소, DNA, RNA로 해체
(2)재생종결: RNA만 분리되고 중합효소는 DNA에 남아 재생
우리 대학 생명과학과 강창원 명예교수(줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동연구팀이 세균의 리보핵산(RNA) 합성방식 두 가지 중 하나가 바이러스에는 없다는 것을 발견해, 세균이 바이러스로부터 진화하면서 획득한 방식을 처음 밝힌 연구 논문을 핵산 분야 최상급 국제학술지에 게재했다고 19일 밝혔다.
유전자 DNA의 유전정보에 따라 RNA를 합성하는 효소가 RNA 중합효소다. 이는 유전정보가 DNA에서 RNA로 옮겨 적히기에 전사(轉寫)라고 부르는 유전자 발현 첫 단계를 수행하며, RNA 백신 등 첨단 RNA 의약품을 개발 생산하는 데에 쓰인다. 연구팀은 세균바이러스의 RNA 중합효소를 연구해서 생물로 진화하기 이전 태초의 RNA 합성(전사) 방식을 밝힌 것이다.
유전자에 따라 다른 게 아니라 어느 유전자든 전사 마무리 방식에 두 가지가 있다는 것을 수년 전 세균에서 발견했었다. 그리고 세균보다 진화한 진핵생물 효모의 유전자 전사에서도 두 방식이 모두 쓰인다는 것이 지난달에 보고됐다. 사람도 진핵생물이어서, 세균과 효모뿐 아니라 사람까지 온갖 생물의 유전자 전사에 두 방식 모두 쓰일 개연성이 커졌다.
그런데 이번 연구에서 세균바이러스의 방식은 세균이나 효모와 사뭇 다르다는 것이 밝혀졌다. 바이러스의 경우 재생종결 없이 해체종결만 일어나는 것이다. 이를 토대로, 연구팀은 RNA 중합효소가 세균에서 바이러스와 달리 적응하면서 해체종결에 재생종결이 추가돼 두 방식이 공존하게 되었고, 최소한 효모로의 진화에서 그대로 보존됐다는 해석을 내놓았다.
이번 연구에서 거푸집 DNA와 전사물 RNA에 각기 다른 형광물질을 부착해 전사 복합체 하나하나의 형광을 실시간으로 측정하는 단일분자 형광기술 연구기법이 사용됐다. 전사 종결로 RNA가 방출될 때 DNA가 효소에 붙어있는지 떨어지는지를 낱낱이 구별할 수 있게 설계한 것이 특장점이다. 특히 형광물질이 전사 반응에 지장을 주지 않도록 하는 게 관건이었다.
송은호 박사후연구원과 한선 박사과정 대학원생이 공동 제1 저자로 참여한 논문(제목: Single-mode termination of phage transcriptions, disclosing bacterial adaptation for facilitated reinitiations)이 학술지 핵산연구(Nucleic Acids Research)에 7월 16일 게재됐다. 이로써 강창원 교수와 홍성철 교수는 2017년부터 총 8편의 논문을 공동으로 발표했다.
강창원 교수는 "이번 연구를 통해 수 초 동안의 분자 반응에서 유구한 진화과정을 밝혀냈고, 앞으로 더 광범위한 진화를 연구할 계획이다”라고 했다. 홍성철 교수는 "분자 하나하나를 관찰하여 복잡한 생물체의 진화를 파악했고, 이런 단일분자 연구기법을 차세대 RNA 의약품과 진단 시약의 개발에 응용하는 연구로 이어가고자 한다”라고 했다.
2024.07.19 조회수 7357
바이러스와 세균의 진화를 규명하다
바이러스는 특정 세포 안에 침투했을 때만 증식의 생명력을 띠고 그 외에는 무생물 같으며, 사람 세포를 감염시키는 코로나19 바이러스, 세균을 잡아먹으며 증식하는 세균바이러스 등이 있다. 국내 연구진이 세균바이러스가 RNA 합성을 마무리 짓는 방식에 해체종결(1)만 있고 재생종결(2)은 없다는 사실을 밝히고 RNA 의약품 개발에 응용될 가능성을 높였다.
(1)해체종결: 합성 복합체가 중합효소, DNA, RNA로 해체
(2)재생종결: RNA만 분리되고 중합효소는 DNA에 남아 재생
우리 대학 생명과학과 강창원 명예교수(줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동연구팀이 세균의 리보핵산(RNA) 합성방식 두 가지 중 하나가 바이러스에는 없다는 것을 발견해, 세균이 바이러스로부터 진화하면서 획득한 방식을 처음 밝힌 연구 논문을 핵산 분야 최상급 국제학술지에 게재했다고 19일 밝혔다.
유전자 DNA의 유전정보에 따라 RNA를 합성하는 효소가 RNA 중합효소다. 이는 유전정보가 DNA에서 RNA로 옮겨 적히기에 전사(轉寫)라고 부르는 유전자 발현 첫 단계를 수행하며, RNA 백신 등 첨단 RNA 의약품을 개발 생산하는 데에 쓰인다. 연구팀은 세균바이러스의 RNA 중합효소를 연구해서 생물로 진화하기 이전 태초의 RNA 합성(전사) 방식을 밝힌 것이다.
유전자에 따라 다른 게 아니라 어느 유전자든 전사 마무리 방식에 두 가지가 있다는 것을 수년 전 세균에서 발견했었다. 그리고 세균보다 진화한 진핵생물 효모의 유전자 전사에서도 두 방식이 모두 쓰인다는 것이 지난달에 보고됐다. 사람도 진핵생물이어서, 세균과 효모뿐 아니라 사람까지 온갖 생물의 유전자 전사에 두 방식 모두 쓰일 개연성이 커졌다.
그런데 이번 연구에서 세균바이러스의 방식은 세균이나 효모와 사뭇 다르다는 것이 밝혀졌다. 바이러스의 경우 재생종결 없이 해체종결만 일어나는 것이다. 이를 토대로, 연구팀은 RNA 중합효소가 세균에서 바이러스와 달리 적응하면서 해체종결에 재생종결이 추가돼 두 방식이 공존하게 되었고, 최소한 효모로의 진화에서 그대로 보존됐다는 해석을 내놓았다.
이번 연구에서 거푸집 DNA와 전사물 RNA에 각기 다른 형광물질을 부착해 전사 복합체 하나하나의 형광을 실시간으로 측정하는 단일분자 형광기술 연구기법이 사용됐다. 전사 종결로 RNA가 방출될 때 DNA가 효소에 붙어있는지 떨어지는지를 낱낱이 구별할 수 있게 설계한 것이 특장점이다. 특히 형광물질이 전사 반응에 지장을 주지 않도록 하는 게 관건이었다.
송은호 박사후연구원과 한선 박사과정 대학원생이 공동 제1 저자로 참여한 논문(제목: Single-mode termination of phage transcriptions, disclosing bacterial adaptation for facilitated reinitiations)이 학술지 핵산연구(Nucleic Acids Research)에 7월 16일 게재됐다. 이로써 강창원 교수와 홍성철 교수는 2017년부터 총 8편의 논문을 공동으로 발표했다.
강창원 교수는 "이번 연구를 통해 수 초 동안의 분자 반응에서 유구한 진화과정을 밝혀냈고, 앞으로 더 광범위한 진화를 연구할 계획이다”라고 했다. 홍성철 교수는 "분자 하나하나를 관찰하여 복잡한 생물체의 진화를 파악했고, 이런 단일분자 연구기법을 차세대 RNA 의약품과 진단 시약의 개발에 응용하는 연구로 이어가고자 한다”라고 했다.
2024.07.19 조회수 7357