-
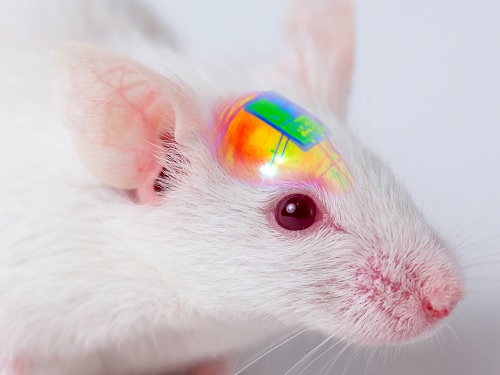 무선 충전 가능한 부드러운 뇌 이식 장치 개발
우리 연구진이 무선 충전 가능한 뇌 이식 장치를 개발했다. 이 장치는 이식 후 생체 내에서 장기간에 걸쳐 배터리 교체 없이 스마트폰을 이용해 빛으로 뇌의 신경회로를 정교하게 조절할 수 있다.
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 연세대 의대 김정훈 교수팀과 공동 연구를 통해 뇌 완전 이식형 무선 광유전학 기기를 개발했다고 26일 밝혔다.
이번 개발 기술은 장기간에 걸친 동물 실험이 필요한 뇌 기능 연구뿐 아니라 향후 인체에 적용돼 중독과 같은 정신질환 및 파킨슨병과 같은 퇴행성 뇌 질환 치료에도 적용될 수 있을 것으로 기대된다.
우리 대학 전기및전자공학부 김충연 박사과정, 연세대 의대 구민정 박사과정 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 1월 22일 字에 게재됐다. (논문명 : Soft subdermal implant capable of wireless battery charging and programmable controls for applications in optogenetics)
광유전학은 빛을 이용해 목표로 하는 특정 신경세포만을 선택적으로 정교하게 제어할 수 있다는 점에서, 뇌 기능을 밝히고 각종 뇌 질환을 치료할 해결책으로 뇌과학 및 신경과학 분야에서 주목받고 있다.
기존의 광유전학은 외부기기와 연결된 광섬유를 통해 신경세포에 빛을 전달하는 방법을 사용하고 있는데, 이러한 유선 방식은 동물의 자유로운 움직임을 크게 제한한다는 점에서 복잡한 동물 실험을 구현하는데 제약이 있다. 반면 최근에 개발된 무선 임플란트 기기들은 동물의 행동을 제약하지는 않지만, 주기적인 배터리의 교체가 필요하거나 외부 장비로부터 무선으로 전력을 공급받아야 하므로 독립적이지 못하고 동작이 안정적이지 못하다는 한계가 있다.
연구팀은 배터리의 무선 충전과 디바이스의 무선 제어를 가능하게 만드는 무선 회로를 개발해 마이크로 LED 기반의 탐침과 결합했다. 이를 통해 동물이 자유롭게 움직이는 상태에서도 배터리의 무선 충전이 가능하고, 스마트폰 앱을 통해 광자극을 무선으로 제어할 수 있는 무게 1.4그램(g)의 뇌 완전이식형 기기를 구현했다. 나아가 생체 이식 후 기기에 의해 주변의 조직이 손상되는 것을 방지하고자, 기기를 매우 부드러운 생체적합성 소재로 감싸 생체조직과 같이 부드러운 형태가 되도록 개발했다.
이번 연구를 주도한 정재웅 교수는 "개발된 장치는 체내 이식 상태에서 무선 충전이 가능하므로 배터리 교체를 위한 추가적인 수술 필요 없이 장기간 사용이 가능하다ˮ며 "이 기술은 뇌 이식용 기기뿐 아니라 인공 심박동기, 위 자극기 등 다양한 생체 이식용 기기에 범용적으로 적용될 수 있을 것이다ˮ고 말했다.
연구팀은 이 기기를 LED 탐침이 쥐의 뇌에 삽입된 상태에서 두피 안으로 완전히 이식하고 쥐가 자유롭게 움직이는 상태에서 배터리가 자동으로 무선 충전될 수 있음을 확인했다. 또한 연구팀은 중독성 약물인 코카인에 반복적으로 노출된 쥐의 특정 뇌 부위에 무선으로 빛을 전달해 코카인으로 인한 행동 민감화 발현을 억제함으로써 광유전학이 코카인에 의한 중독 행동 제어에 적용될 수 있음을 보였다.
아울러 공동연구자 연세대 의대 김정훈 교수는 "자유롭게 움직이는 동물을 바라보며, 단지 스마트폰 앱을 구동해 뇌에 빛을 전달하고, 그로 인해 동물의 특정 행동을 제어할 수 있다는 사실이 매우 흥미롭고, 많은 상상력을 자극한다ˮ라고 말했다.
연구팀은 이 기술을 궁극적으로 인체에 적용할 수 있도록 기기를 더욱 소형화하고 MRI 친화적인 디자인으로 발전시키는 확장 연구를 계획하고 있다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 기초연구실 지원사업과 신진연구자지원사업, KAIST 글로벌 특이점 연구사업의 지원을 받아 수행됐다.
무선 충전 가능한 부드러운 뇌 이식 장치 개발
우리 연구진이 무선 충전 가능한 뇌 이식 장치를 개발했다. 이 장치는 이식 후 생체 내에서 장기간에 걸쳐 배터리 교체 없이 스마트폰을 이용해 빛으로 뇌의 신경회로를 정교하게 조절할 수 있다.
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 연세대 의대 김정훈 교수팀과 공동 연구를 통해 뇌 완전 이식형 무선 광유전학 기기를 개발했다고 26일 밝혔다.
이번 개발 기술은 장기간에 걸친 동물 실험이 필요한 뇌 기능 연구뿐 아니라 향후 인체에 적용돼 중독과 같은 정신질환 및 파킨슨병과 같은 퇴행성 뇌 질환 치료에도 적용될 수 있을 것으로 기대된다.
우리 대학 전기및전자공학부 김충연 박사과정, 연세대 의대 구민정 박사과정 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 1월 22일 字에 게재됐다. (논문명 : Soft subdermal implant capable of wireless battery charging and programmable controls for applications in optogenetics)
광유전학은 빛을 이용해 목표로 하는 특정 신경세포만을 선택적으로 정교하게 제어할 수 있다는 점에서, 뇌 기능을 밝히고 각종 뇌 질환을 치료할 해결책으로 뇌과학 및 신경과학 분야에서 주목받고 있다.
기존의 광유전학은 외부기기와 연결된 광섬유를 통해 신경세포에 빛을 전달하는 방법을 사용하고 있는데, 이러한 유선 방식은 동물의 자유로운 움직임을 크게 제한한다는 점에서 복잡한 동물 실험을 구현하는데 제약이 있다. 반면 최근에 개발된 무선 임플란트 기기들은 동물의 행동을 제약하지는 않지만, 주기적인 배터리의 교체가 필요하거나 외부 장비로부터 무선으로 전력을 공급받아야 하므로 독립적이지 못하고 동작이 안정적이지 못하다는 한계가 있다.
연구팀은 배터리의 무선 충전과 디바이스의 무선 제어를 가능하게 만드는 무선 회로를 개발해 마이크로 LED 기반의 탐침과 결합했다. 이를 통해 동물이 자유롭게 움직이는 상태에서도 배터리의 무선 충전이 가능하고, 스마트폰 앱을 통해 광자극을 무선으로 제어할 수 있는 무게 1.4그램(g)의 뇌 완전이식형 기기를 구현했다. 나아가 생체 이식 후 기기에 의해 주변의 조직이 손상되는 것을 방지하고자, 기기를 매우 부드러운 생체적합성 소재로 감싸 생체조직과 같이 부드러운 형태가 되도록 개발했다.
이번 연구를 주도한 정재웅 교수는 "개발된 장치는 체내 이식 상태에서 무선 충전이 가능하므로 배터리 교체를 위한 추가적인 수술 필요 없이 장기간 사용이 가능하다ˮ며 "이 기술은 뇌 이식용 기기뿐 아니라 인공 심박동기, 위 자극기 등 다양한 생체 이식용 기기에 범용적으로 적용될 수 있을 것이다ˮ고 말했다.
연구팀은 이 기기를 LED 탐침이 쥐의 뇌에 삽입된 상태에서 두피 안으로 완전히 이식하고 쥐가 자유롭게 움직이는 상태에서 배터리가 자동으로 무선 충전될 수 있음을 확인했다. 또한 연구팀은 중독성 약물인 코카인에 반복적으로 노출된 쥐의 특정 뇌 부위에 무선으로 빛을 전달해 코카인으로 인한 행동 민감화 발현을 억제함으로써 광유전학이 코카인에 의한 중독 행동 제어에 적용될 수 있음을 보였다.
아울러 공동연구자 연세대 의대 김정훈 교수는 "자유롭게 움직이는 동물을 바라보며, 단지 스마트폰 앱을 구동해 뇌에 빛을 전달하고, 그로 인해 동물의 특정 행동을 제어할 수 있다는 사실이 매우 흥미롭고, 많은 상상력을 자극한다ˮ라고 말했다.
연구팀은 이 기술을 궁극적으로 인체에 적용할 수 있도록 기기를 더욱 소형화하고 MRI 친화적인 디자인으로 발전시키는 확장 연구를 계획하고 있다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 기초연구실 지원사업과 신진연구자지원사업, KAIST 글로벌 특이점 연구사업의 지원을 받아 수행됐다.
2021.01.26
조회수 80678
-
 시스템생물학 이용 세계 최초 알츠하이머성 치매 환자 맞춤형 치료 효능 예측 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀 (장소영 박사과정(제1저자), 강의룡 박사과정, 장홍준 박사과정)은 서울대학교 의과대학 묵인희 교수 연구팀과 공동연구를 통해 시스템생물학*과 알츠하이머 환자 유래 뇌 오가노이드** 모델의 융합으로 환자 맞춤형 약물 효능평가 플랫폼(Drug-screening platform)을 세계 최초로 개발했다고 13일 밝혔다.
* 시스템생물학: IT의 수학모델링 및 컴퓨터시뮬레이션과 BT의 분자세포생물학 실험을 융합하여 복잡한 생명현상을 규명하고 설명하는 연구 패러다임
** 뇌 오가노이드: 환자의 역분화 줄기세포(iPSC) 유래 인공 미니 뇌
알츠하이머병은 치매의 약 70%를 차지하는 대표적 치매 질환이나 현재까지 발병 원인이 불명확하며, 근본적인 치료제도 없는 인류가 극복하지 못한 질병 중 하나다.
알츠하이머병 치료제 개발 난제 중 하나는 실제 살아있는 환자의 뇌를 직접 실험 샘플로 사용할 수 없다는 것이었다. 이는 수많은 치료제 후보군의 약물 효능을 정확히 평가하기가 어려워 치료제 개발의 걸림돌로 작용해왔다.
조광현 교수 공동 연구팀은 실제 치매환자에서 유래한 뇌 오가노이드 기반으로 생물학적 메커니즘에 대한 수학 모델링을 융합하여 약물효능 예측이 가능한 플랫폼을 세계 최초로 개발했다. 환자 혈액으로부터 역분화줄기세포(Induced-pluripotent stem cell)*를 구축 후 이를 이용하여 3D 뇌 오가노이드를 제작해 실제 환자의 뇌와 유사한 환경 구축을 통해 실험적 한계를 극복했다.
* 역분화줄기세포: 다능성이 없는 혈액 면역세포에 역분화를 일으키는 4가지 특정 유전자를 도입하여 배아 줄기세포와 같이 모든 종류의 세포로 분화할 수 있는 성질(다능성)을 가진 줄기세포
또한, 시스템생물학 기반 수학 모델링 기법으로 알츠하이머병의 신경세포 특이적 네트워크망을 구축하고, 이를 실제 알츠하이머병 환자 및 정상군 유래 뇌 오가노이드를 통하여 신경세포 컴퓨터 모델의 실효성을 검증했다.
이 연구결과는 알츠하이머병의 시스템생물학 기반 신경세포 컴퓨터 모델을 실제 환자 유래 뇌 오가노이드로 검증한 세계 최초의 사례이다. 이는 환자 맞춤형 치료(Precision medicine)의 불모지로 여겨졌던 뇌 질환분야에서도 알츠하이머병 환자의 유전형에 따른 최적의 약물 효능 예측이 가능하게 됨을 의미하며 향후 약물 타겟 발굴에 기여할 것으로 기대된다.
조광현 교수는 “이번에 개발한 시스템생물학 기반 알츠하이머성 치매환자 약물 효능평가 플랫폼을 통해 향후 치매 치료제 개발 경쟁에서 우리나라가 국가적 우위를 선점할 수 있을 것으로 기대한다”고 밝혔다.
이번 연구는 보건복지부 한국보건산업진흥원의 국가치매극복기술개발 사업 및 한국연구재단의 중견연구자지원사업으로 수행됐으며, 연구성과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)의 2021년 1월 12일자 논문으로 게재됐다.
(https://www.nature.com/articles/s41467-020-20440-5)
시스템생물학 이용 세계 최초 알츠하이머성 치매 환자 맞춤형 치료 효능 예측 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀 (장소영 박사과정(제1저자), 강의룡 박사과정, 장홍준 박사과정)은 서울대학교 의과대학 묵인희 교수 연구팀과 공동연구를 통해 시스템생물학*과 알츠하이머 환자 유래 뇌 오가노이드** 모델의 융합으로 환자 맞춤형 약물 효능평가 플랫폼(Drug-screening platform)을 세계 최초로 개발했다고 13일 밝혔다.
* 시스템생물학: IT의 수학모델링 및 컴퓨터시뮬레이션과 BT의 분자세포생물학 실험을 융합하여 복잡한 생명현상을 규명하고 설명하는 연구 패러다임
** 뇌 오가노이드: 환자의 역분화 줄기세포(iPSC) 유래 인공 미니 뇌
알츠하이머병은 치매의 약 70%를 차지하는 대표적 치매 질환이나 현재까지 발병 원인이 불명확하며, 근본적인 치료제도 없는 인류가 극복하지 못한 질병 중 하나다.
알츠하이머병 치료제 개발 난제 중 하나는 실제 살아있는 환자의 뇌를 직접 실험 샘플로 사용할 수 없다는 것이었다. 이는 수많은 치료제 후보군의 약물 효능을 정확히 평가하기가 어려워 치료제 개발의 걸림돌로 작용해왔다.
조광현 교수 공동 연구팀은 실제 치매환자에서 유래한 뇌 오가노이드 기반으로 생물학적 메커니즘에 대한 수학 모델링을 융합하여 약물효능 예측이 가능한 플랫폼을 세계 최초로 개발했다. 환자 혈액으로부터 역분화줄기세포(Induced-pluripotent stem cell)*를 구축 후 이를 이용하여 3D 뇌 오가노이드를 제작해 실제 환자의 뇌와 유사한 환경 구축을 통해 실험적 한계를 극복했다.
* 역분화줄기세포: 다능성이 없는 혈액 면역세포에 역분화를 일으키는 4가지 특정 유전자를 도입하여 배아 줄기세포와 같이 모든 종류의 세포로 분화할 수 있는 성질(다능성)을 가진 줄기세포
또한, 시스템생물학 기반 수학 모델링 기법으로 알츠하이머병의 신경세포 특이적 네트워크망을 구축하고, 이를 실제 알츠하이머병 환자 및 정상군 유래 뇌 오가노이드를 통하여 신경세포 컴퓨터 모델의 실효성을 검증했다.
이 연구결과는 알츠하이머병의 시스템생물학 기반 신경세포 컴퓨터 모델을 실제 환자 유래 뇌 오가노이드로 검증한 세계 최초의 사례이다. 이는 환자 맞춤형 치료(Precision medicine)의 불모지로 여겨졌던 뇌 질환분야에서도 알츠하이머병 환자의 유전형에 따른 최적의 약물 효능 예측이 가능하게 됨을 의미하며 향후 약물 타겟 발굴에 기여할 것으로 기대된다.
조광현 교수는 “이번에 개발한 시스템생물학 기반 알츠하이머성 치매환자 약물 효능평가 플랫폼을 통해 향후 치매 치료제 개발 경쟁에서 우리나라가 국가적 우위를 선점할 수 있을 것으로 기대한다”고 밝혔다.
이번 연구는 보건복지부 한국보건산업진흥원의 국가치매극복기술개발 사업 및 한국연구재단의 중견연구자지원사업으로 수행됐으며, 연구성과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)의 2021년 1월 12일자 논문으로 게재됐다.
(https://www.nature.com/articles/s41467-020-20440-5)
2021.01.13
조회수 76326
-
 우리 뇌가 기억력을 유지하는 메커니즘 밝혀
우리 연구진이 성인의 뇌가 기억력을 유지하는 메커니즘을 밝혔다.
우리 대학 생명과학과 정원석 교수와 이준혁 박사과정 연구팀이 한국뇌연구원의 박형주 박사와 김지영 연구원 연구팀과 공동연구를 통해 이전까지 알려지지 않았던 새로운 뇌 항상성 유지 기전을 처음으로 밝혀 국제학술지 `네이처(Nature)'에 공개했다고 5일 밝혔다.
성인 *해마에서는 학습 및 기억 형성 중에 기존의 시냅스는 사라지고 새로운 *시냅스가 생기는 시냅스 재구성이 일어난다. 그러나 어떻게 시냅스가 사라지고 이러한 시냅스 제거가 학습과 기억 과정 중에 어떠한 역할을 맡는지는 여전히 알려지지 않았다.
☞ 해마(hippocampus): 뇌의 부위 중 하나로 학습, 기억 및 새로운 것의 인식 등의 역할을 한다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
공동연구팀은 중추 신경계에서 다양한 역할을 수행하는 신경교세포 중 가장 숫자가 많은 `별아교세포'가 뇌 발달 시기에 시냅스를 먹어서 없앤다는 정원석 교수의 선행 연구 결과(네이처(Nature), 2013년)에 착안해 연구를 진행하였다. 그 결과, 성체 뇌에서도 별아교세포가 불필요한 시냅스를 끊임없이 제거하고 있음을 발견했으며, 이 현상이 학습 및 기억에 중요한 해마 내 흥분성 시냅스의 회로 유지를 가능하게 한다는 사실을 증명했다.
이전에는 신경교세포의 시냅스 제거 현상을 전자 현미경 또는 시냅스 염색법을 사용해 확인했었다. 그러나 이러한 방법은 신경교세포에 의해 먹힌 시냅스가 세포 내 산성 소화기관에서 급속히 분해되기 때문에 잔여 시냅스를 표시하고 관찰하는 데 한계가 있었다.
이에 연구팀은 시냅스에 산성화 감지가 가능한 형광단백질 조합(mCherry 물질과 eGFP 물질)을 발현시키는 바이러스 기반 시냅스 포식 리포터를 개발했다. 이 형광단백질들은 일반적인 중성 pH 조건에서 원래의 형광 강도를 유지하지만, 세포 속 소화기관 같은 산성 환경에서는 eGFP 물질은 빠르게 분해되어 신호가 사라지고 mCherry 물질은 천천히 분해되어 신호가 유지된다는 특징이 있다. 이러한 원리를 활용해, 연구팀은 mCherry-eGFP를 바이러스를 통해 흥분성 및 억제성 시냅스에 각각 발현시켰고 이후 mCherry-eGFP로 표시된 시냅스들과는 달리 신경교세포에 의해 먹힌 시냅스는 mCherry 물질만의 단독 신호로 관찰됨을 확인했다.
연구팀은 새로 개발한 방법을 이용해, 기존의 방법으로는 관찰할 수 없었던 현상인 별아교세포가 성인 해마에서 시냅스를 지속적으로 제거하며 특히 흥분성 시냅스를 더 많이 제거하고 있음을 발견했다.
놀랍게도 연구팀은 뇌의 면역세포라 불리는 미세아교세포보다 별아교세포가 주도적으로 정상 해마의 흥분성 시냅스를 제거하고 있음을 확인하여 미세아교세포가 시냅스를 제거하는 주된 세포일 것이라는 기존의 학설을 뒤집었다.
미세아교세포를 인위적으로 제거했을 때는 시냅스의 수가 변하지 않았지만, 해마의 별아교세포가 시냅스를 먹지 못하도록 유전자 조작을 했을 때는 비정상적인 시냅스가 과도하게 급증가하고 정상적인 해마 신경 회로의 기능과 기억 형성 능력이 떨어진다는 것을 처음으로 관찰한 것이다.
게다가 연구진은 유전자 변형을 통해 별아교세포의 시냅스 제거 작용을 억제한 생쥐에서는, 해마 내 시냅스 연결 가소성과 기억 형성에 문제가 생김을 발견했다. 이는 불필요한 시냅스들을 별아교세포가 제거하지 않는다면 뇌의 정상적인 학습과 기억 능력이 유지될 수 없다는 것을 의미한다.
연구팀은 이번 연구성과를 통해 별아교세포에 의한 성인 뇌의 흥분성 시냅스 재구성이 정상적 신경 회로망 유지 및 기억 형성에 필수적인 기전이라 제시했다. 이 메커니즘은 향후 뇌 기능 및 관련 신경 회로의 항상성 유지에 관한 다양한 연구들에 활용될 수 있을 것으로 기대되고 있다.
또한 연구팀은 "비정상적인 수준의 시냅스 수 변화는 자폐 스펙트럼 장애, 조현병, 치매 및 여러 형태의 발작과 같은 다양한 신경질환의 유병률과 연관성이 높다ˮ며 "시냅스 수를 다시 정상으로 회복하기 위해 별아교세포가 시냅스를 먹는 현상을 조절하는 것이 이들 뇌 질환을 치료하는 새로운 전략이 될 수 있다ˮ고 말했다.
우리 대학 생명과학과 이준혁 박사과정과 뇌연구원 김지영 연구원이 공동 제1 저자로 참여하고, 정원석 교수와 박형주 박사가 공동 교신저자로 참여한 이번 연구는 뇌인지과학 연구분야에 새로운 돌파구를 마련한 것으로 인정받아 최상위 국제학술지 `네이처(Nature)'에 지난 12월 23일 字 공개됐다. (논문명: Astrocytes phagocytose adult hippocampal synapses for circuit homeostasis)
한편, 이번 연구는 삼성미래기술육성재단, 뇌원천기술개발사업, 한국뇌연구원 기관고유사업 등의 도움을 받아 진행됐다.
우리 뇌가 기억력을 유지하는 메커니즘 밝혀
우리 연구진이 성인의 뇌가 기억력을 유지하는 메커니즘을 밝혔다.
우리 대학 생명과학과 정원석 교수와 이준혁 박사과정 연구팀이 한국뇌연구원의 박형주 박사와 김지영 연구원 연구팀과 공동연구를 통해 이전까지 알려지지 않았던 새로운 뇌 항상성 유지 기전을 처음으로 밝혀 국제학술지 `네이처(Nature)'에 공개했다고 5일 밝혔다.
성인 *해마에서는 학습 및 기억 형성 중에 기존의 시냅스는 사라지고 새로운 *시냅스가 생기는 시냅스 재구성이 일어난다. 그러나 어떻게 시냅스가 사라지고 이러한 시냅스 제거가 학습과 기억 과정 중에 어떠한 역할을 맡는지는 여전히 알려지지 않았다.
☞ 해마(hippocampus): 뇌의 부위 중 하나로 학습, 기억 및 새로운 것의 인식 등의 역할을 한다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
공동연구팀은 중추 신경계에서 다양한 역할을 수행하는 신경교세포 중 가장 숫자가 많은 `별아교세포'가 뇌 발달 시기에 시냅스를 먹어서 없앤다는 정원석 교수의 선행 연구 결과(네이처(Nature), 2013년)에 착안해 연구를 진행하였다. 그 결과, 성체 뇌에서도 별아교세포가 불필요한 시냅스를 끊임없이 제거하고 있음을 발견했으며, 이 현상이 학습 및 기억에 중요한 해마 내 흥분성 시냅스의 회로 유지를 가능하게 한다는 사실을 증명했다.
이전에는 신경교세포의 시냅스 제거 현상을 전자 현미경 또는 시냅스 염색법을 사용해 확인했었다. 그러나 이러한 방법은 신경교세포에 의해 먹힌 시냅스가 세포 내 산성 소화기관에서 급속히 분해되기 때문에 잔여 시냅스를 표시하고 관찰하는 데 한계가 있었다.
이에 연구팀은 시냅스에 산성화 감지가 가능한 형광단백질 조합(mCherry 물질과 eGFP 물질)을 발현시키는 바이러스 기반 시냅스 포식 리포터를 개발했다. 이 형광단백질들은 일반적인 중성 pH 조건에서 원래의 형광 강도를 유지하지만, 세포 속 소화기관 같은 산성 환경에서는 eGFP 물질은 빠르게 분해되어 신호가 사라지고 mCherry 물질은 천천히 분해되어 신호가 유지된다는 특징이 있다. 이러한 원리를 활용해, 연구팀은 mCherry-eGFP를 바이러스를 통해 흥분성 및 억제성 시냅스에 각각 발현시켰고 이후 mCherry-eGFP로 표시된 시냅스들과는 달리 신경교세포에 의해 먹힌 시냅스는 mCherry 물질만의 단독 신호로 관찰됨을 확인했다.
연구팀은 새로 개발한 방법을 이용해, 기존의 방법으로는 관찰할 수 없었던 현상인 별아교세포가 성인 해마에서 시냅스를 지속적으로 제거하며 특히 흥분성 시냅스를 더 많이 제거하고 있음을 발견했다.
놀랍게도 연구팀은 뇌의 면역세포라 불리는 미세아교세포보다 별아교세포가 주도적으로 정상 해마의 흥분성 시냅스를 제거하고 있음을 확인하여 미세아교세포가 시냅스를 제거하는 주된 세포일 것이라는 기존의 학설을 뒤집었다.
미세아교세포를 인위적으로 제거했을 때는 시냅스의 수가 변하지 않았지만, 해마의 별아교세포가 시냅스를 먹지 못하도록 유전자 조작을 했을 때는 비정상적인 시냅스가 과도하게 급증가하고 정상적인 해마 신경 회로의 기능과 기억 형성 능력이 떨어진다는 것을 처음으로 관찰한 것이다.
게다가 연구진은 유전자 변형을 통해 별아교세포의 시냅스 제거 작용을 억제한 생쥐에서는, 해마 내 시냅스 연결 가소성과 기억 형성에 문제가 생김을 발견했다. 이는 불필요한 시냅스들을 별아교세포가 제거하지 않는다면 뇌의 정상적인 학습과 기억 능력이 유지될 수 없다는 것을 의미한다.
연구팀은 이번 연구성과를 통해 별아교세포에 의한 성인 뇌의 흥분성 시냅스 재구성이 정상적 신경 회로망 유지 및 기억 형성에 필수적인 기전이라 제시했다. 이 메커니즘은 향후 뇌 기능 및 관련 신경 회로의 항상성 유지에 관한 다양한 연구들에 활용될 수 있을 것으로 기대되고 있다.
또한 연구팀은 "비정상적인 수준의 시냅스 수 변화는 자폐 스펙트럼 장애, 조현병, 치매 및 여러 형태의 발작과 같은 다양한 신경질환의 유병률과 연관성이 높다ˮ며 "시냅스 수를 다시 정상으로 회복하기 위해 별아교세포가 시냅스를 먹는 현상을 조절하는 것이 이들 뇌 질환을 치료하는 새로운 전략이 될 수 있다ˮ고 말했다.
우리 대학 생명과학과 이준혁 박사과정과 뇌연구원 김지영 연구원이 공동 제1 저자로 참여하고, 정원석 교수와 박형주 박사가 공동 교신저자로 참여한 이번 연구는 뇌인지과학 연구분야에 새로운 돌파구를 마련한 것으로 인정받아 최상위 국제학술지 `네이처(Nature)'에 지난 12월 23일 字 공개됐다. (논문명: Astrocytes phagocytose adult hippocampal synapses for circuit homeostasis)
한편, 이번 연구는 삼성미래기술육성재단, 뇌원천기술개발사업, 한국뇌연구원 기관고유사업 등의 도움을 받아 진행됐다.
2021.01.06
조회수 56140
-
 난치성 악성 위암의 분자병태생리 기전 최초 규명
우리 대학 바이오및뇌공학과 김필남 교수, 최정균 교수 연구팀은 연세대학교 세브란스 병원 정재호 교수 연구팀과 공동연구를 통해 종양 미세환경의 물리적 인자[세포기질의 강성도 증가]가 암세포의 악성화를 촉진하는 분자후성유전학적 원인을 최초로 규명함으로써 향후 새로운 항암치료전략 수립에 중요한 통찰과 방향을 제시했다.
지금까지 종양연구가 대부분 암세포 자체의 돌연변이나 내부 신호전달 경로에 집중되어 진행되었다면 이번 연구는 암세포가 위치한 종양의 미세환경적 요인이 악성화에 어떤 영향을 주는지를 규명해 종양학 연구의 새로운 패러다임을 제공하고 있다. 최근에 암면역치료의 임상적 성공에 힘입어 *종양미세환경의 면역세포에 대한 관심과 연구가 증가하고 있으나 종양미세환경의 물리적 요인이 암세포의 악성화 및 치료반응에 어떤 영향을 주는지에 대한 연구는 거의 없었다.
연구팀은 생체재료를 활용해 인간의 종양미세환경과 유사한 위암실험모델을 개발하고, 이를 이용하여 단단해진 미세환경에 의한 위암세포의 악성화 메커니즘을 규명했다. 암을 유발하는 단백질로 잘 알려진 YAP (Yes-associated protein)의 DNA 가 단단해진 조직내에서 후성유전학적 변화인 DNA 탈메틸화가 유도되어 악성화가 촉진됨을 밝혔다. 이와 더불어, 본 연구팀은 단단하게 변성된 미세환경을 다시 물렁한 조직으로 변화할 경우, 악성화된 위암 세포에서 역전현상이 일어나 악성화가 약화되고 항암제에 반응하는 세포로 변화함을 확인했다.
이번 연구 결과는 치료가 어려운 난치성 *미만형 위암의 악성화를 촉진하는 원인을 규명함으로써 임상적으로 가장 어려운 scirrhous cancer 의 새로운 치료 가능성을 제시하고, 위암 뿐만 아니라 다양한 암종의 유사한 표현형의 암에 대한 치료 확장성에 기여할 것으로 기대한다.
*종양미세환경: 종양내에 존재하는 암세포, 암의 형성 및 진행에 직/간접적으로 영향을 미치는 주변 조직세포 (면역세포, 섬유아세포, 혈관세포 등) 및 이를 구성하고 있는 *세포외기질물질(Extracellular Matrix) 를 총칭해서 종양미세환경이라고 한다.
*세포외기질: 세포와 세포사이를 연결하고 지탱해주는 지지체의 역할을 하는 물질로 콜라겐과 같은 단백질이 이에 속한다. 세포외기질은 단순한 지지체가 아니라, 이것의 물리적, 화학적 특성이 세포의 운명, 특성 등에 직접적으로 영향을 미친다. 특히, 병적요인으로 인해서 조직 섬유화와 같은 변성이 일어나고 이러한 변성이 암과 같은 질병의 악화의 원인이 된다고 알려져 있다.
*미만성 위암: 위암은 조직학적으로 크게 장형암과 미만 위암으로 분류된다. 장형암의 경우 헬리코박터 감염이나 만성 위축성 위염에 속발하는 위암으로 일반적으로 미만성에 비해 양호한 예후를 보인다. 미만성 위암은 장형암에 비해 암 덩어리를 잘 형성하지 않으며 작은 악성 세포들이 위벽에 퍼져서 침윤과 전이를 잘하며 조기 발견도 어렵다. 40세 미만에서 호발하며 악성도가 매우 높아 치료가 어려운 암으로 알려져 있다.
바이오및뇌공학과 장민정 박사가 제1 저자로 참여한 이번 연구는 국제학술지인 `네이처 바이오메디컬엔지니어링’ 12월 7일 字 온라인 판에 실렸다. (논문명: Matrix stiffness epigenetically regulates the oncogenic activation of the Yes-associated protein in gastric cancer)
이번 연구성과는 한국연구재단 과학기술 분야 기초연구사업인 중견연구자지원사업 및 보건복지부 연구중심병원 R&D 사업의 지원을 통해 수행됐다.
난치성 악성 위암의 분자병태생리 기전 최초 규명
우리 대학 바이오및뇌공학과 김필남 교수, 최정균 교수 연구팀은 연세대학교 세브란스 병원 정재호 교수 연구팀과 공동연구를 통해 종양 미세환경의 물리적 인자[세포기질의 강성도 증가]가 암세포의 악성화를 촉진하는 분자후성유전학적 원인을 최초로 규명함으로써 향후 새로운 항암치료전략 수립에 중요한 통찰과 방향을 제시했다.
지금까지 종양연구가 대부분 암세포 자체의 돌연변이나 내부 신호전달 경로에 집중되어 진행되었다면 이번 연구는 암세포가 위치한 종양의 미세환경적 요인이 악성화에 어떤 영향을 주는지를 규명해 종양학 연구의 새로운 패러다임을 제공하고 있다. 최근에 암면역치료의 임상적 성공에 힘입어 *종양미세환경의 면역세포에 대한 관심과 연구가 증가하고 있으나 종양미세환경의 물리적 요인이 암세포의 악성화 및 치료반응에 어떤 영향을 주는지에 대한 연구는 거의 없었다.
연구팀은 생체재료를 활용해 인간의 종양미세환경과 유사한 위암실험모델을 개발하고, 이를 이용하여 단단해진 미세환경에 의한 위암세포의 악성화 메커니즘을 규명했다. 암을 유발하는 단백질로 잘 알려진 YAP (Yes-associated protein)의 DNA 가 단단해진 조직내에서 후성유전학적 변화인 DNA 탈메틸화가 유도되어 악성화가 촉진됨을 밝혔다. 이와 더불어, 본 연구팀은 단단하게 변성된 미세환경을 다시 물렁한 조직으로 변화할 경우, 악성화된 위암 세포에서 역전현상이 일어나 악성화가 약화되고 항암제에 반응하는 세포로 변화함을 확인했다.
이번 연구 결과는 치료가 어려운 난치성 *미만형 위암의 악성화를 촉진하는 원인을 규명함으로써 임상적으로 가장 어려운 scirrhous cancer 의 새로운 치료 가능성을 제시하고, 위암 뿐만 아니라 다양한 암종의 유사한 표현형의 암에 대한 치료 확장성에 기여할 것으로 기대한다.
*종양미세환경: 종양내에 존재하는 암세포, 암의 형성 및 진행에 직/간접적으로 영향을 미치는 주변 조직세포 (면역세포, 섬유아세포, 혈관세포 등) 및 이를 구성하고 있는 *세포외기질물질(Extracellular Matrix) 를 총칭해서 종양미세환경이라고 한다.
*세포외기질: 세포와 세포사이를 연결하고 지탱해주는 지지체의 역할을 하는 물질로 콜라겐과 같은 단백질이 이에 속한다. 세포외기질은 단순한 지지체가 아니라, 이것의 물리적, 화학적 특성이 세포의 운명, 특성 등에 직접적으로 영향을 미친다. 특히, 병적요인으로 인해서 조직 섬유화와 같은 변성이 일어나고 이러한 변성이 암과 같은 질병의 악화의 원인이 된다고 알려져 있다.
*미만성 위암: 위암은 조직학적으로 크게 장형암과 미만 위암으로 분류된다. 장형암의 경우 헬리코박터 감염이나 만성 위축성 위염에 속발하는 위암으로 일반적으로 미만성에 비해 양호한 예후를 보인다. 미만성 위암은 장형암에 비해 암 덩어리를 잘 형성하지 않으며 작은 악성 세포들이 위벽에 퍼져서 침윤과 전이를 잘하며 조기 발견도 어렵다. 40세 미만에서 호발하며 악성도가 매우 높아 치료가 어려운 암으로 알려져 있다.
바이오및뇌공학과 장민정 박사가 제1 저자로 참여한 이번 연구는 국제학술지인 `네이처 바이오메디컬엔지니어링’ 12월 7일 字 온라인 판에 실렸다. (논문명: Matrix stiffness epigenetically regulates the oncogenic activation of the Yes-associated protein in gastric cancer)
이번 연구성과는 한국연구재단 과학기술 분야 기초연구사업인 중견연구자지원사업 및 보건복지부 연구중심병원 R&D 사업의 지원을 통해 수행됐다.
2020.12.10
조회수 45443
-
 노화된 세포를 젊은 세포로 되돌리는 초기 원천기술 개발
우리 연구진이 노화된 세포를 젊은 세포로 되돌리는 역 노화 원천기술을 개발했다. 이를 활용하면 노화 현상을 막고 각종 노인성 질환을 사전 억제할 수 있는 치료제를 개발할 단서를 찾을 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌리는 역 노화의 초기 원천기술을 개발했다고 26일 밝혔다.
조광현 교수팀의 이번 연구 결과는 ㈜아모레퍼시픽 기술연구원과의 산학 공동연구를 통해 최초로 개발된 노화 인공피부 모델에서 이 기술을 적용함으로써 입증하는 데 성공했다.
조 교수팀은 이번 연구를 위해 인간 진피 섬유아세포의 세포노화 신호전달 네트워크의 컴퓨터 모델을 개발한 후 시뮬레이션 분석을 통해 노화된 인간 진피 섬유아세포를 젊은 세포로 되돌리는데 필요한 핵심 인자를 찾아냈다. 이후 노화 인공피부 모델에서 핵심 인자를 조절함으로써 노화된 피부조직에서 감소된 콜라겐의 합성을 증가시키고 재생 능력을 회복시켜 젊은 피부조직의 특성을 보이게 하는 역 노화 기술을 개발했다.
연구팀 관계자는 이러한 역 노화 기술은 노화된 피부 등을 포함한 노화 현상 및 많은 노인성 질환의 발생을 사전에 억제할 수 있도록 근본적인 치료전략을 제시한 것으로 건강 수명을 오랫동안 유지하고 싶은 인류의 꿈을 실현하는데 한 걸음 다가선 결과라고 의미를 부여했다.
바이오및뇌공학과 안수균 박사과정 학생, 강준수 연구원, 이수범 연구원과 ㈜아모레퍼시픽의 바이오사이언스랩이 참여한 이번 연구 결과는 국제저명학술지인 `미국국립과학원회보(PNAS)'에 게재됐다.(논문명: Inhibition of 3-phosphoinositide-dependent protein kinase 1 (PDK1) can revert cellular senescence in human dermal fibroblasts)
현재 널리 연구되고 있는 회춘 전략은 이미 분화된 세포를 역분화시키는 4개의 `OSKM(Oct4, Sox2, Klf4, c-Myc) 야마나카 전사인자'를 일시적으로 발현시켜 후성유전학적 리모델링(epigenetic remodeling)을 일으킴으로써 노화된 세포를 젊은 상태로 되돌리는 부분적 역분화(partial reprogramming) 전략이다.
이 기술은 노화된 세포가 젊은 세포로 되돌아갈 수 있다는 것을 증명했지만 종양의 형성과 암의 진행을 유발하는 부작용이 생긴다. 따라서 이와 같은 부작용을 배제할 수 있는 정교한 제어 전략이 과학 난제로 남아있었다.
조 교수팀은 이러한 난제 해결을 위해 시스템생물학 연구 방법을 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌릴 수 있는 핵심 조절인자를 오래전부터 탐구하기 시작했다. 4년에 걸친 연구 끝에 단백질 합성, 세포의 성장 등을 조절하는 mTOR와 면역 물질 사이토카인의 생성에 관여하는 NF-kB를 동시에 제어하고 있는 상위 조절 인자인 `PDK1(3-phosphoinositide-dependent protein kinase 1)'을 찾아냈다.
연구팀은 PDK1을 억제함으로써 노화된 인간 진피 섬유아세포를 다시 정상적인 젊은 세포로 되돌릴 수 있음을 분자 세포실험 및 노화 인공피부 모델 실험을 통해 입증했다. 연구를 통해 노화된 인간 진피 섬유아세포에서 PDK1을 억제했을 때 세포노화 표지 인자들이 사라지고 주변 환경에 적절하게 반응하는 정상 세포로서 기능을 회복하는 현상을 확인했다.
연구 결과 노화된 인간 진피 섬유아세포에서는 PDK1이 mTOR와 NF-kB를 활성화해 노화와 관련된 분비 표현형(SASP: Senescence Associated Secretary Phenotype)을 유발하고 노화 형질을 유지하는 것과 연관돼 있음을 밝혀냈다. 즉, PDK1을 억제함으로써 다시 원래의 정상적인 젊은 세포 상태로 안전하게 되돌릴 수 있음을 증명한 것이다.
조 교수팀이 연구 과정에서 찾아낸 표적 단백질의 활성을 억제할 수 있는 저분자화합물과 관련된 신약개발과 그리고 전임상실험을 통해 노화된 세포의 정상 세포화라는 연구 결과는 새로운 노인성 질환의 치료 기술과 회춘 기술에 관한 연구를 본 궤도에 올려놓은 초석을 다진 획기적인 연구로 평가받고 있다.
실제 ㈜아모레퍼시픽 기술연구원은 이번 연구 결과로부터 동백추출물에서 PDK1 억제 성분을 추출해 노화된 피부의 주름을 개선하는 화장품을 개발중이다.
조광현 교수는 "그동안 비가역적 생명현상이라고 인식돼왔던 노화를 가역화할 가능성을 보여줬다ˮ라며 "이번 연구는 노화를 가역적 생명현상으로 인식하고 이에 적극적으로 대처해 건강 수명을 연장하는 한편 노인성 질환을 예방할 수 있는 새로운 시대의 서막을 열었다ˮ라고 의미를 부여했다.
이번 연구는 조광현 교수 연구팀의 시스템생물학 기반 가역화 기술 개발의 일환으로 이뤄졌으며, 연구팀은 지난 1월 같은 기술을 적용해 대장암세포를 다시 정상 대장 세포로 되돌리는 연구에 성공한 바 있다.
한편 이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 그랜드챌린지 30 (KC30) 프로젝트 및 아모레퍼시픽 R&D 센터의 지원으로 수행됐다.
노화된 세포를 젊은 세포로 되돌리는 초기 원천기술 개발
우리 연구진이 노화된 세포를 젊은 세포로 되돌리는 역 노화 원천기술을 개발했다. 이를 활용하면 노화 현상을 막고 각종 노인성 질환을 사전 억제할 수 있는 치료제를 개발할 단서를 찾을 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌리는 역 노화의 초기 원천기술을 개발했다고 26일 밝혔다.
조광현 교수팀의 이번 연구 결과는 ㈜아모레퍼시픽 기술연구원과의 산학 공동연구를 통해 최초로 개발된 노화 인공피부 모델에서 이 기술을 적용함으로써 입증하는 데 성공했다.
조 교수팀은 이번 연구를 위해 인간 진피 섬유아세포의 세포노화 신호전달 네트워크의 컴퓨터 모델을 개발한 후 시뮬레이션 분석을 통해 노화된 인간 진피 섬유아세포를 젊은 세포로 되돌리는데 필요한 핵심 인자를 찾아냈다. 이후 노화 인공피부 모델에서 핵심 인자를 조절함으로써 노화된 피부조직에서 감소된 콜라겐의 합성을 증가시키고 재생 능력을 회복시켜 젊은 피부조직의 특성을 보이게 하는 역 노화 기술을 개발했다.
연구팀 관계자는 이러한 역 노화 기술은 노화된 피부 등을 포함한 노화 현상 및 많은 노인성 질환의 발생을 사전에 억제할 수 있도록 근본적인 치료전략을 제시한 것으로 건강 수명을 오랫동안 유지하고 싶은 인류의 꿈을 실현하는데 한 걸음 다가선 결과라고 의미를 부여했다.
바이오및뇌공학과 안수균 박사과정 학생, 강준수 연구원, 이수범 연구원과 ㈜아모레퍼시픽의 바이오사이언스랩이 참여한 이번 연구 결과는 국제저명학술지인 `미국국립과학원회보(PNAS)'에 게재됐다.(논문명: Inhibition of 3-phosphoinositide-dependent protein kinase 1 (PDK1) can revert cellular senescence in human dermal fibroblasts)
현재 널리 연구되고 있는 회춘 전략은 이미 분화된 세포를 역분화시키는 4개의 `OSKM(Oct4, Sox2, Klf4, c-Myc) 야마나카 전사인자'를 일시적으로 발현시켜 후성유전학적 리모델링(epigenetic remodeling)을 일으킴으로써 노화된 세포를 젊은 상태로 되돌리는 부분적 역분화(partial reprogramming) 전략이다.
이 기술은 노화된 세포가 젊은 세포로 되돌아갈 수 있다는 것을 증명했지만 종양의 형성과 암의 진행을 유발하는 부작용이 생긴다. 따라서 이와 같은 부작용을 배제할 수 있는 정교한 제어 전략이 과학 난제로 남아있었다.
조 교수팀은 이러한 난제 해결을 위해 시스템생물학 연구 방법을 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌릴 수 있는 핵심 조절인자를 오래전부터 탐구하기 시작했다. 4년에 걸친 연구 끝에 단백질 합성, 세포의 성장 등을 조절하는 mTOR와 면역 물질 사이토카인의 생성에 관여하는 NF-kB를 동시에 제어하고 있는 상위 조절 인자인 `PDK1(3-phosphoinositide-dependent protein kinase 1)'을 찾아냈다.
연구팀은 PDK1을 억제함으로써 노화된 인간 진피 섬유아세포를 다시 정상적인 젊은 세포로 되돌릴 수 있음을 분자 세포실험 및 노화 인공피부 모델 실험을 통해 입증했다. 연구를 통해 노화된 인간 진피 섬유아세포에서 PDK1을 억제했을 때 세포노화 표지 인자들이 사라지고 주변 환경에 적절하게 반응하는 정상 세포로서 기능을 회복하는 현상을 확인했다.
연구 결과 노화된 인간 진피 섬유아세포에서는 PDK1이 mTOR와 NF-kB를 활성화해 노화와 관련된 분비 표현형(SASP: Senescence Associated Secretary Phenotype)을 유발하고 노화 형질을 유지하는 것과 연관돼 있음을 밝혀냈다. 즉, PDK1을 억제함으로써 다시 원래의 정상적인 젊은 세포 상태로 안전하게 되돌릴 수 있음을 증명한 것이다.
조 교수팀이 연구 과정에서 찾아낸 표적 단백질의 활성을 억제할 수 있는 저분자화합물과 관련된 신약개발과 그리고 전임상실험을 통해 노화된 세포의 정상 세포화라는 연구 결과는 새로운 노인성 질환의 치료 기술과 회춘 기술에 관한 연구를 본 궤도에 올려놓은 초석을 다진 획기적인 연구로 평가받고 있다.
실제 ㈜아모레퍼시픽 기술연구원은 이번 연구 결과로부터 동백추출물에서 PDK1 억제 성분을 추출해 노화된 피부의 주름을 개선하는 화장품을 개발중이다.
조광현 교수는 "그동안 비가역적 생명현상이라고 인식돼왔던 노화를 가역화할 가능성을 보여줬다ˮ라며 "이번 연구는 노화를 가역적 생명현상으로 인식하고 이에 적극적으로 대처해 건강 수명을 연장하는 한편 노인성 질환을 예방할 수 있는 새로운 시대의 서막을 열었다ˮ라고 의미를 부여했다.
이번 연구는 조광현 교수 연구팀의 시스템생물학 기반 가역화 기술 개발의 일환으로 이뤄졌으며, 연구팀은 지난 1월 같은 기술을 적용해 대장암세포를 다시 정상 대장 세포로 되돌리는 연구에 성공한 바 있다.
한편 이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 그랜드챌린지 30 (KC30) 프로젝트 및 아모레퍼시픽 R&D 센터의 지원으로 수행됐다.
2020.11.26
조회수 49363
-
 수학 모델로 불안정한 수면 사이클 원인 밝혀
우리 대학 연구진이 수학적 모델을 이용해 세포질 혼잡을 유발하는 비만과 치매, 노화가 어떻게 불안정한 수면을 유발하는지를 밝히고 해결책을 제시했다.
수리과학과 김재경 교수 연구팀은 수학적 모델을 이용해 세포 내 분자 이동을 방해하는 세포질 혼잡(Cytoplasmic congestion)이 불안정한 일주기 리듬(Circadian rhythms)과 수면 사이클을 유발함을 예측하고, 미국 플로리다 주립대학 이주곤 교수 연구팀과 실험을 통해 검증하는 데 성공했다고 9일 밝혔다.
수리과학과 김대욱 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `미국국립과학원회보(PNAS)' 10월 26일 字 온라인판에 실렸다. (논문명 : Wake-sleep cycles are severely disrupted by diseases affecting cytoplasmic homeostasis)
우리 뇌 속에 있는 생체시계(Circadian clock)는 인간이 24시간 주기에 맞춰 살아갈 수 있도록 행동과 생리 작용을 조절하는 역할을 한다. 생체시계는 밤 9시경이 되면 우리 뇌 속에서 멜라토닌 호르몬의 분비를 유발해 일정 시간에 수면을 취할 수 있도록 하는 등 운동 능력이나 학습 능력에 이르기까지 거의 모든 생리 작용에 관여한다.
2017년 노벨생리의학상을 수상한 마이클 영, 제프리 홀 그리고 마이클 로스바쉬 교수는 *PER 단백질이 매일 일정한 시간에 세포핵 안으로 들어가 PER 유전자의 전사를 일정 시간에 스스로 억제하는 음성피드백 루프를 통해 24시간 주기의 리듬을 만드는 것이 생체시계의 핵심 원리임을 밝혔다.
☞ PER 단백질: 포유류의 일주기 리듬을 통제하는 핵심 생체시계 단백질이다. 세포질에서 번역(translation)된 PER 단백질은 핵 안으로 들어가 자기 자신의 DNA 전사(transcription)를 조절한다. 이로 인해 세포 내 PER 단백질의 농도는 24시간 주기로 변화한다.
하지만 다양한 물질이 존재하는 복잡한 세포 내 환경에서 어떻게 수천 개의 PER 단백질이 핵 안으로 일정한 시간에 들어갈 수 있는지는 오랫동안 생체시계 분야의 난제로 남아있었다. 이는 서울 각지에서 출발한 수천 명의 직원이 혼잡한 도로를 통과해서 매일 같은 시간에 회사에 들어갈 수 있는 방법을 찾는 것과도 같은 문제다.
김 교수 연구팀은 난제 해결을 위해 세포 내 분자의 움직임을 묘사하는 시공간적 확률론적 모형(Spatiotemporal Stochastic model)을 자체 개발했다. 또 이를 이용해 분석한 결과, PER 단백질이 세포핵 주변에서 충분히 응축돼야만 동시에 인산화돼 핵 안으로 함께 들어간다는 사실을 알아냈다.
김 교수는 "인산화 동기화 스위치 덕분에 수천 개의 PER 단백질이 일정한 시간에 함께 핵 안으로 들어가 안정적인 일주기 리듬을 만들어낼 수 있음을 확인했다ˮ고 설명했다.
김 교수팀은 또 PER 단백질의 핵 주변 응축을 방해하는 지방 액포와 같은 물질들이 세포 내에 과도하게 많아져 세포질이 혼잡해지면 인산화 스위치가 작동하지 않아 불안정한 일주기 리듬과 수면 사이클이 유발된다는 사실도 확인했다.
김재경 교수팀의 수리 모델 예측은 미국 플로리다 주립대학 이주곤 교수 팀과 협업을 통해 실험으로 검증하는 한편 한 발짝 더 나가 비만·치매·노화가 세포질 혼잡을 일으킴으로써 수면 사이클의 불안정을 가져오는 핵심 요인임을 규명하는 데도 성공했다. 세포질 혼잡 해소가 수면 질환 치료의 핵심이기 때문에 김 교수팀의 이번 연구는 수면 질환 치료의 새로운 패러다임을 제시했다는 점에서 큰 의미가 있다.
김재경 교수는 "비만과 치매, 그리고 노화가 불안정한 수면을 유발하는 원인을 수학과 생명과학의 융합 연구를 통해 밝힌 연구ˮ라고 소개하면서 "이번 성과를 통해 수면 질환의 새로운 치료법이 개발되기를 기대한다ˮ라고 말했다.
수학 모델로 불안정한 수면 사이클 원인 밝혀
우리 대학 연구진이 수학적 모델을 이용해 세포질 혼잡을 유발하는 비만과 치매, 노화가 어떻게 불안정한 수면을 유발하는지를 밝히고 해결책을 제시했다.
수리과학과 김재경 교수 연구팀은 수학적 모델을 이용해 세포 내 분자 이동을 방해하는 세포질 혼잡(Cytoplasmic congestion)이 불안정한 일주기 리듬(Circadian rhythms)과 수면 사이클을 유발함을 예측하고, 미국 플로리다 주립대학 이주곤 교수 연구팀과 실험을 통해 검증하는 데 성공했다고 9일 밝혔다.
수리과학과 김대욱 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `미국국립과학원회보(PNAS)' 10월 26일 字 온라인판에 실렸다. (논문명 : Wake-sleep cycles are severely disrupted by diseases affecting cytoplasmic homeostasis)
우리 뇌 속에 있는 생체시계(Circadian clock)는 인간이 24시간 주기에 맞춰 살아갈 수 있도록 행동과 생리 작용을 조절하는 역할을 한다. 생체시계는 밤 9시경이 되면 우리 뇌 속에서 멜라토닌 호르몬의 분비를 유발해 일정 시간에 수면을 취할 수 있도록 하는 등 운동 능력이나 학습 능력에 이르기까지 거의 모든 생리 작용에 관여한다.
2017년 노벨생리의학상을 수상한 마이클 영, 제프리 홀 그리고 마이클 로스바쉬 교수는 *PER 단백질이 매일 일정한 시간에 세포핵 안으로 들어가 PER 유전자의 전사를 일정 시간에 스스로 억제하는 음성피드백 루프를 통해 24시간 주기의 리듬을 만드는 것이 생체시계의 핵심 원리임을 밝혔다.
☞ PER 단백질: 포유류의 일주기 리듬을 통제하는 핵심 생체시계 단백질이다. 세포질에서 번역(translation)된 PER 단백질은 핵 안으로 들어가 자기 자신의 DNA 전사(transcription)를 조절한다. 이로 인해 세포 내 PER 단백질의 농도는 24시간 주기로 변화한다.
하지만 다양한 물질이 존재하는 복잡한 세포 내 환경에서 어떻게 수천 개의 PER 단백질이 핵 안으로 일정한 시간에 들어갈 수 있는지는 오랫동안 생체시계 분야의 난제로 남아있었다. 이는 서울 각지에서 출발한 수천 명의 직원이 혼잡한 도로를 통과해서 매일 같은 시간에 회사에 들어갈 수 있는 방법을 찾는 것과도 같은 문제다.
김 교수 연구팀은 난제 해결을 위해 세포 내 분자의 움직임을 묘사하는 시공간적 확률론적 모형(Spatiotemporal Stochastic model)을 자체 개발했다. 또 이를 이용해 분석한 결과, PER 단백질이 세포핵 주변에서 충분히 응축돼야만 동시에 인산화돼 핵 안으로 함께 들어간다는 사실을 알아냈다.
김 교수는 "인산화 동기화 스위치 덕분에 수천 개의 PER 단백질이 일정한 시간에 함께 핵 안으로 들어가 안정적인 일주기 리듬을 만들어낼 수 있음을 확인했다ˮ고 설명했다.
김 교수팀은 또 PER 단백질의 핵 주변 응축을 방해하는 지방 액포와 같은 물질들이 세포 내에 과도하게 많아져 세포질이 혼잡해지면 인산화 스위치가 작동하지 않아 불안정한 일주기 리듬과 수면 사이클이 유발된다는 사실도 확인했다.
김재경 교수팀의 수리 모델 예측은 미국 플로리다 주립대학 이주곤 교수 팀과 협업을 통해 실험으로 검증하는 한편 한 발짝 더 나가 비만·치매·노화가 세포질 혼잡을 일으킴으로써 수면 사이클의 불안정을 가져오는 핵심 요인임을 규명하는 데도 성공했다. 세포질 혼잡 해소가 수면 질환 치료의 핵심이기 때문에 김 교수팀의 이번 연구는 수면 질환 치료의 새로운 패러다임을 제시했다는 점에서 큰 의미가 있다.
김재경 교수는 "비만과 치매, 그리고 노화가 불안정한 수면을 유발하는 원인을 수학과 생명과학의 융합 연구를 통해 밝힌 연구ˮ라고 소개하면서 "이번 성과를 통해 수면 질환의 새로운 치료법이 개발되기를 기대한다ˮ라고 말했다.
2020.11.09
조회수 41430
-
 이흥규 교수 연구팀, 수지상세포 자식작용의 역할 규명
우리 연구진에 의해 세포 항상성을 유지해주는 '자식작용'*의 또 다른 기능이 보고됐다. 의과학대학원 이흥규 교수 연구팀이 T세포*의 항바이러스 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다고 밝혔다.
* 자식작용(自食作用, autophagy) : 세포 내 노폐물 및 손상된 세포 소기관을 제거하여 세포의 항상성을 유지하는 과정이다. 자식작용을 처음 발견한 오스미 요시노리(Ohsumi Yoshinori) 교수가 2016년 노벨 생리의학상을 수상하는 등 세계적으로 활발한 연구가 진행되고 있으며, 최근에는 다양한 병원균을 이기는 면역 반응에서도 중요한 기능을 한다고 보고됐다.
* T세포 : 흉선에서 유래하는 림프구로, 세포의 면역에서 주된 역할을 한다.
수지상세포는 병원균이나 암 항원을 인지해 T세포*의 면역반응을 유도하는 세포이다. 바이러스 항원을 수지상세포가 흡수하고, 자신의 표면에 항원을 제시하여 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용을 통한 세포대사 조절이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항바이러스 효과를 높일 수 있는 원리를 제시했다.
실험결과, 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 해당작용이 증가하고, 이를 통해 T세포 활성화 기능이 높아지고 항바이러스 면역반응이 증가했다.
Atg5가 결손되면 수지상세포의 해당작용이 증가하는데, 이로 인해 MHC 클래스 I 분자가 과발현되고 항원 제시를 통한 T 세포 활성화가 증가한다. 이로 인해 호흡기세포융합바이러스(RSV) 감염 시 항바이러스 면역반응이 더 활성화되어 바이러스가 더 빨리 제거되었다.
이흥규 교수는 "이번 연구를 통해 자식작용이 T세포의 항바이러스 면역반응에 관여하는 기능을 새롭게 규명했다”라고 연구의 의의를 설명하며, “향후 자식작용과 세포 대사를 표적으로하는 항바이러스 치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이번 연구 성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행되었다. 저명한 국제학술지 ‘오토파지(Autophagy)’ 8월 28일 자에 온라인 게재됐다.
수지상세포는 바이러스를 받아들여 이들을 분해해 MHC class I에 항원을 제시하고 CD8+ T세포를 활성화해 항바이러스 면역반응을 유도함. Atg5 유전자 결손 시 해당작용 의존적인 항원 제시 및 사이토카인 분비가 과활성화되어 MHC class I을 통한 CD8+ T세포의 활성이 증가됨. 수지상세포에서 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가되어 바이러스 제거를 촉진시킴.
가. Atg5 유전자 결손 시 정상과 다른 특이한 특징을 갖는 수지상세포가 폐에 유입됨.
나. 수지상 세포 특이적으로 Atg5 결손 시, 항원제시, 해당작용과 대사와 관련된 유전자들이 증가됨.
다. 수지상 세포 특이적으로 Atg5 결손 시, 수지상세포의 해당작용이 증가함.
라. 바이러스 감염 시 항원제시에 중요한 MHC 클래스 I의 발현이 증가함. 반면, 해당작용 억제제(2-DG) 처리 시 발현이 감소함. 즉, MHC 클래스 I의 발현에 해당작용이 중요한 역할을 함.
마. 수지상세포 특이적 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가함.
바. 수지상세포 특이적 Atg5 유전자 결손 시 바이러스의 제거가 더 빠르게 일어남.
이흥규 교수 연구팀, 수지상세포 자식작용의 역할 규명
우리 연구진에 의해 세포 항상성을 유지해주는 '자식작용'*의 또 다른 기능이 보고됐다. 의과학대학원 이흥규 교수 연구팀이 T세포*의 항바이러스 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다고 밝혔다.
* 자식작용(自食作用, autophagy) : 세포 내 노폐물 및 손상된 세포 소기관을 제거하여 세포의 항상성을 유지하는 과정이다. 자식작용을 처음 발견한 오스미 요시노리(Ohsumi Yoshinori) 교수가 2016년 노벨 생리의학상을 수상하는 등 세계적으로 활발한 연구가 진행되고 있으며, 최근에는 다양한 병원균을 이기는 면역 반응에서도 중요한 기능을 한다고 보고됐다.
* T세포 : 흉선에서 유래하는 림프구로, 세포의 면역에서 주된 역할을 한다.
수지상세포는 병원균이나 암 항원을 인지해 T세포*의 면역반응을 유도하는 세포이다. 바이러스 항원을 수지상세포가 흡수하고, 자신의 표면에 항원을 제시하여 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용을 통한 세포대사 조절이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항바이러스 효과를 높일 수 있는 원리를 제시했다.
실험결과, 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 해당작용이 증가하고, 이를 통해 T세포 활성화 기능이 높아지고 항바이러스 면역반응이 증가했다.
Atg5가 결손되면 수지상세포의 해당작용이 증가하는데, 이로 인해 MHC 클래스 I 분자가 과발현되고 항원 제시를 통한 T 세포 활성화가 증가한다. 이로 인해 호흡기세포융합바이러스(RSV) 감염 시 항바이러스 면역반응이 더 활성화되어 바이러스가 더 빨리 제거되었다.
이흥규 교수는 "이번 연구를 통해 자식작용이 T세포의 항바이러스 면역반응에 관여하는 기능을 새롭게 규명했다”라고 연구의 의의를 설명하며, “향후 자식작용과 세포 대사를 표적으로하는 항바이러스 치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이번 연구 성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행되었다. 저명한 국제학술지 ‘오토파지(Autophagy)’ 8월 28일 자에 온라인 게재됐다.
수지상세포는 바이러스를 받아들여 이들을 분해해 MHC class I에 항원을 제시하고 CD8+ T세포를 활성화해 항바이러스 면역반응을 유도함. Atg5 유전자 결손 시 해당작용 의존적인 항원 제시 및 사이토카인 분비가 과활성화되어 MHC class I을 통한 CD8+ T세포의 활성이 증가됨. 수지상세포에서 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가되어 바이러스 제거를 촉진시킴.
가. Atg5 유전자 결손 시 정상과 다른 특이한 특징을 갖는 수지상세포가 폐에 유입됨.
나. 수지상 세포 특이적으로 Atg5 결손 시, 항원제시, 해당작용과 대사와 관련된 유전자들이 증가됨.
다. 수지상 세포 특이적으로 Atg5 결손 시, 수지상세포의 해당작용이 증가함.
라. 바이러스 감염 시 항원제시에 중요한 MHC 클래스 I의 발현이 증가함. 반면, 해당작용 억제제(2-DG) 처리 시 발현이 감소함. 즉, MHC 클래스 I의 발현에 해당작용이 중요한 역할을 함.
마. 수지상세포 특이적 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가함.
바. 수지상세포 특이적 Atg5 유전자 결손 시 바이러스의 제거가 더 빠르게 일어남.
2020.09.11
조회수 29304
-
 코로나19 감염 중증도 결정하는 인자 발견
코로나19로 위중, 중증 상태인 중환자가 6일 0시 기준 163명을 기록했다. 지난달 19일 12명이었던 위중, 중증 환자는 20여일 만에 13배 넘게 늘어났다. 이러한 심각한 상황에서 우리 연구진이 코로나19 중증 환자와 경증 환자를 쉽게 판별할 수 있는 바이오 마커(표시물)를 발견해 중증 코로나19에 대한 치료제 개발에 기대감을 높였다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 *'호중구'와 *'당질코르티코이드'의 연관성을 밝혀 코로나19의 중증도를 결정짓는 인자를 발견했다고 7일 밝혔다.
☞ 호중구(neutrophil) : 혈액의 전체 백혈구 중 50~70%를 차지하는 선천 면역세포로, 세균이나 곰팡이 감염 등에 대응하는 면역세포이다.
☞ 당질코르티코이드(glucocorticoid) : 글루코코르티코이드라고도 하며 콩팥 근처 부신의 부신 겉질에서 생성되는 호르몬으로, 다양한 신체 기능 조절에 관여한다. 특히, 면역반응을 억제하는 호르몬으로도 알려져 있다.
WHO에 의해 세계적 대유행(팬데믹)으로 지정된 코로나바이러스감염증(COVID-19)은 사람마다 증상이 판이하다. 따라서, 환자의 중증도를 예상 및 판별하기 위해서는 확실한 바이오 마커의 활용이 중요하며, 이들을 선별적으로 치료할 수 있는 표적 치료제가 매우 중요하다.
중증 코로나19 환자들은 급성 호흡곤란 증후군의 증상을 보이고 특히 폐 조직의 심한 손상이 관찰된다. 이에 대응해 호중구 등 다양한 면역세포들이 바이러스 감염으로부터 숙주를 보호하기 위해 면역반응을 보이지만 사이토카인 폭풍(과잉 염증반응)처럼 과도한 면역반응으로 오히려 장기를 손상시킬 수도 있다.
이 교수 연구팀은 유전자 발현 옴니버스(GEO)에 공개된 코로나19 감염 경증 및 중증 환자의 기관지 폐포 세척액에 존재하는 단일세포 유전 정보를 분석했다. 그 결과, 그동안 곰팡이나 세균 감염에서만 중요성이 알려졌고 바이러스 감염 시에는 상대적으로 중요성이 알려지지 않았던 호중구의 과활성화로 인해 중증 코로나19가 발생함을 밝혔다.
특히 연구팀은 대식세포 등의 골수 유래 면역세포 내에서 발현하는 CXCL8과 같은 *케모카인에 의해 호중구 유입이 증가함을 밝혔다. 연구팀은 골수에서 유래한 면역세포 내의 당질코르티코이드 수용체 발현에 따라 CXCL8의 생성이 조절받으며, 이것이 결과적으로 호중구의 유입 및 활성도와 연관됨을 밝혔다.
☞ 케모카인(chemokine): 백혈구유주작용, 활성화작용을 하는 염기성헤파린 결합성 저분자 단백질
이 교수는 "이번 연구 결과는 코로나19의 중증도를 결정하는 바이오 마커를 발굴한 것 뿐만 아니라, 덱사메타손 등의 당질코르티코이드 억제제를 활용해 중증도를 개선할 치료제 개발에 단초를 제공할 수 있을 것으로 기대한다"고 밝혔다.
의과학대학원 박장현 석박사통합과정 대학원생이 제1 저자로 참여한 이번 연구는 국제면역학회연합에서 발간하는 면역학 전문 학술지인 '프론티어스 인 이뮤놀로지(Frontiers in Immunology)' 8월 28일 字 온라인판에 게재됐다. (논문명: Re-analysis of Single Cell Transcriptome Reveals That the NR3C1-CXCL8-Neutrophil Axis Determines the Severity of COVID-19)
한편 이번 연구는 과학기술정보통신부의 코리아 바이오 그랜드 챌린지사업, 신약타겟발굴 및 검증사업 및 KAIST 코로나 대응 과학기술 뉴딜사업을 받아 수행됐다.
코로나19 감염 중증도 결정하는 인자 발견
코로나19로 위중, 중증 상태인 중환자가 6일 0시 기준 163명을 기록했다. 지난달 19일 12명이었던 위중, 중증 환자는 20여일 만에 13배 넘게 늘어났다. 이러한 심각한 상황에서 우리 연구진이 코로나19 중증 환자와 경증 환자를 쉽게 판별할 수 있는 바이오 마커(표시물)를 발견해 중증 코로나19에 대한 치료제 개발에 기대감을 높였다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 *'호중구'와 *'당질코르티코이드'의 연관성을 밝혀 코로나19의 중증도를 결정짓는 인자를 발견했다고 7일 밝혔다.
☞ 호중구(neutrophil) : 혈액의 전체 백혈구 중 50~70%를 차지하는 선천 면역세포로, 세균이나 곰팡이 감염 등에 대응하는 면역세포이다.
☞ 당질코르티코이드(glucocorticoid) : 글루코코르티코이드라고도 하며 콩팥 근처 부신의 부신 겉질에서 생성되는 호르몬으로, 다양한 신체 기능 조절에 관여한다. 특히, 면역반응을 억제하는 호르몬으로도 알려져 있다.
WHO에 의해 세계적 대유행(팬데믹)으로 지정된 코로나바이러스감염증(COVID-19)은 사람마다 증상이 판이하다. 따라서, 환자의 중증도를 예상 및 판별하기 위해서는 확실한 바이오 마커의 활용이 중요하며, 이들을 선별적으로 치료할 수 있는 표적 치료제가 매우 중요하다.
중증 코로나19 환자들은 급성 호흡곤란 증후군의 증상을 보이고 특히 폐 조직의 심한 손상이 관찰된다. 이에 대응해 호중구 등 다양한 면역세포들이 바이러스 감염으로부터 숙주를 보호하기 위해 면역반응을 보이지만 사이토카인 폭풍(과잉 염증반응)처럼 과도한 면역반응으로 오히려 장기를 손상시킬 수도 있다.
이 교수 연구팀은 유전자 발현 옴니버스(GEO)에 공개된 코로나19 감염 경증 및 중증 환자의 기관지 폐포 세척액에 존재하는 단일세포 유전 정보를 분석했다. 그 결과, 그동안 곰팡이나 세균 감염에서만 중요성이 알려졌고 바이러스 감염 시에는 상대적으로 중요성이 알려지지 않았던 호중구의 과활성화로 인해 중증 코로나19가 발생함을 밝혔다.
특히 연구팀은 대식세포 등의 골수 유래 면역세포 내에서 발현하는 CXCL8과 같은 *케모카인에 의해 호중구 유입이 증가함을 밝혔다. 연구팀은 골수에서 유래한 면역세포 내의 당질코르티코이드 수용체 발현에 따라 CXCL8의 생성이 조절받으며, 이것이 결과적으로 호중구의 유입 및 활성도와 연관됨을 밝혔다.
☞ 케모카인(chemokine): 백혈구유주작용, 활성화작용을 하는 염기성헤파린 결합성 저분자 단백질
이 교수는 "이번 연구 결과는 코로나19의 중증도를 결정하는 바이오 마커를 발굴한 것 뿐만 아니라, 덱사메타손 등의 당질코르티코이드 억제제를 활용해 중증도를 개선할 치료제 개발에 단초를 제공할 수 있을 것으로 기대한다"고 밝혔다.
의과학대학원 박장현 석박사통합과정 대학원생이 제1 저자로 참여한 이번 연구는 국제면역학회연합에서 발간하는 면역학 전문 학술지인 '프론티어스 인 이뮤놀로지(Frontiers in Immunology)' 8월 28일 字 온라인판에 게재됐다. (논문명: Re-analysis of Single Cell Transcriptome Reveals That the NR3C1-CXCL8-Neutrophil Axis Determines the Severity of COVID-19)
한편 이번 연구는 과학기술정보통신부의 코리아 바이오 그랜드 챌린지사업, 신약타겟발굴 및 검증사업 및 KAIST 코로나 대응 과학기술 뉴딜사업을 받아 수행됐다.
2020.09.07
조회수 30046
-
 중증 코로나19 환자의 사이토카인 폭풍 원인 찾았다
우리 대학 의과학대학원 신의철 교수와 생명과학과 정인경 교수 연구팀이 서울아산병원 김성한 교수·연세대 세브란스병원 최준용·안진영 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 중증 코로나19 환자에서 나타나는 과잉 염증반응을 일으키는 원인을 발견했다.
과잉 염증반응이란 흔히 '사이토카인 폭풍'이라고도 불리는 증상인데 면역 물질인 사이토카인(cytokine)이 과다하게 분비돼 이 물질이 정상 세포를 공격하는 현상이다.
☞ 사이토카인(cytokine): 면역세포로부터 분비되는 단백질 면역조절제로서 자가분비형 신호전달(autocrine signaling), 측분비 신호전달(paracrine signaling), 내분비 신호전달(endocrine signaling) 과정에서 특정 수용체와 결합하여 면역반응에 관여한다. 세포의 증식, 분화, 세포사멸 또는 상처 치료 등에 관여하는 다양한 종류의 사이토카인이 존재하며, 특히 면역과 염증에 관여하는 것이 많다. 세포를 의미하는 접두어인 ‘cyto’와 그리스어로 ‘움직이다’를 의미하는 ‘kinein’으로부터 cytokine이 명명됐다.
☞ 사이토카인 폭풍(cytokine storm): 인체에 바이러스가 침투하였을 때 면역 물질인 사이토카인이 과다하게 분비되어 정상 세포를 공격하는 현상
빠르게 확산하고 있는 코로나19 바이러스는 전 세계적으로 이미 1,300만 명 이상이 감염됐고 이 중 50만 명 이상이 사망했다. 코로나19 바이러스에 감염된 환자들은 경증 질환만을 앓고 자연적으로 회복되는 경우가 많으나, 어떤 환자들은 중증 질환으로 발전해 심한 경우 사망하기도 한다. 흔히 사이토카인 폭풍 때문에 중증 코로나19가 유발된다는 사실이 널리 알려져 있다. 하지만 어떤 이유에서 과잉 염증반응이 일어나는지 구체적인 원인은 아직도 알려지지 않아 중증 코로나19 환자의 치료에 많은 어려움을 겪고 있다.
우리 대학 의과학대학원 이정석 연구원 및 생명과학과 박성완 연구원이 주도한 이번 연구에서 공동연구팀은 중증 및 경증 코로나19 환자로부터 혈액을 얻은 후 면역세포들을 분리하고 단일 세포 유전자발현 분석이라는 최신 연구기법을 적용해 그 특성을 상세히 분석했다. 그 결과, 중증 또는 경증을 막론하고 코로나19 환자의 면역세포에서 염증성 사이토카인의 일종인 종양괴사인자(TNF)와 인터류킨-1(IL-1)이 공통으로 나타나는 현상을 발견했다. 연구팀은 특히 중증과 경증 환자를 비교 분석한 결과, 인터페론이라는 사이토카인 반응이 중증 환자에게서만 특징적으로 강하게 나타남을 확인했다.
☞ 인터페론(interferon): 사이토카인(cytokine)의 일종으로 숙주 세포가 바이러스, 세균, 기생균 등 다양한 병원체에 감염되거나 혹은 암세포 존재 하에서 합성되고 분비되는 당단백질이다. 일반적으로 바이러스에 감염된 세포에서 분비되는 제 1형 인터페론이 많이 알려져 있으며 주변 세포들이 항바이러스 방어 효과를 나타낼 수 있도록 돕는다.
지금까지 인터페론은 항바이러스 작용을 하는 착한(?) 사이토카인으로 알려져 있으나, 공동연구팀은 인터페론 반응이 코로나19 환자에서는 오히려 과도한 염증반응을 촉발하는 원인이 될 수 있다는 사실을 다양한 방법을 통해 이를 증명했다.
삼성미래기술육성재단과 서경배과학재단의 지원을 받아 수행한 공동연구팀의 이번 연구결과는 면역학 분야 국제 학술지인 사이언스 면역학(Science Immunology)誌 7월 10일 字에 게재됐다(논문명: Immunophenotyping of COVID-19 and Influenza Highlights the Role of Type I Interferons in Development of Severe COVID-19).
연구팀은 중증 코로나19 환자의 과잉 염증반응 완화를 위해 현재에는 스테로이드제와 같은 비특이적 항염증 약물이 사용하고 있는데 이번 연구 성과를 계기로 인터페론을 표적으로 하는 새로운 치료방법도 고려할 수 있음을 보여준다며 중증 코로나19 환자 치료에 새로운 패러다임을 제시한 획기적인 연구라고 이 연구에 대한 의미를 부여했다.
관련 학계와 의료계에서도 코로나19의 재확산 등 팬데믹이 지속되는 현 상황에서 KAIST와 대학병원 연구팀이 긴밀한 협력을 통해 코로나19의 면역학적 원리를 밝히고 새로운 치료전략을 제시한 이번 연구를 중개 연구(translational research)의 주요 성과로 높게 평가했다.
공동연구팀은 현재 중증 코로나19 환자의 과잉 염증반응을 완화해 환자 생존율을 높일 수 있는 약물을 시험관 내에서 효율적으로 검색하고 발굴하는 방법을 개발하는 후속연구를 진행중에 있다.
이번 연구를 주도한 이정석 연구원은 내과 전문의로서 의과학대학원 박사과정에 재학 중인데 "중증 코로나19 환자의 의료적 문제를 해결하기 위해 정인경 교수 연구팀과 함께 이번 연구를 긴박하게 시작했는데 서울아산병원과 연세대 세브란스병원·충북대병원의 적극적인 지원에 힘입어 불과 3개월 만에 마칠 수 있게 됐다ˮ고 말했다.
정인경 교수는 "코로나19와 같은 신규 질환의 특성을 신속하게 규명하는데 있어 최신 단일세포 전사체 빅데이터 분석법이 매우 효과적ˮ이었음을 밝혔다.
신의철 교수도 "이번 연구는 코로나19 환자의 면역세포에서 어떤 일이 벌어지는지 상세히 연구함으로써 향후 치료전략을 설계할 수 있는 토대를 마련했다는 점에서 매우 중요하고 의미가 있는 연구ˮ라고 평가했다.
신의철 교수와 정인경 교수는 이와 함께 "중증 코로나19 환자의 생존율을 높일 수 있도록 새로운 면역기전 연구 및 환자 맞춤 항염증 약물 사용에 관한 연구를 지속적으로 수행할 것ˮ이라고 강조했다.
중증 코로나19 환자의 사이토카인 폭풍 원인 찾았다
우리 대학 의과학대학원 신의철 교수와 생명과학과 정인경 교수 연구팀이 서울아산병원 김성한 교수·연세대 세브란스병원 최준용·안진영 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 중증 코로나19 환자에서 나타나는 과잉 염증반응을 일으키는 원인을 발견했다.
과잉 염증반응이란 흔히 '사이토카인 폭풍'이라고도 불리는 증상인데 면역 물질인 사이토카인(cytokine)이 과다하게 분비돼 이 물질이 정상 세포를 공격하는 현상이다.
☞ 사이토카인(cytokine): 면역세포로부터 분비되는 단백질 면역조절제로서 자가분비형 신호전달(autocrine signaling), 측분비 신호전달(paracrine signaling), 내분비 신호전달(endocrine signaling) 과정에서 특정 수용체와 결합하여 면역반응에 관여한다. 세포의 증식, 분화, 세포사멸 또는 상처 치료 등에 관여하는 다양한 종류의 사이토카인이 존재하며, 특히 면역과 염증에 관여하는 것이 많다. 세포를 의미하는 접두어인 ‘cyto’와 그리스어로 ‘움직이다’를 의미하는 ‘kinein’으로부터 cytokine이 명명됐다.
☞ 사이토카인 폭풍(cytokine storm): 인체에 바이러스가 침투하였을 때 면역 물질인 사이토카인이 과다하게 분비되어 정상 세포를 공격하는 현상
빠르게 확산하고 있는 코로나19 바이러스는 전 세계적으로 이미 1,300만 명 이상이 감염됐고 이 중 50만 명 이상이 사망했다. 코로나19 바이러스에 감염된 환자들은 경증 질환만을 앓고 자연적으로 회복되는 경우가 많으나, 어떤 환자들은 중증 질환으로 발전해 심한 경우 사망하기도 한다. 흔히 사이토카인 폭풍 때문에 중증 코로나19가 유발된다는 사실이 널리 알려져 있다. 하지만 어떤 이유에서 과잉 염증반응이 일어나는지 구체적인 원인은 아직도 알려지지 않아 중증 코로나19 환자의 치료에 많은 어려움을 겪고 있다.
우리 대학 의과학대학원 이정석 연구원 및 생명과학과 박성완 연구원이 주도한 이번 연구에서 공동연구팀은 중증 및 경증 코로나19 환자로부터 혈액을 얻은 후 면역세포들을 분리하고 단일 세포 유전자발현 분석이라는 최신 연구기법을 적용해 그 특성을 상세히 분석했다. 그 결과, 중증 또는 경증을 막론하고 코로나19 환자의 면역세포에서 염증성 사이토카인의 일종인 종양괴사인자(TNF)와 인터류킨-1(IL-1)이 공통으로 나타나는 현상을 발견했다. 연구팀은 특히 중증과 경증 환자를 비교 분석한 결과, 인터페론이라는 사이토카인 반응이 중증 환자에게서만 특징적으로 강하게 나타남을 확인했다.
☞ 인터페론(interferon): 사이토카인(cytokine)의 일종으로 숙주 세포가 바이러스, 세균, 기생균 등 다양한 병원체에 감염되거나 혹은 암세포 존재 하에서 합성되고 분비되는 당단백질이다. 일반적으로 바이러스에 감염된 세포에서 분비되는 제 1형 인터페론이 많이 알려져 있으며 주변 세포들이 항바이러스 방어 효과를 나타낼 수 있도록 돕는다.
지금까지 인터페론은 항바이러스 작용을 하는 착한(?) 사이토카인으로 알려져 있으나, 공동연구팀은 인터페론 반응이 코로나19 환자에서는 오히려 과도한 염증반응을 촉발하는 원인이 될 수 있다는 사실을 다양한 방법을 통해 이를 증명했다.
삼성미래기술육성재단과 서경배과학재단의 지원을 받아 수행한 공동연구팀의 이번 연구결과는 면역학 분야 국제 학술지인 사이언스 면역학(Science Immunology)誌 7월 10일 字에 게재됐다(논문명: Immunophenotyping of COVID-19 and Influenza Highlights the Role of Type I Interferons in Development of Severe COVID-19).
연구팀은 중증 코로나19 환자의 과잉 염증반응 완화를 위해 현재에는 스테로이드제와 같은 비특이적 항염증 약물이 사용하고 있는데 이번 연구 성과를 계기로 인터페론을 표적으로 하는 새로운 치료방법도 고려할 수 있음을 보여준다며 중증 코로나19 환자 치료에 새로운 패러다임을 제시한 획기적인 연구라고 이 연구에 대한 의미를 부여했다.
관련 학계와 의료계에서도 코로나19의 재확산 등 팬데믹이 지속되는 현 상황에서 KAIST와 대학병원 연구팀이 긴밀한 협력을 통해 코로나19의 면역학적 원리를 밝히고 새로운 치료전략을 제시한 이번 연구를 중개 연구(translational research)의 주요 성과로 높게 평가했다.
공동연구팀은 현재 중증 코로나19 환자의 과잉 염증반응을 완화해 환자 생존율을 높일 수 있는 약물을 시험관 내에서 효율적으로 검색하고 발굴하는 방법을 개발하는 후속연구를 진행중에 있다.
이번 연구를 주도한 이정석 연구원은 내과 전문의로서 의과학대학원 박사과정에 재학 중인데 "중증 코로나19 환자의 의료적 문제를 해결하기 위해 정인경 교수 연구팀과 함께 이번 연구를 긴박하게 시작했는데 서울아산병원과 연세대 세브란스병원·충북대병원의 적극적인 지원에 힘입어 불과 3개월 만에 마칠 수 있게 됐다ˮ고 말했다.
정인경 교수는 "코로나19와 같은 신규 질환의 특성을 신속하게 규명하는데 있어 최신 단일세포 전사체 빅데이터 분석법이 매우 효과적ˮ이었음을 밝혔다.
신의철 교수도 "이번 연구는 코로나19 환자의 면역세포에서 어떤 일이 벌어지는지 상세히 연구함으로써 향후 치료전략을 설계할 수 있는 토대를 마련했다는 점에서 매우 중요하고 의미가 있는 연구ˮ라고 평가했다.
신의철 교수와 정인경 교수는 이와 함께 "중증 코로나19 환자의 생존율을 높일 수 있도록 새로운 면역기전 연구 및 환자 맞춤 항염증 약물 사용에 관한 연구를 지속적으로 수행할 것ˮ이라고 강조했다.
2020.07.14
조회수 34746
-
 이상엽 특훈교수팀 학생들, 천연물 생산 미생물 개발 전략 총정리
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀 소속 대학원생 4명이 대장균 세포 공장을 개발해 생산된 대표 천연물들의 생합성 경로를 총망라해 최신의 연구 내용과 흐름을 한눈에 파악할 수 있도록 대사 회로를 정리한 `천연물 생산을 위한 대장균에서의 대사공학'을 주제로 논문을 발표했다.
학생들은 이번 논문에서 천연물 생산 대장균 세포 공장 개발을 위한 주요 시스템 대사공학 전략을 `효소 개량'과 `대사흐름 최적화', 그리고 `시스템 접근법' 등 3단계로 정리했으며 각 단계별로 활용이 가능한 최신 도구 및 전략을 대사공학이 나아가야 할 방향과 함께 제시했다.
양동수·박선영·은현민 박사과정과 박예슬 석사과정 학생이 참여한 이번 연구결과는 국제학술지인 셀(Cell)誌가 발행하는 생명공학 분야 권위 리뷰지인 `생명공학의 동향(Trends in Biotechnology)' 7월호(특별호: 대사공학) 표지논문 및 주 논문(Featured Article)으로 1일 게재됐다.
인류 역사에서 천연물은 식품과 의약품 등의 분야에 널리 사용되고 있는데 많은 천연물이 그 자체로 의약 물질로 쓰이거나 새로운 의약 물질 개발의 구조적인 근간이 되고 있다. 고부가가치 천연물에 대한 국제적인 수요와 시장규모는 지속적으로 증가하는 추세인 데 반해 천연자원으로부터 얻을 수 있는 양은 극히 제한적이며 완전한 화학합성은 대체로 효율이 낮고 유기 용매를 다량으로 이용하기 때문에 환경 오염과 인류 건강에 악영향을 초래할 수 있다.
따라서 전 세계적으로 천연물을 친환경적이며 고효율로 생산이 가능한 미생물 세포 공장을 개발하려는 노력이 이뤄지고 있다. 미생물 세포 공장 구축을 위한 핵심전략인 시스템 대사공학은 기존 석유화학산업을 대체할 바이오산업의 핵심이 되는 미생물 균주를 보다 효과적으로 개발하기 위해 KAIST 이상엽 특훈교수가 창시한 연구 분야다.
이상엽 특훈교수 연구팀은 실제 시스템 대사공학 전략을 이용, 천연물·아미노산·생분해성 플라스틱·환경친화적인 플라스틱 원료와 바이오 연료 등을 생산하는 고성능 균주들을 다수 개발한 성과를 거뒀다.
이들 4명의 학생을 지도한 이상엽 특훈교수는 "천연물 생산을 위한 대사공학 연구를 체계적으로 분석, 정리하고 또 향후 전략을 제시했다는 점에서 큰 의미가 있다ˮ면서 "권위가 있는 학술지에 주 논문이자 표지논문으로 게재된 이번 연구를 수행한 학생들이 자랑스럽다ˮ고 말했다.
공동 제1 저자인 양동수·박선영 박사과정 학생도 "고령화가 진행되는 사회에서 헬스케어 산업은 그 중요성이 더욱 대두되고 있다ˮ면서 "인류가 건강한 삶을 지속적으로 영위하기 위해서 필수적인 각종 천연물을 대사공학적으로 생산하는 연구 또한 갈수록 중요해질 것ˮ이라고 강조했다.
한편 이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 `바이오리파이너리를 위한 시스템 대사공학 원천기술개발 과제' 및 노보 노디스크 재단의 지원을 받아 수행됐다.
이상엽 특훈교수팀 학생들, 천연물 생산 미생물 개발 전략 총정리
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀 소속 대학원생 4명이 대장균 세포 공장을 개발해 생산된 대표 천연물들의 생합성 경로를 총망라해 최신의 연구 내용과 흐름을 한눈에 파악할 수 있도록 대사 회로를 정리한 `천연물 생산을 위한 대장균에서의 대사공학'을 주제로 논문을 발표했다.
학생들은 이번 논문에서 천연물 생산 대장균 세포 공장 개발을 위한 주요 시스템 대사공학 전략을 `효소 개량'과 `대사흐름 최적화', 그리고 `시스템 접근법' 등 3단계로 정리했으며 각 단계별로 활용이 가능한 최신 도구 및 전략을 대사공학이 나아가야 할 방향과 함께 제시했다.
양동수·박선영·은현민 박사과정과 박예슬 석사과정 학생이 참여한 이번 연구결과는 국제학술지인 셀(Cell)誌가 발행하는 생명공학 분야 권위 리뷰지인 `생명공학의 동향(Trends in Biotechnology)' 7월호(특별호: 대사공학) 표지논문 및 주 논문(Featured Article)으로 1일 게재됐다.
인류 역사에서 천연물은 식품과 의약품 등의 분야에 널리 사용되고 있는데 많은 천연물이 그 자체로 의약 물질로 쓰이거나 새로운 의약 물질 개발의 구조적인 근간이 되고 있다. 고부가가치 천연물에 대한 국제적인 수요와 시장규모는 지속적으로 증가하는 추세인 데 반해 천연자원으로부터 얻을 수 있는 양은 극히 제한적이며 완전한 화학합성은 대체로 효율이 낮고 유기 용매를 다량으로 이용하기 때문에 환경 오염과 인류 건강에 악영향을 초래할 수 있다.
따라서 전 세계적으로 천연물을 친환경적이며 고효율로 생산이 가능한 미생물 세포 공장을 개발하려는 노력이 이뤄지고 있다. 미생물 세포 공장 구축을 위한 핵심전략인 시스템 대사공학은 기존 석유화학산업을 대체할 바이오산업의 핵심이 되는 미생물 균주를 보다 효과적으로 개발하기 위해 KAIST 이상엽 특훈교수가 창시한 연구 분야다.
이상엽 특훈교수 연구팀은 실제 시스템 대사공학 전략을 이용, 천연물·아미노산·생분해성 플라스틱·환경친화적인 플라스틱 원료와 바이오 연료 등을 생산하는 고성능 균주들을 다수 개발한 성과를 거뒀다.
이들 4명의 학생을 지도한 이상엽 특훈교수는 "천연물 생산을 위한 대사공학 연구를 체계적으로 분석, 정리하고 또 향후 전략을 제시했다는 점에서 큰 의미가 있다ˮ면서 "권위가 있는 학술지에 주 논문이자 표지논문으로 게재된 이번 연구를 수행한 학생들이 자랑스럽다ˮ고 말했다.
공동 제1 저자인 양동수·박선영 박사과정 학생도 "고령화가 진행되는 사회에서 헬스케어 산업은 그 중요성이 더욱 대두되고 있다ˮ면서 "인류가 건강한 삶을 지속적으로 영위하기 위해서 필수적인 각종 천연물을 대사공학적으로 생산하는 연구 또한 갈수록 중요해질 것ˮ이라고 강조했다.
한편 이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 `바이오리파이너리를 위한 시스템 대사공학 원천기술개발 과제' 및 노보 노디스크 재단의 지원을 받아 수행됐다.
2020.07.02
조회수 28715
-
 육종민 교수팀, 살아있는 세포의 전자현미경 관찰 성공
우리 대학 신소재공학과 육종민 교수 연구팀이 경북대학교(총장 김상동) ITA 융합대학원 한영기 교수 연구팀과 공동연구를 통해 살아 있는 세포를 전자현미경을 통해 실시간으로 관찰하는 데 성공했다고 29일 밝혔다.
이번 연구를 통해 살아 있는 다양한 세포의 실시간 분자 단위 관찰이 가능해져, 그동안 관찰하지 못했던 살아 있는 세포의 전이·감염에 관한 전 과정을 규명할 수 있게 돼 신약 개발 등을 더욱 촉진할 수 있을 것으로 기대된다.
신소재공학과 구건모 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `나노 레터스(Nano Letters)' 5월 5일 字 온라인판에 게재됐으며 6월 호 표지논문으로 선정됐다. (논문명: Live-Cell Electron Microscopy Using Graphene Veils)
전 세계적으로 대유행하고 있는 코로나바이러스감염증(COVID-19) 등은 수십~수백 나노미터(nm, 1 나노미터는 100만 분의 1밀리미터) 크기의 바이러스로 인해 일어나는 질병이다. 바이러스의 전이·감염 과정을 분석하고 이에 대처하는 신약 개발을 위해서는 바이러스의 미시적인 행동을 실시간으로 관찰하는 것이 매우 중요하다.
수십~수백 나노미터 크기의 바이러스 등을 비롯해 세포와 세포를 이루는 기관들은 가시광선을 이용하는 일반 광학현미경으로는 관찰이 어려워 해상력이 매우 높은 전자선을 이용하는 전자현미경 기술을 이용한다.
그렇지만 전자현미경 기술은 효율적인 작동을 위해 매우 강력한 진공상태가 필요하며 또 가시광선보다 수천 배 이상 높은 에너지를 가지는 전자를 이용하기 때문에 관찰 시 세포의 구조적인 손상이 불가피하다. 따라서 현재로서는 2017년 노벨화학상을 수상한 기술인 극저온 전자현미경을 통해 고정 작업 및 안정화 작업을 거친 표본만 관찰이 가능하다.
최근 학계에서는 사멸해 고정된 것이 아닌 온전한 상태의 살아 있는 세포등 다양한 생체물질을 전자현미경을 이용해 분자 단위로 관찰 가능한지에 대한 논쟁이 전개되고 있다. 육 교수 연구팀은 지난 2012년 개발한 그래핀 액상 셀 전자현미경 기술을 응용해 전자현미경으로도 살아있는 대장균 세포를 관찰하는데 성공했고, 이를 재배양시킴으로써 전자와 진공에 노출됐음에도 불구하고 대장균 세포가 생존한다는 사실을 밝혀냈다.
육 교수 연구팀이 이번 연구에서 활용한 그래핀은 층상 구조인 흑연에서 분리하는 등의 방법으로 얻어내는 약 0.2 나노미터(nm) 두께의 원자 막이다. 여러 분야에서 차세대 소재로 주목받고 있는 그래핀은 강철보다 200배 강한 강도와 높은 전기 전도성을 가지며, 물질을 투과시키지 않는 성질을 가진다. 육 교수 연구팀은 이러한 그래핀 성질을 이용, 세포 등을 액체와 함께 감싸주면, 고진공의 전자현미경 내부에서 탈수에 의한 세포의 구조변화를 막아줄 수 있음을 밝혀냈다. 뿐만 아니라, 그래핀이 전자빔에 의해 공격성이 높아진 활성 산소들을 분해하는 효과도 지니고 있어 그래핀으로 덮어주지 않은 세포보다 100배 강한 전자에 노출되더라도 세포가 활성을 잃지 않는다는 결과를 확인했다.
육 교수는 "이번 연구 결과는 세포보다 더 작은 단백질이나 DNA의 실시간 전자현미경 관찰로까지 확대될 수 있어, 앞으로 다양한 생명 현상의 기작을 근본적으로 밝힐 수 있을 것이라 기대한다ˮ고 밝혔다.
한편, 이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
육종민 교수팀, 살아있는 세포의 전자현미경 관찰 성공
우리 대학 신소재공학과 육종민 교수 연구팀이 경북대학교(총장 김상동) ITA 융합대학원 한영기 교수 연구팀과 공동연구를 통해 살아 있는 세포를 전자현미경을 통해 실시간으로 관찰하는 데 성공했다고 29일 밝혔다.
이번 연구를 통해 살아 있는 다양한 세포의 실시간 분자 단위 관찰이 가능해져, 그동안 관찰하지 못했던 살아 있는 세포의 전이·감염에 관한 전 과정을 규명할 수 있게 돼 신약 개발 등을 더욱 촉진할 수 있을 것으로 기대된다.
신소재공학과 구건모 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `나노 레터스(Nano Letters)' 5월 5일 字 온라인판에 게재됐으며 6월 호 표지논문으로 선정됐다. (논문명: Live-Cell Electron Microscopy Using Graphene Veils)
전 세계적으로 대유행하고 있는 코로나바이러스감염증(COVID-19) 등은 수십~수백 나노미터(nm, 1 나노미터는 100만 분의 1밀리미터) 크기의 바이러스로 인해 일어나는 질병이다. 바이러스의 전이·감염 과정을 분석하고 이에 대처하는 신약 개발을 위해서는 바이러스의 미시적인 행동을 실시간으로 관찰하는 것이 매우 중요하다.
수십~수백 나노미터 크기의 바이러스 등을 비롯해 세포와 세포를 이루는 기관들은 가시광선을 이용하는 일반 광학현미경으로는 관찰이 어려워 해상력이 매우 높은 전자선을 이용하는 전자현미경 기술을 이용한다.
그렇지만 전자현미경 기술은 효율적인 작동을 위해 매우 강력한 진공상태가 필요하며 또 가시광선보다 수천 배 이상 높은 에너지를 가지는 전자를 이용하기 때문에 관찰 시 세포의 구조적인 손상이 불가피하다. 따라서 현재로서는 2017년 노벨화학상을 수상한 기술인 극저온 전자현미경을 통해 고정 작업 및 안정화 작업을 거친 표본만 관찰이 가능하다.
최근 학계에서는 사멸해 고정된 것이 아닌 온전한 상태의 살아 있는 세포등 다양한 생체물질을 전자현미경을 이용해 분자 단위로 관찰 가능한지에 대한 논쟁이 전개되고 있다. 육 교수 연구팀은 지난 2012년 개발한 그래핀 액상 셀 전자현미경 기술을 응용해 전자현미경으로도 살아있는 대장균 세포를 관찰하는데 성공했고, 이를 재배양시킴으로써 전자와 진공에 노출됐음에도 불구하고 대장균 세포가 생존한다는 사실을 밝혀냈다.
육 교수 연구팀이 이번 연구에서 활용한 그래핀은 층상 구조인 흑연에서 분리하는 등의 방법으로 얻어내는 약 0.2 나노미터(nm) 두께의 원자 막이다. 여러 분야에서 차세대 소재로 주목받고 있는 그래핀은 강철보다 200배 강한 강도와 높은 전기 전도성을 가지며, 물질을 투과시키지 않는 성질을 가진다. 육 교수 연구팀은 이러한 그래핀 성질을 이용, 세포 등을 액체와 함께 감싸주면, 고진공의 전자현미경 내부에서 탈수에 의한 세포의 구조변화를 막아줄 수 있음을 밝혀냈다. 뿐만 아니라, 그래핀이 전자빔에 의해 공격성이 높아진 활성 산소들을 분해하는 효과도 지니고 있어 그래핀으로 덮어주지 않은 세포보다 100배 강한 전자에 노출되더라도 세포가 활성을 잃지 않는다는 결과를 확인했다.
육 교수는 "이번 연구 결과는 세포보다 더 작은 단백질이나 DNA의 실시간 전자현미경 관찰로까지 확대될 수 있어, 앞으로 다양한 생명 현상의 기작을 근본적으로 밝힐 수 있을 것이라 기대한다ˮ고 밝혔다.
한편, 이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
2020.06.29
조회수 22645
-
 항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
2020.06.16
조회수 25644
 무선 충전 가능한 부드러운 뇌 이식 장치 개발
우리 연구진이 무선 충전 가능한 뇌 이식 장치를 개발했다. 이 장치는 이식 후 생체 내에서 장기간에 걸쳐 배터리 교체 없이 스마트폰을 이용해 빛으로 뇌의 신경회로를 정교하게 조절할 수 있다.
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 연세대 의대 김정훈 교수팀과 공동 연구를 통해 뇌 완전 이식형 무선 광유전학 기기를 개발했다고 26일 밝혔다.
이번 개발 기술은 장기간에 걸친 동물 실험이 필요한 뇌 기능 연구뿐 아니라 향후 인체에 적용돼 중독과 같은 정신질환 및 파킨슨병과 같은 퇴행성 뇌 질환 치료에도 적용될 수 있을 것으로 기대된다.
우리 대학 전기및전자공학부 김충연 박사과정, 연세대 의대 구민정 박사과정 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 1월 22일 字에 게재됐다. (논문명 : Soft subdermal implant capable of wireless battery charging and programmable controls for applications in optogenetics)
광유전학은 빛을 이용해 목표로 하는 특정 신경세포만을 선택적으로 정교하게 제어할 수 있다는 점에서, 뇌 기능을 밝히고 각종 뇌 질환을 치료할 해결책으로 뇌과학 및 신경과학 분야에서 주목받고 있다.
기존의 광유전학은 외부기기와 연결된 광섬유를 통해 신경세포에 빛을 전달하는 방법을 사용하고 있는데, 이러한 유선 방식은 동물의 자유로운 움직임을 크게 제한한다는 점에서 복잡한 동물 실험을 구현하는데 제약이 있다. 반면 최근에 개발된 무선 임플란트 기기들은 동물의 행동을 제약하지는 않지만, 주기적인 배터리의 교체가 필요하거나 외부 장비로부터 무선으로 전력을 공급받아야 하므로 독립적이지 못하고 동작이 안정적이지 못하다는 한계가 있다.
연구팀은 배터리의 무선 충전과 디바이스의 무선 제어를 가능하게 만드는 무선 회로를 개발해 마이크로 LED 기반의 탐침과 결합했다. 이를 통해 동물이 자유롭게 움직이는 상태에서도 배터리의 무선 충전이 가능하고, 스마트폰 앱을 통해 광자극을 무선으로 제어할 수 있는 무게 1.4그램(g)의 뇌 완전이식형 기기를 구현했다. 나아가 생체 이식 후 기기에 의해 주변의 조직이 손상되는 것을 방지하고자, 기기를 매우 부드러운 생체적합성 소재로 감싸 생체조직과 같이 부드러운 형태가 되도록 개발했다.
이번 연구를 주도한 정재웅 교수는 "개발된 장치는 체내 이식 상태에서 무선 충전이 가능하므로 배터리 교체를 위한 추가적인 수술 필요 없이 장기간 사용이 가능하다ˮ며 "이 기술은 뇌 이식용 기기뿐 아니라 인공 심박동기, 위 자극기 등 다양한 생체 이식용 기기에 범용적으로 적용될 수 있을 것이다ˮ고 말했다.
연구팀은 이 기기를 LED 탐침이 쥐의 뇌에 삽입된 상태에서 두피 안으로 완전히 이식하고 쥐가 자유롭게 움직이는 상태에서 배터리가 자동으로 무선 충전될 수 있음을 확인했다. 또한 연구팀은 중독성 약물인 코카인에 반복적으로 노출된 쥐의 특정 뇌 부위에 무선으로 빛을 전달해 코카인으로 인한 행동 민감화 발현을 억제함으로써 광유전학이 코카인에 의한 중독 행동 제어에 적용될 수 있음을 보였다.
아울러 공동연구자 연세대 의대 김정훈 교수는 "자유롭게 움직이는 동물을 바라보며, 단지 스마트폰 앱을 구동해 뇌에 빛을 전달하고, 그로 인해 동물의 특정 행동을 제어할 수 있다는 사실이 매우 흥미롭고, 많은 상상력을 자극한다ˮ라고 말했다.
연구팀은 이 기술을 궁극적으로 인체에 적용할 수 있도록 기기를 더욱 소형화하고 MRI 친화적인 디자인으로 발전시키는 확장 연구를 계획하고 있다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 기초연구실 지원사업과 신진연구자지원사업, KAIST 글로벌 특이점 연구사업의 지원을 받아 수행됐다.
2021.01.26 조회수 80678
무선 충전 가능한 부드러운 뇌 이식 장치 개발
우리 연구진이 무선 충전 가능한 뇌 이식 장치를 개발했다. 이 장치는 이식 후 생체 내에서 장기간에 걸쳐 배터리 교체 없이 스마트폰을 이용해 빛으로 뇌의 신경회로를 정교하게 조절할 수 있다.
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 연세대 의대 김정훈 교수팀과 공동 연구를 통해 뇌 완전 이식형 무선 광유전학 기기를 개발했다고 26일 밝혔다.
이번 개발 기술은 장기간에 걸친 동물 실험이 필요한 뇌 기능 연구뿐 아니라 향후 인체에 적용돼 중독과 같은 정신질환 및 파킨슨병과 같은 퇴행성 뇌 질환 치료에도 적용될 수 있을 것으로 기대된다.
우리 대학 전기및전자공학부 김충연 박사과정, 연세대 의대 구민정 박사과정 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 1월 22일 字에 게재됐다. (논문명 : Soft subdermal implant capable of wireless battery charging and programmable controls for applications in optogenetics)
광유전학은 빛을 이용해 목표로 하는 특정 신경세포만을 선택적으로 정교하게 제어할 수 있다는 점에서, 뇌 기능을 밝히고 각종 뇌 질환을 치료할 해결책으로 뇌과학 및 신경과학 분야에서 주목받고 있다.
기존의 광유전학은 외부기기와 연결된 광섬유를 통해 신경세포에 빛을 전달하는 방법을 사용하고 있는데, 이러한 유선 방식은 동물의 자유로운 움직임을 크게 제한한다는 점에서 복잡한 동물 실험을 구현하는데 제약이 있다. 반면 최근에 개발된 무선 임플란트 기기들은 동물의 행동을 제약하지는 않지만, 주기적인 배터리의 교체가 필요하거나 외부 장비로부터 무선으로 전력을 공급받아야 하므로 독립적이지 못하고 동작이 안정적이지 못하다는 한계가 있다.
연구팀은 배터리의 무선 충전과 디바이스의 무선 제어를 가능하게 만드는 무선 회로를 개발해 마이크로 LED 기반의 탐침과 결합했다. 이를 통해 동물이 자유롭게 움직이는 상태에서도 배터리의 무선 충전이 가능하고, 스마트폰 앱을 통해 광자극을 무선으로 제어할 수 있는 무게 1.4그램(g)의 뇌 완전이식형 기기를 구현했다. 나아가 생체 이식 후 기기에 의해 주변의 조직이 손상되는 것을 방지하고자, 기기를 매우 부드러운 생체적합성 소재로 감싸 생체조직과 같이 부드러운 형태가 되도록 개발했다.
이번 연구를 주도한 정재웅 교수는 "개발된 장치는 체내 이식 상태에서 무선 충전이 가능하므로 배터리 교체를 위한 추가적인 수술 필요 없이 장기간 사용이 가능하다ˮ며 "이 기술은 뇌 이식용 기기뿐 아니라 인공 심박동기, 위 자극기 등 다양한 생체 이식용 기기에 범용적으로 적용될 수 있을 것이다ˮ고 말했다.
연구팀은 이 기기를 LED 탐침이 쥐의 뇌에 삽입된 상태에서 두피 안으로 완전히 이식하고 쥐가 자유롭게 움직이는 상태에서 배터리가 자동으로 무선 충전될 수 있음을 확인했다. 또한 연구팀은 중독성 약물인 코카인에 반복적으로 노출된 쥐의 특정 뇌 부위에 무선으로 빛을 전달해 코카인으로 인한 행동 민감화 발현을 억제함으로써 광유전학이 코카인에 의한 중독 행동 제어에 적용될 수 있음을 보였다.
아울러 공동연구자 연세대 의대 김정훈 교수는 "자유롭게 움직이는 동물을 바라보며, 단지 스마트폰 앱을 구동해 뇌에 빛을 전달하고, 그로 인해 동물의 특정 행동을 제어할 수 있다는 사실이 매우 흥미롭고, 많은 상상력을 자극한다ˮ라고 말했다.
연구팀은 이 기술을 궁극적으로 인체에 적용할 수 있도록 기기를 더욱 소형화하고 MRI 친화적인 디자인으로 발전시키는 확장 연구를 계획하고 있다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 기초연구실 지원사업과 신진연구자지원사업, KAIST 글로벌 특이점 연구사업의 지원을 받아 수행됐다.
2021.01.26 조회수 80678 시스템생물학 이용 세계 최초 알츠하이머성 치매 환자 맞춤형 치료 효능 예측 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀 (장소영 박사과정(제1저자), 강의룡 박사과정, 장홍준 박사과정)은 서울대학교 의과대학 묵인희 교수 연구팀과 공동연구를 통해 시스템생물학*과 알츠하이머 환자 유래 뇌 오가노이드** 모델의 융합으로 환자 맞춤형 약물 효능평가 플랫폼(Drug-screening platform)을 세계 최초로 개발했다고 13일 밝혔다.
* 시스템생물학: IT의 수학모델링 및 컴퓨터시뮬레이션과 BT의 분자세포생물학 실험을 융합하여 복잡한 생명현상을 규명하고 설명하는 연구 패러다임
** 뇌 오가노이드: 환자의 역분화 줄기세포(iPSC) 유래 인공 미니 뇌
알츠하이머병은 치매의 약 70%를 차지하는 대표적 치매 질환이나 현재까지 발병 원인이 불명확하며, 근본적인 치료제도 없는 인류가 극복하지 못한 질병 중 하나다.
알츠하이머병 치료제 개발 난제 중 하나는 실제 살아있는 환자의 뇌를 직접 실험 샘플로 사용할 수 없다는 것이었다. 이는 수많은 치료제 후보군의 약물 효능을 정확히 평가하기가 어려워 치료제 개발의 걸림돌로 작용해왔다.
조광현 교수 공동 연구팀은 실제 치매환자에서 유래한 뇌 오가노이드 기반으로 생물학적 메커니즘에 대한 수학 모델링을 융합하여 약물효능 예측이 가능한 플랫폼을 세계 최초로 개발했다. 환자 혈액으로부터 역분화줄기세포(Induced-pluripotent stem cell)*를 구축 후 이를 이용하여 3D 뇌 오가노이드를 제작해 실제 환자의 뇌와 유사한 환경 구축을 통해 실험적 한계를 극복했다.
* 역분화줄기세포: 다능성이 없는 혈액 면역세포에 역분화를 일으키는 4가지 특정 유전자를 도입하여 배아 줄기세포와 같이 모든 종류의 세포로 분화할 수 있는 성질(다능성)을 가진 줄기세포
또한, 시스템생물학 기반 수학 모델링 기법으로 알츠하이머병의 신경세포 특이적 네트워크망을 구축하고, 이를 실제 알츠하이머병 환자 및 정상군 유래 뇌 오가노이드를 통하여 신경세포 컴퓨터 모델의 실효성을 검증했다.
이 연구결과는 알츠하이머병의 시스템생물학 기반 신경세포 컴퓨터 모델을 실제 환자 유래 뇌 오가노이드로 검증한 세계 최초의 사례이다. 이는 환자 맞춤형 치료(Precision medicine)의 불모지로 여겨졌던 뇌 질환분야에서도 알츠하이머병 환자의 유전형에 따른 최적의 약물 효능 예측이 가능하게 됨을 의미하며 향후 약물 타겟 발굴에 기여할 것으로 기대된다.
조광현 교수는 “이번에 개발한 시스템생물학 기반 알츠하이머성 치매환자 약물 효능평가 플랫폼을 통해 향후 치매 치료제 개발 경쟁에서 우리나라가 국가적 우위를 선점할 수 있을 것으로 기대한다”고 밝혔다.
이번 연구는 보건복지부 한국보건산업진흥원의 국가치매극복기술개발 사업 및 한국연구재단의 중견연구자지원사업으로 수행됐으며, 연구성과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)의 2021년 1월 12일자 논문으로 게재됐다.
(https://www.nature.com/articles/s41467-020-20440-5)
2021.01.13 조회수 76326
시스템생물학 이용 세계 최초 알츠하이머성 치매 환자 맞춤형 치료 효능 예측 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀 (장소영 박사과정(제1저자), 강의룡 박사과정, 장홍준 박사과정)은 서울대학교 의과대학 묵인희 교수 연구팀과 공동연구를 통해 시스템생물학*과 알츠하이머 환자 유래 뇌 오가노이드** 모델의 융합으로 환자 맞춤형 약물 효능평가 플랫폼(Drug-screening platform)을 세계 최초로 개발했다고 13일 밝혔다.
* 시스템생물학: IT의 수학모델링 및 컴퓨터시뮬레이션과 BT의 분자세포생물학 실험을 융합하여 복잡한 생명현상을 규명하고 설명하는 연구 패러다임
** 뇌 오가노이드: 환자의 역분화 줄기세포(iPSC) 유래 인공 미니 뇌
알츠하이머병은 치매의 약 70%를 차지하는 대표적 치매 질환이나 현재까지 발병 원인이 불명확하며, 근본적인 치료제도 없는 인류가 극복하지 못한 질병 중 하나다.
알츠하이머병 치료제 개발 난제 중 하나는 실제 살아있는 환자의 뇌를 직접 실험 샘플로 사용할 수 없다는 것이었다. 이는 수많은 치료제 후보군의 약물 효능을 정확히 평가하기가 어려워 치료제 개발의 걸림돌로 작용해왔다.
조광현 교수 공동 연구팀은 실제 치매환자에서 유래한 뇌 오가노이드 기반으로 생물학적 메커니즘에 대한 수학 모델링을 융합하여 약물효능 예측이 가능한 플랫폼을 세계 최초로 개발했다. 환자 혈액으로부터 역분화줄기세포(Induced-pluripotent stem cell)*를 구축 후 이를 이용하여 3D 뇌 오가노이드를 제작해 실제 환자의 뇌와 유사한 환경 구축을 통해 실험적 한계를 극복했다.
* 역분화줄기세포: 다능성이 없는 혈액 면역세포에 역분화를 일으키는 4가지 특정 유전자를 도입하여 배아 줄기세포와 같이 모든 종류의 세포로 분화할 수 있는 성질(다능성)을 가진 줄기세포
또한, 시스템생물학 기반 수학 모델링 기법으로 알츠하이머병의 신경세포 특이적 네트워크망을 구축하고, 이를 실제 알츠하이머병 환자 및 정상군 유래 뇌 오가노이드를 통하여 신경세포 컴퓨터 모델의 실효성을 검증했다.
이 연구결과는 알츠하이머병의 시스템생물학 기반 신경세포 컴퓨터 모델을 실제 환자 유래 뇌 오가노이드로 검증한 세계 최초의 사례이다. 이는 환자 맞춤형 치료(Precision medicine)의 불모지로 여겨졌던 뇌 질환분야에서도 알츠하이머병 환자의 유전형에 따른 최적의 약물 효능 예측이 가능하게 됨을 의미하며 향후 약물 타겟 발굴에 기여할 것으로 기대된다.
조광현 교수는 “이번에 개발한 시스템생물학 기반 알츠하이머성 치매환자 약물 효능평가 플랫폼을 통해 향후 치매 치료제 개발 경쟁에서 우리나라가 국가적 우위를 선점할 수 있을 것으로 기대한다”고 밝혔다.
이번 연구는 보건복지부 한국보건산업진흥원의 국가치매극복기술개발 사업 및 한국연구재단의 중견연구자지원사업으로 수행됐으며, 연구성과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)의 2021년 1월 12일자 논문으로 게재됐다.
(https://www.nature.com/articles/s41467-020-20440-5)
2021.01.13 조회수 76326 우리 뇌가 기억력을 유지하는 메커니즘 밝혀
우리 연구진이 성인의 뇌가 기억력을 유지하는 메커니즘을 밝혔다.
우리 대학 생명과학과 정원석 교수와 이준혁 박사과정 연구팀이 한국뇌연구원의 박형주 박사와 김지영 연구원 연구팀과 공동연구를 통해 이전까지 알려지지 않았던 새로운 뇌 항상성 유지 기전을 처음으로 밝혀 국제학술지 `네이처(Nature)'에 공개했다고 5일 밝혔다.
성인 *해마에서는 학습 및 기억 형성 중에 기존의 시냅스는 사라지고 새로운 *시냅스가 생기는 시냅스 재구성이 일어난다. 그러나 어떻게 시냅스가 사라지고 이러한 시냅스 제거가 학습과 기억 과정 중에 어떠한 역할을 맡는지는 여전히 알려지지 않았다.
☞ 해마(hippocampus): 뇌의 부위 중 하나로 학습, 기억 및 새로운 것의 인식 등의 역할을 한다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
공동연구팀은 중추 신경계에서 다양한 역할을 수행하는 신경교세포 중 가장 숫자가 많은 `별아교세포'가 뇌 발달 시기에 시냅스를 먹어서 없앤다는 정원석 교수의 선행 연구 결과(네이처(Nature), 2013년)에 착안해 연구를 진행하였다. 그 결과, 성체 뇌에서도 별아교세포가 불필요한 시냅스를 끊임없이 제거하고 있음을 발견했으며, 이 현상이 학습 및 기억에 중요한 해마 내 흥분성 시냅스의 회로 유지를 가능하게 한다는 사실을 증명했다.
이전에는 신경교세포의 시냅스 제거 현상을 전자 현미경 또는 시냅스 염색법을 사용해 확인했었다. 그러나 이러한 방법은 신경교세포에 의해 먹힌 시냅스가 세포 내 산성 소화기관에서 급속히 분해되기 때문에 잔여 시냅스를 표시하고 관찰하는 데 한계가 있었다.
이에 연구팀은 시냅스에 산성화 감지가 가능한 형광단백질 조합(mCherry 물질과 eGFP 물질)을 발현시키는 바이러스 기반 시냅스 포식 리포터를 개발했다. 이 형광단백질들은 일반적인 중성 pH 조건에서 원래의 형광 강도를 유지하지만, 세포 속 소화기관 같은 산성 환경에서는 eGFP 물질은 빠르게 분해되어 신호가 사라지고 mCherry 물질은 천천히 분해되어 신호가 유지된다는 특징이 있다. 이러한 원리를 활용해, 연구팀은 mCherry-eGFP를 바이러스를 통해 흥분성 및 억제성 시냅스에 각각 발현시켰고 이후 mCherry-eGFP로 표시된 시냅스들과는 달리 신경교세포에 의해 먹힌 시냅스는 mCherry 물질만의 단독 신호로 관찰됨을 확인했다.
연구팀은 새로 개발한 방법을 이용해, 기존의 방법으로는 관찰할 수 없었던 현상인 별아교세포가 성인 해마에서 시냅스를 지속적으로 제거하며 특히 흥분성 시냅스를 더 많이 제거하고 있음을 발견했다.
놀랍게도 연구팀은 뇌의 면역세포라 불리는 미세아교세포보다 별아교세포가 주도적으로 정상 해마의 흥분성 시냅스를 제거하고 있음을 확인하여 미세아교세포가 시냅스를 제거하는 주된 세포일 것이라는 기존의 학설을 뒤집었다.
미세아교세포를 인위적으로 제거했을 때는 시냅스의 수가 변하지 않았지만, 해마의 별아교세포가 시냅스를 먹지 못하도록 유전자 조작을 했을 때는 비정상적인 시냅스가 과도하게 급증가하고 정상적인 해마 신경 회로의 기능과 기억 형성 능력이 떨어진다는 것을 처음으로 관찰한 것이다.
게다가 연구진은 유전자 변형을 통해 별아교세포의 시냅스 제거 작용을 억제한 생쥐에서는, 해마 내 시냅스 연결 가소성과 기억 형성에 문제가 생김을 발견했다. 이는 불필요한 시냅스들을 별아교세포가 제거하지 않는다면 뇌의 정상적인 학습과 기억 능력이 유지될 수 없다는 것을 의미한다.
연구팀은 이번 연구성과를 통해 별아교세포에 의한 성인 뇌의 흥분성 시냅스 재구성이 정상적 신경 회로망 유지 및 기억 형성에 필수적인 기전이라 제시했다. 이 메커니즘은 향후 뇌 기능 및 관련 신경 회로의 항상성 유지에 관한 다양한 연구들에 활용될 수 있을 것으로 기대되고 있다.
또한 연구팀은 "비정상적인 수준의 시냅스 수 변화는 자폐 스펙트럼 장애, 조현병, 치매 및 여러 형태의 발작과 같은 다양한 신경질환의 유병률과 연관성이 높다ˮ며 "시냅스 수를 다시 정상으로 회복하기 위해 별아교세포가 시냅스를 먹는 현상을 조절하는 것이 이들 뇌 질환을 치료하는 새로운 전략이 될 수 있다ˮ고 말했다.
우리 대학 생명과학과 이준혁 박사과정과 뇌연구원 김지영 연구원이 공동 제1 저자로 참여하고, 정원석 교수와 박형주 박사가 공동 교신저자로 참여한 이번 연구는 뇌인지과학 연구분야에 새로운 돌파구를 마련한 것으로 인정받아 최상위 국제학술지 `네이처(Nature)'에 지난 12월 23일 字 공개됐다. (논문명: Astrocytes phagocytose adult hippocampal synapses for circuit homeostasis)
한편, 이번 연구는 삼성미래기술육성재단, 뇌원천기술개발사업, 한국뇌연구원 기관고유사업 등의 도움을 받아 진행됐다.
2021.01.06 조회수 56140
우리 뇌가 기억력을 유지하는 메커니즘 밝혀
우리 연구진이 성인의 뇌가 기억력을 유지하는 메커니즘을 밝혔다.
우리 대학 생명과학과 정원석 교수와 이준혁 박사과정 연구팀이 한국뇌연구원의 박형주 박사와 김지영 연구원 연구팀과 공동연구를 통해 이전까지 알려지지 않았던 새로운 뇌 항상성 유지 기전을 처음으로 밝혀 국제학술지 `네이처(Nature)'에 공개했다고 5일 밝혔다.
성인 *해마에서는 학습 및 기억 형성 중에 기존의 시냅스는 사라지고 새로운 *시냅스가 생기는 시냅스 재구성이 일어난다. 그러나 어떻게 시냅스가 사라지고 이러한 시냅스 제거가 학습과 기억 과정 중에 어떠한 역할을 맡는지는 여전히 알려지지 않았다.
☞ 해마(hippocampus): 뇌의 부위 중 하나로 학습, 기억 및 새로운 것의 인식 등의 역할을 한다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
공동연구팀은 중추 신경계에서 다양한 역할을 수행하는 신경교세포 중 가장 숫자가 많은 `별아교세포'가 뇌 발달 시기에 시냅스를 먹어서 없앤다는 정원석 교수의 선행 연구 결과(네이처(Nature), 2013년)에 착안해 연구를 진행하였다. 그 결과, 성체 뇌에서도 별아교세포가 불필요한 시냅스를 끊임없이 제거하고 있음을 발견했으며, 이 현상이 학습 및 기억에 중요한 해마 내 흥분성 시냅스의 회로 유지를 가능하게 한다는 사실을 증명했다.
이전에는 신경교세포의 시냅스 제거 현상을 전자 현미경 또는 시냅스 염색법을 사용해 확인했었다. 그러나 이러한 방법은 신경교세포에 의해 먹힌 시냅스가 세포 내 산성 소화기관에서 급속히 분해되기 때문에 잔여 시냅스를 표시하고 관찰하는 데 한계가 있었다.
이에 연구팀은 시냅스에 산성화 감지가 가능한 형광단백질 조합(mCherry 물질과 eGFP 물질)을 발현시키는 바이러스 기반 시냅스 포식 리포터를 개발했다. 이 형광단백질들은 일반적인 중성 pH 조건에서 원래의 형광 강도를 유지하지만, 세포 속 소화기관 같은 산성 환경에서는 eGFP 물질은 빠르게 분해되어 신호가 사라지고 mCherry 물질은 천천히 분해되어 신호가 유지된다는 특징이 있다. 이러한 원리를 활용해, 연구팀은 mCherry-eGFP를 바이러스를 통해 흥분성 및 억제성 시냅스에 각각 발현시켰고 이후 mCherry-eGFP로 표시된 시냅스들과는 달리 신경교세포에 의해 먹힌 시냅스는 mCherry 물질만의 단독 신호로 관찰됨을 확인했다.
연구팀은 새로 개발한 방법을 이용해, 기존의 방법으로는 관찰할 수 없었던 현상인 별아교세포가 성인 해마에서 시냅스를 지속적으로 제거하며 특히 흥분성 시냅스를 더 많이 제거하고 있음을 발견했다.
놀랍게도 연구팀은 뇌의 면역세포라 불리는 미세아교세포보다 별아교세포가 주도적으로 정상 해마의 흥분성 시냅스를 제거하고 있음을 확인하여 미세아교세포가 시냅스를 제거하는 주된 세포일 것이라는 기존의 학설을 뒤집었다.
미세아교세포를 인위적으로 제거했을 때는 시냅스의 수가 변하지 않았지만, 해마의 별아교세포가 시냅스를 먹지 못하도록 유전자 조작을 했을 때는 비정상적인 시냅스가 과도하게 급증가하고 정상적인 해마 신경 회로의 기능과 기억 형성 능력이 떨어진다는 것을 처음으로 관찰한 것이다.
게다가 연구진은 유전자 변형을 통해 별아교세포의 시냅스 제거 작용을 억제한 생쥐에서는, 해마 내 시냅스 연결 가소성과 기억 형성에 문제가 생김을 발견했다. 이는 불필요한 시냅스들을 별아교세포가 제거하지 않는다면 뇌의 정상적인 학습과 기억 능력이 유지될 수 없다는 것을 의미한다.
연구팀은 이번 연구성과를 통해 별아교세포에 의한 성인 뇌의 흥분성 시냅스 재구성이 정상적 신경 회로망 유지 및 기억 형성에 필수적인 기전이라 제시했다. 이 메커니즘은 향후 뇌 기능 및 관련 신경 회로의 항상성 유지에 관한 다양한 연구들에 활용될 수 있을 것으로 기대되고 있다.
또한 연구팀은 "비정상적인 수준의 시냅스 수 변화는 자폐 스펙트럼 장애, 조현병, 치매 및 여러 형태의 발작과 같은 다양한 신경질환의 유병률과 연관성이 높다ˮ며 "시냅스 수를 다시 정상으로 회복하기 위해 별아교세포가 시냅스를 먹는 현상을 조절하는 것이 이들 뇌 질환을 치료하는 새로운 전략이 될 수 있다ˮ고 말했다.
우리 대학 생명과학과 이준혁 박사과정과 뇌연구원 김지영 연구원이 공동 제1 저자로 참여하고, 정원석 교수와 박형주 박사가 공동 교신저자로 참여한 이번 연구는 뇌인지과학 연구분야에 새로운 돌파구를 마련한 것으로 인정받아 최상위 국제학술지 `네이처(Nature)'에 지난 12월 23일 字 공개됐다. (논문명: Astrocytes phagocytose adult hippocampal synapses for circuit homeostasis)
한편, 이번 연구는 삼성미래기술육성재단, 뇌원천기술개발사업, 한국뇌연구원 기관고유사업 등의 도움을 받아 진행됐다.
2021.01.06 조회수 56140 난치성 악성 위암의 분자병태생리 기전 최초 규명
우리 대학 바이오및뇌공학과 김필남 교수, 최정균 교수 연구팀은 연세대학교 세브란스 병원 정재호 교수 연구팀과 공동연구를 통해 종양 미세환경의 물리적 인자[세포기질의 강성도 증가]가 암세포의 악성화를 촉진하는 분자후성유전학적 원인을 최초로 규명함으로써 향후 새로운 항암치료전략 수립에 중요한 통찰과 방향을 제시했다.
지금까지 종양연구가 대부분 암세포 자체의 돌연변이나 내부 신호전달 경로에 집중되어 진행되었다면 이번 연구는 암세포가 위치한 종양의 미세환경적 요인이 악성화에 어떤 영향을 주는지를 규명해 종양학 연구의 새로운 패러다임을 제공하고 있다. 최근에 암면역치료의 임상적 성공에 힘입어 *종양미세환경의 면역세포에 대한 관심과 연구가 증가하고 있으나 종양미세환경의 물리적 요인이 암세포의 악성화 및 치료반응에 어떤 영향을 주는지에 대한 연구는 거의 없었다.
연구팀은 생체재료를 활용해 인간의 종양미세환경과 유사한 위암실험모델을 개발하고, 이를 이용하여 단단해진 미세환경에 의한 위암세포의 악성화 메커니즘을 규명했다. 암을 유발하는 단백질로 잘 알려진 YAP (Yes-associated protein)의 DNA 가 단단해진 조직내에서 후성유전학적 변화인 DNA 탈메틸화가 유도되어 악성화가 촉진됨을 밝혔다. 이와 더불어, 본 연구팀은 단단하게 변성된 미세환경을 다시 물렁한 조직으로 변화할 경우, 악성화된 위암 세포에서 역전현상이 일어나 악성화가 약화되고 항암제에 반응하는 세포로 변화함을 확인했다.
이번 연구 결과는 치료가 어려운 난치성 *미만형 위암의 악성화를 촉진하는 원인을 규명함으로써 임상적으로 가장 어려운 scirrhous cancer 의 새로운 치료 가능성을 제시하고, 위암 뿐만 아니라 다양한 암종의 유사한 표현형의 암에 대한 치료 확장성에 기여할 것으로 기대한다.
*종양미세환경: 종양내에 존재하는 암세포, 암의 형성 및 진행에 직/간접적으로 영향을 미치는 주변 조직세포 (면역세포, 섬유아세포, 혈관세포 등) 및 이를 구성하고 있는 *세포외기질물질(Extracellular Matrix) 를 총칭해서 종양미세환경이라고 한다.
*세포외기질: 세포와 세포사이를 연결하고 지탱해주는 지지체의 역할을 하는 물질로 콜라겐과 같은 단백질이 이에 속한다. 세포외기질은 단순한 지지체가 아니라, 이것의 물리적, 화학적 특성이 세포의 운명, 특성 등에 직접적으로 영향을 미친다. 특히, 병적요인으로 인해서 조직 섬유화와 같은 변성이 일어나고 이러한 변성이 암과 같은 질병의 악화의 원인이 된다고 알려져 있다.
*미만성 위암: 위암은 조직학적으로 크게 장형암과 미만 위암으로 분류된다. 장형암의 경우 헬리코박터 감염이나 만성 위축성 위염에 속발하는 위암으로 일반적으로 미만성에 비해 양호한 예후를 보인다. 미만성 위암은 장형암에 비해 암 덩어리를 잘 형성하지 않으며 작은 악성 세포들이 위벽에 퍼져서 침윤과 전이를 잘하며 조기 발견도 어렵다. 40세 미만에서 호발하며 악성도가 매우 높아 치료가 어려운 암으로 알려져 있다.
바이오및뇌공학과 장민정 박사가 제1 저자로 참여한 이번 연구는 국제학술지인 `네이처 바이오메디컬엔지니어링’ 12월 7일 字 온라인 판에 실렸다. (논문명: Matrix stiffness epigenetically regulates the oncogenic activation of the Yes-associated protein in gastric cancer)
이번 연구성과는 한국연구재단 과학기술 분야 기초연구사업인 중견연구자지원사업 및 보건복지부 연구중심병원 R&D 사업의 지원을 통해 수행됐다.
2020.12.10 조회수 45443
난치성 악성 위암의 분자병태생리 기전 최초 규명
우리 대학 바이오및뇌공학과 김필남 교수, 최정균 교수 연구팀은 연세대학교 세브란스 병원 정재호 교수 연구팀과 공동연구를 통해 종양 미세환경의 물리적 인자[세포기질의 강성도 증가]가 암세포의 악성화를 촉진하는 분자후성유전학적 원인을 최초로 규명함으로써 향후 새로운 항암치료전략 수립에 중요한 통찰과 방향을 제시했다.
지금까지 종양연구가 대부분 암세포 자체의 돌연변이나 내부 신호전달 경로에 집중되어 진행되었다면 이번 연구는 암세포가 위치한 종양의 미세환경적 요인이 악성화에 어떤 영향을 주는지를 규명해 종양학 연구의 새로운 패러다임을 제공하고 있다. 최근에 암면역치료의 임상적 성공에 힘입어 *종양미세환경의 면역세포에 대한 관심과 연구가 증가하고 있으나 종양미세환경의 물리적 요인이 암세포의 악성화 및 치료반응에 어떤 영향을 주는지에 대한 연구는 거의 없었다.
연구팀은 생체재료를 활용해 인간의 종양미세환경과 유사한 위암실험모델을 개발하고, 이를 이용하여 단단해진 미세환경에 의한 위암세포의 악성화 메커니즘을 규명했다. 암을 유발하는 단백질로 잘 알려진 YAP (Yes-associated protein)의 DNA 가 단단해진 조직내에서 후성유전학적 변화인 DNA 탈메틸화가 유도되어 악성화가 촉진됨을 밝혔다. 이와 더불어, 본 연구팀은 단단하게 변성된 미세환경을 다시 물렁한 조직으로 변화할 경우, 악성화된 위암 세포에서 역전현상이 일어나 악성화가 약화되고 항암제에 반응하는 세포로 변화함을 확인했다.
이번 연구 결과는 치료가 어려운 난치성 *미만형 위암의 악성화를 촉진하는 원인을 규명함으로써 임상적으로 가장 어려운 scirrhous cancer 의 새로운 치료 가능성을 제시하고, 위암 뿐만 아니라 다양한 암종의 유사한 표현형의 암에 대한 치료 확장성에 기여할 것으로 기대한다.
*종양미세환경: 종양내에 존재하는 암세포, 암의 형성 및 진행에 직/간접적으로 영향을 미치는 주변 조직세포 (면역세포, 섬유아세포, 혈관세포 등) 및 이를 구성하고 있는 *세포외기질물질(Extracellular Matrix) 를 총칭해서 종양미세환경이라고 한다.
*세포외기질: 세포와 세포사이를 연결하고 지탱해주는 지지체의 역할을 하는 물질로 콜라겐과 같은 단백질이 이에 속한다. 세포외기질은 단순한 지지체가 아니라, 이것의 물리적, 화학적 특성이 세포의 운명, 특성 등에 직접적으로 영향을 미친다. 특히, 병적요인으로 인해서 조직 섬유화와 같은 변성이 일어나고 이러한 변성이 암과 같은 질병의 악화의 원인이 된다고 알려져 있다.
*미만성 위암: 위암은 조직학적으로 크게 장형암과 미만 위암으로 분류된다. 장형암의 경우 헬리코박터 감염이나 만성 위축성 위염에 속발하는 위암으로 일반적으로 미만성에 비해 양호한 예후를 보인다. 미만성 위암은 장형암에 비해 암 덩어리를 잘 형성하지 않으며 작은 악성 세포들이 위벽에 퍼져서 침윤과 전이를 잘하며 조기 발견도 어렵다. 40세 미만에서 호발하며 악성도가 매우 높아 치료가 어려운 암으로 알려져 있다.
바이오및뇌공학과 장민정 박사가 제1 저자로 참여한 이번 연구는 국제학술지인 `네이처 바이오메디컬엔지니어링’ 12월 7일 字 온라인 판에 실렸다. (논문명: Matrix stiffness epigenetically regulates the oncogenic activation of the Yes-associated protein in gastric cancer)
이번 연구성과는 한국연구재단 과학기술 분야 기초연구사업인 중견연구자지원사업 및 보건복지부 연구중심병원 R&D 사업의 지원을 통해 수행됐다.
2020.12.10 조회수 45443 노화된 세포를 젊은 세포로 되돌리는 초기 원천기술 개발
우리 연구진이 노화된 세포를 젊은 세포로 되돌리는 역 노화 원천기술을 개발했다. 이를 활용하면 노화 현상을 막고 각종 노인성 질환을 사전 억제할 수 있는 치료제를 개발할 단서를 찾을 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌리는 역 노화의 초기 원천기술을 개발했다고 26일 밝혔다.
조광현 교수팀의 이번 연구 결과는 ㈜아모레퍼시픽 기술연구원과의 산학 공동연구를 통해 최초로 개발된 노화 인공피부 모델에서 이 기술을 적용함으로써 입증하는 데 성공했다.
조 교수팀은 이번 연구를 위해 인간 진피 섬유아세포의 세포노화 신호전달 네트워크의 컴퓨터 모델을 개발한 후 시뮬레이션 분석을 통해 노화된 인간 진피 섬유아세포를 젊은 세포로 되돌리는데 필요한 핵심 인자를 찾아냈다. 이후 노화 인공피부 모델에서 핵심 인자를 조절함으로써 노화된 피부조직에서 감소된 콜라겐의 합성을 증가시키고 재생 능력을 회복시켜 젊은 피부조직의 특성을 보이게 하는 역 노화 기술을 개발했다.
연구팀 관계자는 이러한 역 노화 기술은 노화된 피부 등을 포함한 노화 현상 및 많은 노인성 질환의 발생을 사전에 억제할 수 있도록 근본적인 치료전략을 제시한 것으로 건강 수명을 오랫동안 유지하고 싶은 인류의 꿈을 실현하는데 한 걸음 다가선 결과라고 의미를 부여했다.
바이오및뇌공학과 안수균 박사과정 학생, 강준수 연구원, 이수범 연구원과 ㈜아모레퍼시픽의 바이오사이언스랩이 참여한 이번 연구 결과는 국제저명학술지인 `미국국립과학원회보(PNAS)'에 게재됐다.(논문명: Inhibition of 3-phosphoinositide-dependent protein kinase 1 (PDK1) can revert cellular senescence in human dermal fibroblasts)
현재 널리 연구되고 있는 회춘 전략은 이미 분화된 세포를 역분화시키는 4개의 `OSKM(Oct4, Sox2, Klf4, c-Myc) 야마나카 전사인자'를 일시적으로 발현시켜 후성유전학적 리모델링(epigenetic remodeling)을 일으킴으로써 노화된 세포를 젊은 상태로 되돌리는 부분적 역분화(partial reprogramming) 전략이다.
이 기술은 노화된 세포가 젊은 세포로 되돌아갈 수 있다는 것을 증명했지만 종양의 형성과 암의 진행을 유발하는 부작용이 생긴다. 따라서 이와 같은 부작용을 배제할 수 있는 정교한 제어 전략이 과학 난제로 남아있었다.
조 교수팀은 이러한 난제 해결을 위해 시스템생물학 연구 방법을 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌릴 수 있는 핵심 조절인자를 오래전부터 탐구하기 시작했다. 4년에 걸친 연구 끝에 단백질 합성, 세포의 성장 등을 조절하는 mTOR와 면역 물질 사이토카인의 생성에 관여하는 NF-kB를 동시에 제어하고 있는 상위 조절 인자인 `PDK1(3-phosphoinositide-dependent protein kinase 1)'을 찾아냈다.
연구팀은 PDK1을 억제함으로써 노화된 인간 진피 섬유아세포를 다시 정상적인 젊은 세포로 되돌릴 수 있음을 분자 세포실험 및 노화 인공피부 모델 실험을 통해 입증했다. 연구를 통해 노화된 인간 진피 섬유아세포에서 PDK1을 억제했을 때 세포노화 표지 인자들이 사라지고 주변 환경에 적절하게 반응하는 정상 세포로서 기능을 회복하는 현상을 확인했다.
연구 결과 노화된 인간 진피 섬유아세포에서는 PDK1이 mTOR와 NF-kB를 활성화해 노화와 관련된 분비 표현형(SASP: Senescence Associated Secretary Phenotype)을 유발하고 노화 형질을 유지하는 것과 연관돼 있음을 밝혀냈다. 즉, PDK1을 억제함으로써 다시 원래의 정상적인 젊은 세포 상태로 안전하게 되돌릴 수 있음을 증명한 것이다.
조 교수팀이 연구 과정에서 찾아낸 표적 단백질의 활성을 억제할 수 있는 저분자화합물과 관련된 신약개발과 그리고 전임상실험을 통해 노화된 세포의 정상 세포화라는 연구 결과는 새로운 노인성 질환의 치료 기술과 회춘 기술에 관한 연구를 본 궤도에 올려놓은 초석을 다진 획기적인 연구로 평가받고 있다.
실제 ㈜아모레퍼시픽 기술연구원은 이번 연구 결과로부터 동백추출물에서 PDK1 억제 성분을 추출해 노화된 피부의 주름을 개선하는 화장품을 개발중이다.
조광현 교수는 "그동안 비가역적 생명현상이라고 인식돼왔던 노화를 가역화할 가능성을 보여줬다ˮ라며 "이번 연구는 노화를 가역적 생명현상으로 인식하고 이에 적극적으로 대처해 건강 수명을 연장하는 한편 노인성 질환을 예방할 수 있는 새로운 시대의 서막을 열었다ˮ라고 의미를 부여했다.
이번 연구는 조광현 교수 연구팀의 시스템생물학 기반 가역화 기술 개발의 일환으로 이뤄졌으며, 연구팀은 지난 1월 같은 기술을 적용해 대장암세포를 다시 정상 대장 세포로 되돌리는 연구에 성공한 바 있다.
한편 이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 그랜드챌린지 30 (KC30) 프로젝트 및 아모레퍼시픽 R&D 센터의 지원으로 수행됐다.
2020.11.26 조회수 49363
노화된 세포를 젊은 세포로 되돌리는 초기 원천기술 개발
우리 연구진이 노화된 세포를 젊은 세포로 되돌리는 역 노화 원천기술을 개발했다. 이를 활용하면 노화 현상을 막고 각종 노인성 질환을 사전 억제할 수 있는 치료제를 개발할 단서를 찾을 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌리는 역 노화의 초기 원천기술을 개발했다고 26일 밝혔다.
조광현 교수팀의 이번 연구 결과는 ㈜아모레퍼시픽 기술연구원과의 산학 공동연구를 통해 최초로 개발된 노화 인공피부 모델에서 이 기술을 적용함으로써 입증하는 데 성공했다.
조 교수팀은 이번 연구를 위해 인간 진피 섬유아세포의 세포노화 신호전달 네트워크의 컴퓨터 모델을 개발한 후 시뮬레이션 분석을 통해 노화된 인간 진피 섬유아세포를 젊은 세포로 되돌리는데 필요한 핵심 인자를 찾아냈다. 이후 노화 인공피부 모델에서 핵심 인자를 조절함으로써 노화된 피부조직에서 감소된 콜라겐의 합성을 증가시키고 재생 능력을 회복시켜 젊은 피부조직의 특성을 보이게 하는 역 노화 기술을 개발했다.
연구팀 관계자는 이러한 역 노화 기술은 노화된 피부 등을 포함한 노화 현상 및 많은 노인성 질환의 발생을 사전에 억제할 수 있도록 근본적인 치료전략을 제시한 것으로 건강 수명을 오랫동안 유지하고 싶은 인류의 꿈을 실현하는데 한 걸음 다가선 결과라고 의미를 부여했다.
바이오및뇌공학과 안수균 박사과정 학생, 강준수 연구원, 이수범 연구원과 ㈜아모레퍼시픽의 바이오사이언스랩이 참여한 이번 연구 결과는 국제저명학술지인 `미국국립과학원회보(PNAS)'에 게재됐다.(논문명: Inhibition of 3-phosphoinositide-dependent protein kinase 1 (PDK1) can revert cellular senescence in human dermal fibroblasts)
현재 널리 연구되고 있는 회춘 전략은 이미 분화된 세포를 역분화시키는 4개의 `OSKM(Oct4, Sox2, Klf4, c-Myc) 야마나카 전사인자'를 일시적으로 발현시켜 후성유전학적 리모델링(epigenetic remodeling)을 일으킴으로써 노화된 세포를 젊은 상태로 되돌리는 부분적 역분화(partial reprogramming) 전략이다.
이 기술은 노화된 세포가 젊은 세포로 되돌아갈 수 있다는 것을 증명했지만 종양의 형성과 암의 진행을 유발하는 부작용이 생긴다. 따라서 이와 같은 부작용을 배제할 수 있는 정교한 제어 전략이 과학 난제로 남아있었다.
조 교수팀은 이러한 난제 해결을 위해 시스템생물학 연구 방법을 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌릴 수 있는 핵심 조절인자를 오래전부터 탐구하기 시작했다. 4년에 걸친 연구 끝에 단백질 합성, 세포의 성장 등을 조절하는 mTOR와 면역 물질 사이토카인의 생성에 관여하는 NF-kB를 동시에 제어하고 있는 상위 조절 인자인 `PDK1(3-phosphoinositide-dependent protein kinase 1)'을 찾아냈다.
연구팀은 PDK1을 억제함으로써 노화된 인간 진피 섬유아세포를 다시 정상적인 젊은 세포로 되돌릴 수 있음을 분자 세포실험 및 노화 인공피부 모델 실험을 통해 입증했다. 연구를 통해 노화된 인간 진피 섬유아세포에서 PDK1을 억제했을 때 세포노화 표지 인자들이 사라지고 주변 환경에 적절하게 반응하는 정상 세포로서 기능을 회복하는 현상을 확인했다.
연구 결과 노화된 인간 진피 섬유아세포에서는 PDK1이 mTOR와 NF-kB를 활성화해 노화와 관련된 분비 표현형(SASP: Senescence Associated Secretary Phenotype)을 유발하고 노화 형질을 유지하는 것과 연관돼 있음을 밝혀냈다. 즉, PDK1을 억제함으로써 다시 원래의 정상적인 젊은 세포 상태로 안전하게 되돌릴 수 있음을 증명한 것이다.
조 교수팀이 연구 과정에서 찾아낸 표적 단백질의 활성을 억제할 수 있는 저분자화합물과 관련된 신약개발과 그리고 전임상실험을 통해 노화된 세포의 정상 세포화라는 연구 결과는 새로운 노인성 질환의 치료 기술과 회춘 기술에 관한 연구를 본 궤도에 올려놓은 초석을 다진 획기적인 연구로 평가받고 있다.
실제 ㈜아모레퍼시픽 기술연구원은 이번 연구 결과로부터 동백추출물에서 PDK1 억제 성분을 추출해 노화된 피부의 주름을 개선하는 화장품을 개발중이다.
조광현 교수는 "그동안 비가역적 생명현상이라고 인식돼왔던 노화를 가역화할 가능성을 보여줬다ˮ라며 "이번 연구는 노화를 가역적 생명현상으로 인식하고 이에 적극적으로 대처해 건강 수명을 연장하는 한편 노인성 질환을 예방할 수 있는 새로운 시대의 서막을 열었다ˮ라고 의미를 부여했다.
이번 연구는 조광현 교수 연구팀의 시스템생물학 기반 가역화 기술 개발의 일환으로 이뤄졌으며, 연구팀은 지난 1월 같은 기술을 적용해 대장암세포를 다시 정상 대장 세포로 되돌리는 연구에 성공한 바 있다.
한편 이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 그랜드챌린지 30 (KC30) 프로젝트 및 아모레퍼시픽 R&D 센터의 지원으로 수행됐다.
2020.11.26 조회수 49363 수학 모델로 불안정한 수면 사이클 원인 밝혀
우리 대학 연구진이 수학적 모델을 이용해 세포질 혼잡을 유발하는 비만과 치매, 노화가 어떻게 불안정한 수면을 유발하는지를 밝히고 해결책을 제시했다.
수리과학과 김재경 교수 연구팀은 수학적 모델을 이용해 세포 내 분자 이동을 방해하는 세포질 혼잡(Cytoplasmic congestion)이 불안정한 일주기 리듬(Circadian rhythms)과 수면 사이클을 유발함을 예측하고, 미국 플로리다 주립대학 이주곤 교수 연구팀과 실험을 통해 검증하는 데 성공했다고 9일 밝혔다.
수리과학과 김대욱 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `미국국립과학원회보(PNAS)' 10월 26일 字 온라인판에 실렸다. (논문명 : Wake-sleep cycles are severely disrupted by diseases affecting cytoplasmic homeostasis)
우리 뇌 속에 있는 생체시계(Circadian clock)는 인간이 24시간 주기에 맞춰 살아갈 수 있도록 행동과 생리 작용을 조절하는 역할을 한다. 생체시계는 밤 9시경이 되면 우리 뇌 속에서 멜라토닌 호르몬의 분비를 유발해 일정 시간에 수면을 취할 수 있도록 하는 등 운동 능력이나 학습 능력에 이르기까지 거의 모든 생리 작용에 관여한다.
2017년 노벨생리의학상을 수상한 마이클 영, 제프리 홀 그리고 마이클 로스바쉬 교수는 *PER 단백질이 매일 일정한 시간에 세포핵 안으로 들어가 PER 유전자의 전사를 일정 시간에 스스로 억제하는 음성피드백 루프를 통해 24시간 주기의 리듬을 만드는 것이 생체시계의 핵심 원리임을 밝혔다.
☞ PER 단백질: 포유류의 일주기 리듬을 통제하는 핵심 생체시계 단백질이다. 세포질에서 번역(translation)된 PER 단백질은 핵 안으로 들어가 자기 자신의 DNA 전사(transcription)를 조절한다. 이로 인해 세포 내 PER 단백질의 농도는 24시간 주기로 변화한다.
하지만 다양한 물질이 존재하는 복잡한 세포 내 환경에서 어떻게 수천 개의 PER 단백질이 핵 안으로 일정한 시간에 들어갈 수 있는지는 오랫동안 생체시계 분야의 난제로 남아있었다. 이는 서울 각지에서 출발한 수천 명의 직원이 혼잡한 도로를 통과해서 매일 같은 시간에 회사에 들어갈 수 있는 방법을 찾는 것과도 같은 문제다.
김 교수 연구팀은 난제 해결을 위해 세포 내 분자의 움직임을 묘사하는 시공간적 확률론적 모형(Spatiotemporal Stochastic model)을 자체 개발했다. 또 이를 이용해 분석한 결과, PER 단백질이 세포핵 주변에서 충분히 응축돼야만 동시에 인산화돼 핵 안으로 함께 들어간다는 사실을 알아냈다.
김 교수는 "인산화 동기화 스위치 덕분에 수천 개의 PER 단백질이 일정한 시간에 함께 핵 안으로 들어가 안정적인 일주기 리듬을 만들어낼 수 있음을 확인했다ˮ고 설명했다.
김 교수팀은 또 PER 단백질의 핵 주변 응축을 방해하는 지방 액포와 같은 물질들이 세포 내에 과도하게 많아져 세포질이 혼잡해지면 인산화 스위치가 작동하지 않아 불안정한 일주기 리듬과 수면 사이클이 유발된다는 사실도 확인했다.
김재경 교수팀의 수리 모델 예측은 미국 플로리다 주립대학 이주곤 교수 팀과 협업을 통해 실험으로 검증하는 한편 한 발짝 더 나가 비만·치매·노화가 세포질 혼잡을 일으킴으로써 수면 사이클의 불안정을 가져오는 핵심 요인임을 규명하는 데도 성공했다. 세포질 혼잡 해소가 수면 질환 치료의 핵심이기 때문에 김 교수팀의 이번 연구는 수면 질환 치료의 새로운 패러다임을 제시했다는 점에서 큰 의미가 있다.
김재경 교수는 "비만과 치매, 그리고 노화가 불안정한 수면을 유발하는 원인을 수학과 생명과학의 융합 연구를 통해 밝힌 연구ˮ라고 소개하면서 "이번 성과를 통해 수면 질환의 새로운 치료법이 개발되기를 기대한다ˮ라고 말했다.
2020.11.09 조회수 41430
수학 모델로 불안정한 수면 사이클 원인 밝혀
우리 대학 연구진이 수학적 모델을 이용해 세포질 혼잡을 유발하는 비만과 치매, 노화가 어떻게 불안정한 수면을 유발하는지를 밝히고 해결책을 제시했다.
수리과학과 김재경 교수 연구팀은 수학적 모델을 이용해 세포 내 분자 이동을 방해하는 세포질 혼잡(Cytoplasmic congestion)이 불안정한 일주기 리듬(Circadian rhythms)과 수면 사이클을 유발함을 예측하고, 미국 플로리다 주립대학 이주곤 교수 연구팀과 실험을 통해 검증하는 데 성공했다고 9일 밝혔다.
수리과학과 김대욱 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `미국국립과학원회보(PNAS)' 10월 26일 字 온라인판에 실렸다. (논문명 : Wake-sleep cycles are severely disrupted by diseases affecting cytoplasmic homeostasis)
우리 뇌 속에 있는 생체시계(Circadian clock)는 인간이 24시간 주기에 맞춰 살아갈 수 있도록 행동과 생리 작용을 조절하는 역할을 한다. 생체시계는 밤 9시경이 되면 우리 뇌 속에서 멜라토닌 호르몬의 분비를 유발해 일정 시간에 수면을 취할 수 있도록 하는 등 운동 능력이나 학습 능력에 이르기까지 거의 모든 생리 작용에 관여한다.
2017년 노벨생리의학상을 수상한 마이클 영, 제프리 홀 그리고 마이클 로스바쉬 교수는 *PER 단백질이 매일 일정한 시간에 세포핵 안으로 들어가 PER 유전자의 전사를 일정 시간에 스스로 억제하는 음성피드백 루프를 통해 24시간 주기의 리듬을 만드는 것이 생체시계의 핵심 원리임을 밝혔다.
☞ PER 단백질: 포유류의 일주기 리듬을 통제하는 핵심 생체시계 단백질이다. 세포질에서 번역(translation)된 PER 단백질은 핵 안으로 들어가 자기 자신의 DNA 전사(transcription)를 조절한다. 이로 인해 세포 내 PER 단백질의 농도는 24시간 주기로 변화한다.
하지만 다양한 물질이 존재하는 복잡한 세포 내 환경에서 어떻게 수천 개의 PER 단백질이 핵 안으로 일정한 시간에 들어갈 수 있는지는 오랫동안 생체시계 분야의 난제로 남아있었다. 이는 서울 각지에서 출발한 수천 명의 직원이 혼잡한 도로를 통과해서 매일 같은 시간에 회사에 들어갈 수 있는 방법을 찾는 것과도 같은 문제다.
김 교수 연구팀은 난제 해결을 위해 세포 내 분자의 움직임을 묘사하는 시공간적 확률론적 모형(Spatiotemporal Stochastic model)을 자체 개발했다. 또 이를 이용해 분석한 결과, PER 단백질이 세포핵 주변에서 충분히 응축돼야만 동시에 인산화돼 핵 안으로 함께 들어간다는 사실을 알아냈다.
김 교수는 "인산화 동기화 스위치 덕분에 수천 개의 PER 단백질이 일정한 시간에 함께 핵 안으로 들어가 안정적인 일주기 리듬을 만들어낼 수 있음을 확인했다ˮ고 설명했다.
김 교수팀은 또 PER 단백질의 핵 주변 응축을 방해하는 지방 액포와 같은 물질들이 세포 내에 과도하게 많아져 세포질이 혼잡해지면 인산화 스위치가 작동하지 않아 불안정한 일주기 리듬과 수면 사이클이 유발된다는 사실도 확인했다.
김재경 교수팀의 수리 모델 예측은 미국 플로리다 주립대학 이주곤 교수 팀과 협업을 통해 실험으로 검증하는 한편 한 발짝 더 나가 비만·치매·노화가 세포질 혼잡을 일으킴으로써 수면 사이클의 불안정을 가져오는 핵심 요인임을 규명하는 데도 성공했다. 세포질 혼잡 해소가 수면 질환 치료의 핵심이기 때문에 김 교수팀의 이번 연구는 수면 질환 치료의 새로운 패러다임을 제시했다는 점에서 큰 의미가 있다.
김재경 교수는 "비만과 치매, 그리고 노화가 불안정한 수면을 유발하는 원인을 수학과 생명과학의 융합 연구를 통해 밝힌 연구ˮ라고 소개하면서 "이번 성과를 통해 수면 질환의 새로운 치료법이 개발되기를 기대한다ˮ라고 말했다.
2020.11.09 조회수 41430 이흥규 교수 연구팀, 수지상세포 자식작용의 역할 규명
우리 연구진에 의해 세포 항상성을 유지해주는 '자식작용'*의 또 다른 기능이 보고됐다. 의과학대학원 이흥규 교수 연구팀이 T세포*의 항바이러스 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다고 밝혔다.
* 자식작용(自食作用, autophagy) : 세포 내 노폐물 및 손상된 세포 소기관을 제거하여 세포의 항상성을 유지하는 과정이다. 자식작용을 처음 발견한 오스미 요시노리(Ohsumi Yoshinori) 교수가 2016년 노벨 생리의학상을 수상하는 등 세계적으로 활발한 연구가 진행되고 있으며, 최근에는 다양한 병원균을 이기는 면역 반응에서도 중요한 기능을 한다고 보고됐다.
* T세포 : 흉선에서 유래하는 림프구로, 세포의 면역에서 주된 역할을 한다.
수지상세포는 병원균이나 암 항원을 인지해 T세포*의 면역반응을 유도하는 세포이다. 바이러스 항원을 수지상세포가 흡수하고, 자신의 표면에 항원을 제시하여 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용을 통한 세포대사 조절이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항바이러스 효과를 높일 수 있는 원리를 제시했다.
실험결과, 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 해당작용이 증가하고, 이를 통해 T세포 활성화 기능이 높아지고 항바이러스 면역반응이 증가했다.
Atg5가 결손되면 수지상세포의 해당작용이 증가하는데, 이로 인해 MHC 클래스 I 분자가 과발현되고 항원 제시를 통한 T 세포 활성화가 증가한다. 이로 인해 호흡기세포융합바이러스(RSV) 감염 시 항바이러스 면역반응이 더 활성화되어 바이러스가 더 빨리 제거되었다.
이흥규 교수는 "이번 연구를 통해 자식작용이 T세포의 항바이러스 면역반응에 관여하는 기능을 새롭게 규명했다”라고 연구의 의의를 설명하며, “향후 자식작용과 세포 대사를 표적으로하는 항바이러스 치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이번 연구 성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행되었다. 저명한 국제학술지 ‘오토파지(Autophagy)’ 8월 28일 자에 온라인 게재됐다.
수지상세포는 바이러스를 받아들여 이들을 분해해 MHC class I에 항원을 제시하고 CD8+ T세포를 활성화해 항바이러스 면역반응을 유도함. Atg5 유전자 결손 시 해당작용 의존적인 항원 제시 및 사이토카인 분비가 과활성화되어 MHC class I을 통한 CD8+ T세포의 활성이 증가됨. 수지상세포에서 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가되어 바이러스 제거를 촉진시킴.
가. Atg5 유전자 결손 시 정상과 다른 특이한 특징을 갖는 수지상세포가 폐에 유입됨.
나. 수지상 세포 특이적으로 Atg5 결손 시, 항원제시, 해당작용과 대사와 관련된 유전자들이 증가됨.
다. 수지상 세포 특이적으로 Atg5 결손 시, 수지상세포의 해당작용이 증가함.
라. 바이러스 감염 시 항원제시에 중요한 MHC 클래스 I의 발현이 증가함. 반면, 해당작용 억제제(2-DG) 처리 시 발현이 감소함. 즉, MHC 클래스 I의 발현에 해당작용이 중요한 역할을 함.
마. 수지상세포 특이적 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가함.
바. 수지상세포 특이적 Atg5 유전자 결손 시 바이러스의 제거가 더 빠르게 일어남.
2020.09.11 조회수 29304
이흥규 교수 연구팀, 수지상세포 자식작용의 역할 규명
우리 연구진에 의해 세포 항상성을 유지해주는 '자식작용'*의 또 다른 기능이 보고됐다. 의과학대학원 이흥규 교수 연구팀이 T세포*의 항바이러스 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다고 밝혔다.
* 자식작용(自食作用, autophagy) : 세포 내 노폐물 및 손상된 세포 소기관을 제거하여 세포의 항상성을 유지하는 과정이다. 자식작용을 처음 발견한 오스미 요시노리(Ohsumi Yoshinori) 교수가 2016년 노벨 생리의학상을 수상하는 등 세계적으로 활발한 연구가 진행되고 있으며, 최근에는 다양한 병원균을 이기는 면역 반응에서도 중요한 기능을 한다고 보고됐다.
* T세포 : 흉선에서 유래하는 림프구로, 세포의 면역에서 주된 역할을 한다.
수지상세포는 병원균이나 암 항원을 인지해 T세포*의 면역반응을 유도하는 세포이다. 바이러스 항원을 수지상세포가 흡수하고, 자신의 표면에 항원을 제시하여 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용을 통한 세포대사 조절이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항바이러스 효과를 높일 수 있는 원리를 제시했다.
실험결과, 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 해당작용이 증가하고, 이를 통해 T세포 활성화 기능이 높아지고 항바이러스 면역반응이 증가했다.
Atg5가 결손되면 수지상세포의 해당작용이 증가하는데, 이로 인해 MHC 클래스 I 분자가 과발현되고 항원 제시를 통한 T 세포 활성화가 증가한다. 이로 인해 호흡기세포융합바이러스(RSV) 감염 시 항바이러스 면역반응이 더 활성화되어 바이러스가 더 빨리 제거되었다.
이흥규 교수는 "이번 연구를 통해 자식작용이 T세포의 항바이러스 면역반응에 관여하는 기능을 새롭게 규명했다”라고 연구의 의의를 설명하며, “향후 자식작용과 세포 대사를 표적으로하는 항바이러스 치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이번 연구 성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행되었다. 저명한 국제학술지 ‘오토파지(Autophagy)’ 8월 28일 자에 온라인 게재됐다.
수지상세포는 바이러스를 받아들여 이들을 분해해 MHC class I에 항원을 제시하고 CD8+ T세포를 활성화해 항바이러스 면역반응을 유도함. Atg5 유전자 결손 시 해당작용 의존적인 항원 제시 및 사이토카인 분비가 과활성화되어 MHC class I을 통한 CD8+ T세포의 활성이 증가됨. 수지상세포에서 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가되어 바이러스 제거를 촉진시킴.
가. Atg5 유전자 결손 시 정상과 다른 특이한 특징을 갖는 수지상세포가 폐에 유입됨.
나. 수지상 세포 특이적으로 Atg5 결손 시, 항원제시, 해당작용과 대사와 관련된 유전자들이 증가됨.
다. 수지상 세포 특이적으로 Atg5 결손 시, 수지상세포의 해당작용이 증가함.
라. 바이러스 감염 시 항원제시에 중요한 MHC 클래스 I의 발현이 증가함. 반면, 해당작용 억제제(2-DG) 처리 시 발현이 감소함. 즉, MHC 클래스 I의 발현에 해당작용이 중요한 역할을 함.
마. 수지상세포 특이적 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가함.
바. 수지상세포 특이적 Atg5 유전자 결손 시 바이러스의 제거가 더 빠르게 일어남.
2020.09.11 조회수 29304 코로나19 감염 중증도 결정하는 인자 발견
코로나19로 위중, 중증 상태인 중환자가 6일 0시 기준 163명을 기록했다. 지난달 19일 12명이었던 위중, 중증 환자는 20여일 만에 13배 넘게 늘어났다. 이러한 심각한 상황에서 우리 연구진이 코로나19 중증 환자와 경증 환자를 쉽게 판별할 수 있는 바이오 마커(표시물)를 발견해 중증 코로나19에 대한 치료제 개발에 기대감을 높였다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 *'호중구'와 *'당질코르티코이드'의 연관성을 밝혀 코로나19의 중증도를 결정짓는 인자를 발견했다고 7일 밝혔다.
☞ 호중구(neutrophil) : 혈액의 전체 백혈구 중 50~70%를 차지하는 선천 면역세포로, 세균이나 곰팡이 감염 등에 대응하는 면역세포이다.
☞ 당질코르티코이드(glucocorticoid) : 글루코코르티코이드라고도 하며 콩팥 근처 부신의 부신 겉질에서 생성되는 호르몬으로, 다양한 신체 기능 조절에 관여한다. 특히, 면역반응을 억제하는 호르몬으로도 알려져 있다.
WHO에 의해 세계적 대유행(팬데믹)으로 지정된 코로나바이러스감염증(COVID-19)은 사람마다 증상이 판이하다. 따라서, 환자의 중증도를 예상 및 판별하기 위해서는 확실한 바이오 마커의 활용이 중요하며, 이들을 선별적으로 치료할 수 있는 표적 치료제가 매우 중요하다.
중증 코로나19 환자들은 급성 호흡곤란 증후군의 증상을 보이고 특히 폐 조직의 심한 손상이 관찰된다. 이에 대응해 호중구 등 다양한 면역세포들이 바이러스 감염으로부터 숙주를 보호하기 위해 면역반응을 보이지만 사이토카인 폭풍(과잉 염증반응)처럼 과도한 면역반응으로 오히려 장기를 손상시킬 수도 있다.
이 교수 연구팀은 유전자 발현 옴니버스(GEO)에 공개된 코로나19 감염 경증 및 중증 환자의 기관지 폐포 세척액에 존재하는 단일세포 유전 정보를 분석했다. 그 결과, 그동안 곰팡이나 세균 감염에서만 중요성이 알려졌고 바이러스 감염 시에는 상대적으로 중요성이 알려지지 않았던 호중구의 과활성화로 인해 중증 코로나19가 발생함을 밝혔다.
특히 연구팀은 대식세포 등의 골수 유래 면역세포 내에서 발현하는 CXCL8과 같은 *케모카인에 의해 호중구 유입이 증가함을 밝혔다. 연구팀은 골수에서 유래한 면역세포 내의 당질코르티코이드 수용체 발현에 따라 CXCL8의 생성이 조절받으며, 이것이 결과적으로 호중구의 유입 및 활성도와 연관됨을 밝혔다.
☞ 케모카인(chemokine): 백혈구유주작용, 활성화작용을 하는 염기성헤파린 결합성 저분자 단백질
이 교수는 "이번 연구 결과는 코로나19의 중증도를 결정하는 바이오 마커를 발굴한 것 뿐만 아니라, 덱사메타손 등의 당질코르티코이드 억제제를 활용해 중증도를 개선할 치료제 개발에 단초를 제공할 수 있을 것으로 기대한다"고 밝혔다.
의과학대학원 박장현 석박사통합과정 대학원생이 제1 저자로 참여한 이번 연구는 국제면역학회연합에서 발간하는 면역학 전문 학술지인 '프론티어스 인 이뮤놀로지(Frontiers in Immunology)' 8월 28일 字 온라인판에 게재됐다. (논문명: Re-analysis of Single Cell Transcriptome Reveals That the NR3C1-CXCL8-Neutrophil Axis Determines the Severity of COVID-19)
한편 이번 연구는 과학기술정보통신부의 코리아 바이오 그랜드 챌린지사업, 신약타겟발굴 및 검증사업 및 KAIST 코로나 대응 과학기술 뉴딜사업을 받아 수행됐다.
2020.09.07 조회수 30046
코로나19 감염 중증도 결정하는 인자 발견
코로나19로 위중, 중증 상태인 중환자가 6일 0시 기준 163명을 기록했다. 지난달 19일 12명이었던 위중, 중증 환자는 20여일 만에 13배 넘게 늘어났다. 이러한 심각한 상황에서 우리 연구진이 코로나19 중증 환자와 경증 환자를 쉽게 판별할 수 있는 바이오 마커(표시물)를 발견해 중증 코로나19에 대한 치료제 개발에 기대감을 높였다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 *'호중구'와 *'당질코르티코이드'의 연관성을 밝혀 코로나19의 중증도를 결정짓는 인자를 발견했다고 7일 밝혔다.
☞ 호중구(neutrophil) : 혈액의 전체 백혈구 중 50~70%를 차지하는 선천 면역세포로, 세균이나 곰팡이 감염 등에 대응하는 면역세포이다.
☞ 당질코르티코이드(glucocorticoid) : 글루코코르티코이드라고도 하며 콩팥 근처 부신의 부신 겉질에서 생성되는 호르몬으로, 다양한 신체 기능 조절에 관여한다. 특히, 면역반응을 억제하는 호르몬으로도 알려져 있다.
WHO에 의해 세계적 대유행(팬데믹)으로 지정된 코로나바이러스감염증(COVID-19)은 사람마다 증상이 판이하다. 따라서, 환자의 중증도를 예상 및 판별하기 위해서는 확실한 바이오 마커의 활용이 중요하며, 이들을 선별적으로 치료할 수 있는 표적 치료제가 매우 중요하다.
중증 코로나19 환자들은 급성 호흡곤란 증후군의 증상을 보이고 특히 폐 조직의 심한 손상이 관찰된다. 이에 대응해 호중구 등 다양한 면역세포들이 바이러스 감염으로부터 숙주를 보호하기 위해 면역반응을 보이지만 사이토카인 폭풍(과잉 염증반응)처럼 과도한 면역반응으로 오히려 장기를 손상시킬 수도 있다.
이 교수 연구팀은 유전자 발현 옴니버스(GEO)에 공개된 코로나19 감염 경증 및 중증 환자의 기관지 폐포 세척액에 존재하는 단일세포 유전 정보를 분석했다. 그 결과, 그동안 곰팡이나 세균 감염에서만 중요성이 알려졌고 바이러스 감염 시에는 상대적으로 중요성이 알려지지 않았던 호중구의 과활성화로 인해 중증 코로나19가 발생함을 밝혔다.
특히 연구팀은 대식세포 등의 골수 유래 면역세포 내에서 발현하는 CXCL8과 같은 *케모카인에 의해 호중구 유입이 증가함을 밝혔다. 연구팀은 골수에서 유래한 면역세포 내의 당질코르티코이드 수용체 발현에 따라 CXCL8의 생성이 조절받으며, 이것이 결과적으로 호중구의 유입 및 활성도와 연관됨을 밝혔다.
☞ 케모카인(chemokine): 백혈구유주작용, 활성화작용을 하는 염기성헤파린 결합성 저분자 단백질
이 교수는 "이번 연구 결과는 코로나19의 중증도를 결정하는 바이오 마커를 발굴한 것 뿐만 아니라, 덱사메타손 등의 당질코르티코이드 억제제를 활용해 중증도를 개선할 치료제 개발에 단초를 제공할 수 있을 것으로 기대한다"고 밝혔다.
의과학대학원 박장현 석박사통합과정 대학원생이 제1 저자로 참여한 이번 연구는 국제면역학회연합에서 발간하는 면역학 전문 학술지인 '프론티어스 인 이뮤놀로지(Frontiers in Immunology)' 8월 28일 字 온라인판에 게재됐다. (논문명: Re-analysis of Single Cell Transcriptome Reveals That the NR3C1-CXCL8-Neutrophil Axis Determines the Severity of COVID-19)
한편 이번 연구는 과학기술정보통신부의 코리아 바이오 그랜드 챌린지사업, 신약타겟발굴 및 검증사업 및 KAIST 코로나 대응 과학기술 뉴딜사업을 받아 수행됐다.
2020.09.07 조회수 30046 중증 코로나19 환자의 사이토카인 폭풍 원인 찾았다
우리 대학 의과학대학원 신의철 교수와 생명과학과 정인경 교수 연구팀이 서울아산병원 김성한 교수·연세대 세브란스병원 최준용·안진영 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 중증 코로나19 환자에서 나타나는 과잉 염증반응을 일으키는 원인을 발견했다.
과잉 염증반응이란 흔히 '사이토카인 폭풍'이라고도 불리는 증상인데 면역 물질인 사이토카인(cytokine)이 과다하게 분비돼 이 물질이 정상 세포를 공격하는 현상이다.
☞ 사이토카인(cytokine): 면역세포로부터 분비되는 단백질 면역조절제로서 자가분비형 신호전달(autocrine signaling), 측분비 신호전달(paracrine signaling), 내분비 신호전달(endocrine signaling) 과정에서 특정 수용체와 결합하여 면역반응에 관여한다. 세포의 증식, 분화, 세포사멸 또는 상처 치료 등에 관여하는 다양한 종류의 사이토카인이 존재하며, 특히 면역과 염증에 관여하는 것이 많다. 세포를 의미하는 접두어인 ‘cyto’와 그리스어로 ‘움직이다’를 의미하는 ‘kinein’으로부터 cytokine이 명명됐다.
☞ 사이토카인 폭풍(cytokine storm): 인체에 바이러스가 침투하였을 때 면역 물질인 사이토카인이 과다하게 분비되어 정상 세포를 공격하는 현상
빠르게 확산하고 있는 코로나19 바이러스는 전 세계적으로 이미 1,300만 명 이상이 감염됐고 이 중 50만 명 이상이 사망했다. 코로나19 바이러스에 감염된 환자들은 경증 질환만을 앓고 자연적으로 회복되는 경우가 많으나, 어떤 환자들은 중증 질환으로 발전해 심한 경우 사망하기도 한다. 흔히 사이토카인 폭풍 때문에 중증 코로나19가 유발된다는 사실이 널리 알려져 있다. 하지만 어떤 이유에서 과잉 염증반응이 일어나는지 구체적인 원인은 아직도 알려지지 않아 중증 코로나19 환자의 치료에 많은 어려움을 겪고 있다.
우리 대학 의과학대학원 이정석 연구원 및 생명과학과 박성완 연구원이 주도한 이번 연구에서 공동연구팀은 중증 및 경증 코로나19 환자로부터 혈액을 얻은 후 면역세포들을 분리하고 단일 세포 유전자발현 분석이라는 최신 연구기법을 적용해 그 특성을 상세히 분석했다. 그 결과, 중증 또는 경증을 막론하고 코로나19 환자의 면역세포에서 염증성 사이토카인의 일종인 종양괴사인자(TNF)와 인터류킨-1(IL-1)이 공통으로 나타나는 현상을 발견했다. 연구팀은 특히 중증과 경증 환자를 비교 분석한 결과, 인터페론이라는 사이토카인 반응이 중증 환자에게서만 특징적으로 강하게 나타남을 확인했다.
☞ 인터페론(interferon): 사이토카인(cytokine)의 일종으로 숙주 세포가 바이러스, 세균, 기생균 등 다양한 병원체에 감염되거나 혹은 암세포 존재 하에서 합성되고 분비되는 당단백질이다. 일반적으로 바이러스에 감염된 세포에서 분비되는 제 1형 인터페론이 많이 알려져 있으며 주변 세포들이 항바이러스 방어 효과를 나타낼 수 있도록 돕는다.
지금까지 인터페론은 항바이러스 작용을 하는 착한(?) 사이토카인으로 알려져 있으나, 공동연구팀은 인터페론 반응이 코로나19 환자에서는 오히려 과도한 염증반응을 촉발하는 원인이 될 수 있다는 사실을 다양한 방법을 통해 이를 증명했다.
삼성미래기술육성재단과 서경배과학재단의 지원을 받아 수행한 공동연구팀의 이번 연구결과는 면역학 분야 국제 학술지인 사이언스 면역학(Science Immunology)誌 7월 10일 字에 게재됐다(논문명: Immunophenotyping of COVID-19 and Influenza Highlights the Role of Type I Interferons in Development of Severe COVID-19).
연구팀은 중증 코로나19 환자의 과잉 염증반응 완화를 위해 현재에는 스테로이드제와 같은 비특이적 항염증 약물이 사용하고 있는데 이번 연구 성과를 계기로 인터페론을 표적으로 하는 새로운 치료방법도 고려할 수 있음을 보여준다며 중증 코로나19 환자 치료에 새로운 패러다임을 제시한 획기적인 연구라고 이 연구에 대한 의미를 부여했다.
관련 학계와 의료계에서도 코로나19의 재확산 등 팬데믹이 지속되는 현 상황에서 KAIST와 대학병원 연구팀이 긴밀한 협력을 통해 코로나19의 면역학적 원리를 밝히고 새로운 치료전략을 제시한 이번 연구를 중개 연구(translational research)의 주요 성과로 높게 평가했다.
공동연구팀은 현재 중증 코로나19 환자의 과잉 염증반응을 완화해 환자 생존율을 높일 수 있는 약물을 시험관 내에서 효율적으로 검색하고 발굴하는 방법을 개발하는 후속연구를 진행중에 있다.
이번 연구를 주도한 이정석 연구원은 내과 전문의로서 의과학대학원 박사과정에 재학 중인데 "중증 코로나19 환자의 의료적 문제를 해결하기 위해 정인경 교수 연구팀과 함께 이번 연구를 긴박하게 시작했는데 서울아산병원과 연세대 세브란스병원·충북대병원의 적극적인 지원에 힘입어 불과 3개월 만에 마칠 수 있게 됐다ˮ고 말했다.
정인경 교수는 "코로나19와 같은 신규 질환의 특성을 신속하게 규명하는데 있어 최신 단일세포 전사체 빅데이터 분석법이 매우 효과적ˮ이었음을 밝혔다.
신의철 교수도 "이번 연구는 코로나19 환자의 면역세포에서 어떤 일이 벌어지는지 상세히 연구함으로써 향후 치료전략을 설계할 수 있는 토대를 마련했다는 점에서 매우 중요하고 의미가 있는 연구ˮ라고 평가했다.
신의철 교수와 정인경 교수는 이와 함께 "중증 코로나19 환자의 생존율을 높일 수 있도록 새로운 면역기전 연구 및 환자 맞춤 항염증 약물 사용에 관한 연구를 지속적으로 수행할 것ˮ이라고 강조했다.
2020.07.14 조회수 34746
중증 코로나19 환자의 사이토카인 폭풍 원인 찾았다
우리 대학 의과학대학원 신의철 교수와 생명과학과 정인경 교수 연구팀이 서울아산병원 김성한 교수·연세대 세브란스병원 최준용·안진영 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 중증 코로나19 환자에서 나타나는 과잉 염증반응을 일으키는 원인을 발견했다.
과잉 염증반응이란 흔히 '사이토카인 폭풍'이라고도 불리는 증상인데 면역 물질인 사이토카인(cytokine)이 과다하게 분비돼 이 물질이 정상 세포를 공격하는 현상이다.
☞ 사이토카인(cytokine): 면역세포로부터 분비되는 단백질 면역조절제로서 자가분비형 신호전달(autocrine signaling), 측분비 신호전달(paracrine signaling), 내분비 신호전달(endocrine signaling) 과정에서 특정 수용체와 결합하여 면역반응에 관여한다. 세포의 증식, 분화, 세포사멸 또는 상처 치료 등에 관여하는 다양한 종류의 사이토카인이 존재하며, 특히 면역과 염증에 관여하는 것이 많다. 세포를 의미하는 접두어인 ‘cyto’와 그리스어로 ‘움직이다’를 의미하는 ‘kinein’으로부터 cytokine이 명명됐다.
☞ 사이토카인 폭풍(cytokine storm): 인체에 바이러스가 침투하였을 때 면역 물질인 사이토카인이 과다하게 분비되어 정상 세포를 공격하는 현상
빠르게 확산하고 있는 코로나19 바이러스는 전 세계적으로 이미 1,300만 명 이상이 감염됐고 이 중 50만 명 이상이 사망했다. 코로나19 바이러스에 감염된 환자들은 경증 질환만을 앓고 자연적으로 회복되는 경우가 많으나, 어떤 환자들은 중증 질환으로 발전해 심한 경우 사망하기도 한다. 흔히 사이토카인 폭풍 때문에 중증 코로나19가 유발된다는 사실이 널리 알려져 있다. 하지만 어떤 이유에서 과잉 염증반응이 일어나는지 구체적인 원인은 아직도 알려지지 않아 중증 코로나19 환자의 치료에 많은 어려움을 겪고 있다.
우리 대학 의과학대학원 이정석 연구원 및 생명과학과 박성완 연구원이 주도한 이번 연구에서 공동연구팀은 중증 및 경증 코로나19 환자로부터 혈액을 얻은 후 면역세포들을 분리하고 단일 세포 유전자발현 분석이라는 최신 연구기법을 적용해 그 특성을 상세히 분석했다. 그 결과, 중증 또는 경증을 막론하고 코로나19 환자의 면역세포에서 염증성 사이토카인의 일종인 종양괴사인자(TNF)와 인터류킨-1(IL-1)이 공통으로 나타나는 현상을 발견했다. 연구팀은 특히 중증과 경증 환자를 비교 분석한 결과, 인터페론이라는 사이토카인 반응이 중증 환자에게서만 특징적으로 강하게 나타남을 확인했다.
☞ 인터페론(interferon): 사이토카인(cytokine)의 일종으로 숙주 세포가 바이러스, 세균, 기생균 등 다양한 병원체에 감염되거나 혹은 암세포 존재 하에서 합성되고 분비되는 당단백질이다. 일반적으로 바이러스에 감염된 세포에서 분비되는 제 1형 인터페론이 많이 알려져 있으며 주변 세포들이 항바이러스 방어 효과를 나타낼 수 있도록 돕는다.
지금까지 인터페론은 항바이러스 작용을 하는 착한(?) 사이토카인으로 알려져 있으나, 공동연구팀은 인터페론 반응이 코로나19 환자에서는 오히려 과도한 염증반응을 촉발하는 원인이 될 수 있다는 사실을 다양한 방법을 통해 이를 증명했다.
삼성미래기술육성재단과 서경배과학재단의 지원을 받아 수행한 공동연구팀의 이번 연구결과는 면역학 분야 국제 학술지인 사이언스 면역학(Science Immunology)誌 7월 10일 字에 게재됐다(논문명: Immunophenotyping of COVID-19 and Influenza Highlights the Role of Type I Interferons in Development of Severe COVID-19).
연구팀은 중증 코로나19 환자의 과잉 염증반응 완화를 위해 현재에는 스테로이드제와 같은 비특이적 항염증 약물이 사용하고 있는데 이번 연구 성과를 계기로 인터페론을 표적으로 하는 새로운 치료방법도 고려할 수 있음을 보여준다며 중증 코로나19 환자 치료에 새로운 패러다임을 제시한 획기적인 연구라고 이 연구에 대한 의미를 부여했다.
관련 학계와 의료계에서도 코로나19의 재확산 등 팬데믹이 지속되는 현 상황에서 KAIST와 대학병원 연구팀이 긴밀한 협력을 통해 코로나19의 면역학적 원리를 밝히고 새로운 치료전략을 제시한 이번 연구를 중개 연구(translational research)의 주요 성과로 높게 평가했다.
공동연구팀은 현재 중증 코로나19 환자의 과잉 염증반응을 완화해 환자 생존율을 높일 수 있는 약물을 시험관 내에서 효율적으로 검색하고 발굴하는 방법을 개발하는 후속연구를 진행중에 있다.
이번 연구를 주도한 이정석 연구원은 내과 전문의로서 의과학대학원 박사과정에 재학 중인데 "중증 코로나19 환자의 의료적 문제를 해결하기 위해 정인경 교수 연구팀과 함께 이번 연구를 긴박하게 시작했는데 서울아산병원과 연세대 세브란스병원·충북대병원의 적극적인 지원에 힘입어 불과 3개월 만에 마칠 수 있게 됐다ˮ고 말했다.
정인경 교수는 "코로나19와 같은 신규 질환의 특성을 신속하게 규명하는데 있어 최신 단일세포 전사체 빅데이터 분석법이 매우 효과적ˮ이었음을 밝혔다.
신의철 교수도 "이번 연구는 코로나19 환자의 면역세포에서 어떤 일이 벌어지는지 상세히 연구함으로써 향후 치료전략을 설계할 수 있는 토대를 마련했다는 점에서 매우 중요하고 의미가 있는 연구ˮ라고 평가했다.
신의철 교수와 정인경 교수는 이와 함께 "중증 코로나19 환자의 생존율을 높일 수 있도록 새로운 면역기전 연구 및 환자 맞춤 항염증 약물 사용에 관한 연구를 지속적으로 수행할 것ˮ이라고 강조했다.
2020.07.14 조회수 34746 이상엽 특훈교수팀 학생들, 천연물 생산 미생물 개발 전략 총정리
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀 소속 대학원생 4명이 대장균 세포 공장을 개발해 생산된 대표 천연물들의 생합성 경로를 총망라해 최신의 연구 내용과 흐름을 한눈에 파악할 수 있도록 대사 회로를 정리한 `천연물 생산을 위한 대장균에서의 대사공학'을 주제로 논문을 발표했다.
학생들은 이번 논문에서 천연물 생산 대장균 세포 공장 개발을 위한 주요 시스템 대사공학 전략을 `효소 개량'과 `대사흐름 최적화', 그리고 `시스템 접근법' 등 3단계로 정리했으며 각 단계별로 활용이 가능한 최신 도구 및 전략을 대사공학이 나아가야 할 방향과 함께 제시했다.
양동수·박선영·은현민 박사과정과 박예슬 석사과정 학생이 참여한 이번 연구결과는 국제학술지인 셀(Cell)誌가 발행하는 생명공학 분야 권위 리뷰지인 `생명공학의 동향(Trends in Biotechnology)' 7월호(특별호: 대사공학) 표지논문 및 주 논문(Featured Article)으로 1일 게재됐다.
인류 역사에서 천연물은 식품과 의약품 등의 분야에 널리 사용되고 있는데 많은 천연물이 그 자체로 의약 물질로 쓰이거나 새로운 의약 물질 개발의 구조적인 근간이 되고 있다. 고부가가치 천연물에 대한 국제적인 수요와 시장규모는 지속적으로 증가하는 추세인 데 반해 천연자원으로부터 얻을 수 있는 양은 극히 제한적이며 완전한 화학합성은 대체로 효율이 낮고 유기 용매를 다량으로 이용하기 때문에 환경 오염과 인류 건강에 악영향을 초래할 수 있다.
따라서 전 세계적으로 천연물을 친환경적이며 고효율로 생산이 가능한 미생물 세포 공장을 개발하려는 노력이 이뤄지고 있다. 미생물 세포 공장 구축을 위한 핵심전략인 시스템 대사공학은 기존 석유화학산업을 대체할 바이오산업의 핵심이 되는 미생물 균주를 보다 효과적으로 개발하기 위해 KAIST 이상엽 특훈교수가 창시한 연구 분야다.
이상엽 특훈교수 연구팀은 실제 시스템 대사공학 전략을 이용, 천연물·아미노산·생분해성 플라스틱·환경친화적인 플라스틱 원료와 바이오 연료 등을 생산하는 고성능 균주들을 다수 개발한 성과를 거뒀다.
이들 4명의 학생을 지도한 이상엽 특훈교수는 "천연물 생산을 위한 대사공학 연구를 체계적으로 분석, 정리하고 또 향후 전략을 제시했다는 점에서 큰 의미가 있다ˮ면서 "권위가 있는 학술지에 주 논문이자 표지논문으로 게재된 이번 연구를 수행한 학생들이 자랑스럽다ˮ고 말했다.
공동 제1 저자인 양동수·박선영 박사과정 학생도 "고령화가 진행되는 사회에서 헬스케어 산업은 그 중요성이 더욱 대두되고 있다ˮ면서 "인류가 건강한 삶을 지속적으로 영위하기 위해서 필수적인 각종 천연물을 대사공학적으로 생산하는 연구 또한 갈수록 중요해질 것ˮ이라고 강조했다.
한편 이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 `바이오리파이너리를 위한 시스템 대사공학 원천기술개발 과제' 및 노보 노디스크 재단의 지원을 받아 수행됐다.
2020.07.02 조회수 28715
이상엽 특훈교수팀 학생들, 천연물 생산 미생물 개발 전략 총정리
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀 소속 대학원생 4명이 대장균 세포 공장을 개발해 생산된 대표 천연물들의 생합성 경로를 총망라해 최신의 연구 내용과 흐름을 한눈에 파악할 수 있도록 대사 회로를 정리한 `천연물 생산을 위한 대장균에서의 대사공학'을 주제로 논문을 발표했다.
학생들은 이번 논문에서 천연물 생산 대장균 세포 공장 개발을 위한 주요 시스템 대사공학 전략을 `효소 개량'과 `대사흐름 최적화', 그리고 `시스템 접근법' 등 3단계로 정리했으며 각 단계별로 활용이 가능한 최신 도구 및 전략을 대사공학이 나아가야 할 방향과 함께 제시했다.
양동수·박선영·은현민 박사과정과 박예슬 석사과정 학생이 참여한 이번 연구결과는 국제학술지인 셀(Cell)誌가 발행하는 생명공학 분야 권위 리뷰지인 `생명공학의 동향(Trends in Biotechnology)' 7월호(특별호: 대사공학) 표지논문 및 주 논문(Featured Article)으로 1일 게재됐다.
인류 역사에서 천연물은 식품과 의약품 등의 분야에 널리 사용되고 있는데 많은 천연물이 그 자체로 의약 물질로 쓰이거나 새로운 의약 물질 개발의 구조적인 근간이 되고 있다. 고부가가치 천연물에 대한 국제적인 수요와 시장규모는 지속적으로 증가하는 추세인 데 반해 천연자원으로부터 얻을 수 있는 양은 극히 제한적이며 완전한 화학합성은 대체로 효율이 낮고 유기 용매를 다량으로 이용하기 때문에 환경 오염과 인류 건강에 악영향을 초래할 수 있다.
따라서 전 세계적으로 천연물을 친환경적이며 고효율로 생산이 가능한 미생물 세포 공장을 개발하려는 노력이 이뤄지고 있다. 미생물 세포 공장 구축을 위한 핵심전략인 시스템 대사공학은 기존 석유화학산업을 대체할 바이오산업의 핵심이 되는 미생물 균주를 보다 효과적으로 개발하기 위해 KAIST 이상엽 특훈교수가 창시한 연구 분야다.
이상엽 특훈교수 연구팀은 실제 시스템 대사공학 전략을 이용, 천연물·아미노산·생분해성 플라스틱·환경친화적인 플라스틱 원료와 바이오 연료 등을 생산하는 고성능 균주들을 다수 개발한 성과를 거뒀다.
이들 4명의 학생을 지도한 이상엽 특훈교수는 "천연물 생산을 위한 대사공학 연구를 체계적으로 분석, 정리하고 또 향후 전략을 제시했다는 점에서 큰 의미가 있다ˮ면서 "권위가 있는 학술지에 주 논문이자 표지논문으로 게재된 이번 연구를 수행한 학생들이 자랑스럽다ˮ고 말했다.
공동 제1 저자인 양동수·박선영 박사과정 학생도 "고령화가 진행되는 사회에서 헬스케어 산업은 그 중요성이 더욱 대두되고 있다ˮ면서 "인류가 건강한 삶을 지속적으로 영위하기 위해서 필수적인 각종 천연물을 대사공학적으로 생산하는 연구 또한 갈수록 중요해질 것ˮ이라고 강조했다.
한편 이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 `바이오리파이너리를 위한 시스템 대사공학 원천기술개발 과제' 및 노보 노디스크 재단의 지원을 받아 수행됐다.
2020.07.02 조회수 28715 육종민 교수팀, 살아있는 세포의 전자현미경 관찰 성공
우리 대학 신소재공학과 육종민 교수 연구팀이 경북대학교(총장 김상동) ITA 융합대학원 한영기 교수 연구팀과 공동연구를 통해 살아 있는 세포를 전자현미경을 통해 실시간으로 관찰하는 데 성공했다고 29일 밝혔다.
이번 연구를 통해 살아 있는 다양한 세포의 실시간 분자 단위 관찰이 가능해져, 그동안 관찰하지 못했던 살아 있는 세포의 전이·감염에 관한 전 과정을 규명할 수 있게 돼 신약 개발 등을 더욱 촉진할 수 있을 것으로 기대된다.
신소재공학과 구건모 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `나노 레터스(Nano Letters)' 5월 5일 字 온라인판에 게재됐으며 6월 호 표지논문으로 선정됐다. (논문명: Live-Cell Electron Microscopy Using Graphene Veils)
전 세계적으로 대유행하고 있는 코로나바이러스감염증(COVID-19) 등은 수십~수백 나노미터(nm, 1 나노미터는 100만 분의 1밀리미터) 크기의 바이러스로 인해 일어나는 질병이다. 바이러스의 전이·감염 과정을 분석하고 이에 대처하는 신약 개발을 위해서는 바이러스의 미시적인 행동을 실시간으로 관찰하는 것이 매우 중요하다.
수십~수백 나노미터 크기의 바이러스 등을 비롯해 세포와 세포를 이루는 기관들은 가시광선을 이용하는 일반 광학현미경으로는 관찰이 어려워 해상력이 매우 높은 전자선을 이용하는 전자현미경 기술을 이용한다.
그렇지만 전자현미경 기술은 효율적인 작동을 위해 매우 강력한 진공상태가 필요하며 또 가시광선보다 수천 배 이상 높은 에너지를 가지는 전자를 이용하기 때문에 관찰 시 세포의 구조적인 손상이 불가피하다. 따라서 현재로서는 2017년 노벨화학상을 수상한 기술인 극저온 전자현미경을 통해 고정 작업 및 안정화 작업을 거친 표본만 관찰이 가능하다.
최근 학계에서는 사멸해 고정된 것이 아닌 온전한 상태의 살아 있는 세포등 다양한 생체물질을 전자현미경을 이용해 분자 단위로 관찰 가능한지에 대한 논쟁이 전개되고 있다. 육 교수 연구팀은 지난 2012년 개발한 그래핀 액상 셀 전자현미경 기술을 응용해 전자현미경으로도 살아있는 대장균 세포를 관찰하는데 성공했고, 이를 재배양시킴으로써 전자와 진공에 노출됐음에도 불구하고 대장균 세포가 생존한다는 사실을 밝혀냈다.
육 교수 연구팀이 이번 연구에서 활용한 그래핀은 층상 구조인 흑연에서 분리하는 등의 방법으로 얻어내는 약 0.2 나노미터(nm) 두께의 원자 막이다. 여러 분야에서 차세대 소재로 주목받고 있는 그래핀은 강철보다 200배 강한 강도와 높은 전기 전도성을 가지며, 물질을 투과시키지 않는 성질을 가진다. 육 교수 연구팀은 이러한 그래핀 성질을 이용, 세포 등을 액체와 함께 감싸주면, 고진공의 전자현미경 내부에서 탈수에 의한 세포의 구조변화를 막아줄 수 있음을 밝혀냈다. 뿐만 아니라, 그래핀이 전자빔에 의해 공격성이 높아진 활성 산소들을 분해하는 효과도 지니고 있어 그래핀으로 덮어주지 않은 세포보다 100배 강한 전자에 노출되더라도 세포가 활성을 잃지 않는다는 결과를 확인했다.
육 교수는 "이번 연구 결과는 세포보다 더 작은 단백질이나 DNA의 실시간 전자현미경 관찰로까지 확대될 수 있어, 앞으로 다양한 생명 현상의 기작을 근본적으로 밝힐 수 있을 것이라 기대한다ˮ고 밝혔다.
한편, 이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
2020.06.29 조회수 22645
육종민 교수팀, 살아있는 세포의 전자현미경 관찰 성공
우리 대학 신소재공학과 육종민 교수 연구팀이 경북대학교(총장 김상동) ITA 융합대학원 한영기 교수 연구팀과 공동연구를 통해 살아 있는 세포를 전자현미경을 통해 실시간으로 관찰하는 데 성공했다고 29일 밝혔다.
이번 연구를 통해 살아 있는 다양한 세포의 실시간 분자 단위 관찰이 가능해져, 그동안 관찰하지 못했던 살아 있는 세포의 전이·감염에 관한 전 과정을 규명할 수 있게 돼 신약 개발 등을 더욱 촉진할 수 있을 것으로 기대된다.
신소재공학과 구건모 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `나노 레터스(Nano Letters)' 5월 5일 字 온라인판에 게재됐으며 6월 호 표지논문으로 선정됐다. (논문명: Live-Cell Electron Microscopy Using Graphene Veils)
전 세계적으로 대유행하고 있는 코로나바이러스감염증(COVID-19) 등은 수십~수백 나노미터(nm, 1 나노미터는 100만 분의 1밀리미터) 크기의 바이러스로 인해 일어나는 질병이다. 바이러스의 전이·감염 과정을 분석하고 이에 대처하는 신약 개발을 위해서는 바이러스의 미시적인 행동을 실시간으로 관찰하는 것이 매우 중요하다.
수십~수백 나노미터 크기의 바이러스 등을 비롯해 세포와 세포를 이루는 기관들은 가시광선을 이용하는 일반 광학현미경으로는 관찰이 어려워 해상력이 매우 높은 전자선을 이용하는 전자현미경 기술을 이용한다.
그렇지만 전자현미경 기술은 효율적인 작동을 위해 매우 강력한 진공상태가 필요하며 또 가시광선보다 수천 배 이상 높은 에너지를 가지는 전자를 이용하기 때문에 관찰 시 세포의 구조적인 손상이 불가피하다. 따라서 현재로서는 2017년 노벨화학상을 수상한 기술인 극저온 전자현미경을 통해 고정 작업 및 안정화 작업을 거친 표본만 관찰이 가능하다.
최근 학계에서는 사멸해 고정된 것이 아닌 온전한 상태의 살아 있는 세포등 다양한 생체물질을 전자현미경을 이용해 분자 단위로 관찰 가능한지에 대한 논쟁이 전개되고 있다. 육 교수 연구팀은 지난 2012년 개발한 그래핀 액상 셀 전자현미경 기술을 응용해 전자현미경으로도 살아있는 대장균 세포를 관찰하는데 성공했고, 이를 재배양시킴으로써 전자와 진공에 노출됐음에도 불구하고 대장균 세포가 생존한다는 사실을 밝혀냈다.
육 교수 연구팀이 이번 연구에서 활용한 그래핀은 층상 구조인 흑연에서 분리하는 등의 방법으로 얻어내는 약 0.2 나노미터(nm) 두께의 원자 막이다. 여러 분야에서 차세대 소재로 주목받고 있는 그래핀은 강철보다 200배 강한 강도와 높은 전기 전도성을 가지며, 물질을 투과시키지 않는 성질을 가진다. 육 교수 연구팀은 이러한 그래핀 성질을 이용, 세포 등을 액체와 함께 감싸주면, 고진공의 전자현미경 내부에서 탈수에 의한 세포의 구조변화를 막아줄 수 있음을 밝혀냈다. 뿐만 아니라, 그래핀이 전자빔에 의해 공격성이 높아진 활성 산소들을 분해하는 효과도 지니고 있어 그래핀으로 덮어주지 않은 세포보다 100배 강한 전자에 노출되더라도 세포가 활성을 잃지 않는다는 결과를 확인했다.
육 교수는 "이번 연구 결과는 세포보다 더 작은 단백질이나 DNA의 실시간 전자현미경 관찰로까지 확대될 수 있어, 앞으로 다양한 생명 현상의 기작을 근본적으로 밝힐 수 있을 것이라 기대한다ˮ고 밝혔다.
한편, 이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
2020.06.29 조회수 22645 항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
2020.06.16 조회수 25644
항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
2020.06.16 조회수 25644