-
 에탄이 온실가스 줄이고, 플라스틱도 만든다고요?
메탄은 이산화탄소(CO₂)보다 약 25배 강한 온실가스로, 기후변화 대응에서 가장 시급한 감축 대상 중 하나로 천연가스, 매립지 가스, 축산·폐수 처리 등 다양한 배출원에서 종종 에탄과 혼합된 형태로 존재한다. 천연가스 중 에탄도 큰 비중을 차지하며, 메탄 다음으로 최대 15%까지 포함돼 있다. 우리 연구진이 에탄이 이런 메탄을 에너지원으로 사용하는 ‘편성 메탄산화균’의 대사에 영향을 줘서 메탄을 저감시키고 바이오플라스틱 생산에 활용할 가능성을 제시했다.
우리 대학 건설및환경공학과 명재욱 교수 연구팀이 미국 스탠퍼드 대학교와의 공동연구를 통해, 천연가스의 주요 부성분인 에탄(C2H6)이 ‘편성 메탄산화균(Methylosinus trichosporium OB3b)’의 핵심 대사에 미치는 영향을 규명했다고 7일 밝혔다.
메탄산화균은 산소가 있는 조건에서 메탄을 에너지원으로 사용해 생장할 수 있는 세균으로, 이 중 ‘편성(obligate) 메탄산화균’은 메탄이나 메탄올과 같은 C1 화합물만을 성장 기질로 활용하는 것이 특징이다. 지금까지 이러한 편성 메탄산화균이 비(非)성장 기질인 에탄에 어떻게 반응하는지에 대한 연구는 이뤄지지 않았다.
연구팀은 이번 연구에서는 C2 기질인 에탄이 성장 기질로 사용되지 않음에도 불구하고, 편성 메탄산화균의 메탄 산화, 세포 성장, 생분해성 고분자인 폴리하이드록시부티레이트(Polyhydroxybutyrate, 이하 PHB) 합성 등 주요 대사 경로에 유의미한 영향을 미친다는 사실을 밝혀냈다.
연구팀이 다양한 메탄 및 산소 농도 조건에서 에탄을 첨가해 메탄산화균을 배양한 결과, ▲세포 성장 억제 ▲메탄 소비 감소 ▲PHB 합성 증가의 세 가지 대사 반응이 일관되게 나타났으며, 이러한 변화는 에탄 농도가 증가할수록 더욱 두드려졌다.
이번 연구에 따르면, 에탄은 단독으로는 메탄산화균에서 반응하지 않으며, 세균 역시 에탄만 주어졌을 때는 성장하지 않는다. 그러나 메탄과 함께 존재할 경우, 메탄을 산화하는 핵심 효소 ‘입자상 메탄모노옥시게네이스(pMMO)’를 통해 에탄이 함께 산화되는 ‘동시 산화(co-oxidation)’현상이 관찰됐다.
에탄이 산화되는 과정에서 생성되는 중간 대사산물 ‘아세테이트(acetate)’는 메탄산화균의 세포 성장을 억제하는 동시에, PHB(Polyhydroxybutyrate) 생산을 촉진하는 것으로 나타났다. PHB는 생분해성 바이오플라스틱의 원료로 주목받는 고분자 물질이다.
이러한 작용은 균이 처한 영양 상태에 따라 상반된 양상을 보인다. 영양이 충분한 상태에서는 에탄이 세포 성장에 부정적인 영향을 미치지만, 영양 불균형 상태에서는 오히려 PHB 축적을 유도해 긍정적인 효과를 나타낸다.
한편, 에탄을 첨가했을 때 메탄의 소비량은 감소했지만, 메탄 분해 효소인 pMMO를 구성하는 pmoA 유전자의 발현량에는 유의미한 변화가 없었다. 이는 에탄이 유전자의 전사(transcription) 수준에서는 영향을 미치지 않으며, 대신 효소의 실제 작동 능력(활성 수준)이나 전사 이후 조절 단계에서 영향을 준다는 사실을 입증한다.
연구팀은 에탄이 메탄산화균의 대사 흐름을 간접적으로 조절하는 조절자 역할을 하며, 메탄과 함께 있을 때 의도치 않은 방식으로 세포 성장과 PHB 생산에 영향을 미친다고 분석했다.
명재욱 교수는 “이번 연구는 ‘편성 메탄산화균’이 단일 기질 환경이 아닌 에탄과의 복합 기질 조건에서 어떻게 대사적으로 반응하는지를 체계적으로 규명한 최초의 사례”라며, “에탄과 같은 비성장 기질이 메탄 대사와 생분해성 고분자 생산에 미치는 영향을 밝힘으로써, 생물학적 메탄 저감 기술뿐 아니라 바이오플라스틱 생산에도 새로운 가능성을 제시한다”라고 전했다.
건설및환경공학과 박사과정 박선호 학생이 제1 저자인 이번 연구는 환경미생물학 및 생명공학 분야의 권위 있는 미국미생물학회(American Society for Microbiology) 학회지인 국제 학술지 응용 환경미생물학(Applied and Environmental Microbiology)에 7월 10일 자로 게재됐다.
※ 논문명: Non-growth substrate ethane perturbs core methanotrophy in obligate methanotroph Methylosinus trichosporium OB3b upon nutrient availability
(저자 정보 : 박선호(KAIST, 제1 저자), Chungheon Shin(Standford University), Craig S. Criddle (Standford University), 명재욱(KAIST, 교신저자) 총 4명)
※ DOI: 10.1128/aem.00969-25
한편, 이번 연구는 한국연구재단, 국토교통부, 해양수산부의 지원을 받아 수행됐다.
에탄이 온실가스 줄이고, 플라스틱도 만든다고요?
메탄은 이산화탄소(CO₂)보다 약 25배 강한 온실가스로, 기후변화 대응에서 가장 시급한 감축 대상 중 하나로 천연가스, 매립지 가스, 축산·폐수 처리 등 다양한 배출원에서 종종 에탄과 혼합된 형태로 존재한다. 천연가스 중 에탄도 큰 비중을 차지하며, 메탄 다음으로 최대 15%까지 포함돼 있다. 우리 연구진이 에탄이 이런 메탄을 에너지원으로 사용하는 ‘편성 메탄산화균’의 대사에 영향을 줘서 메탄을 저감시키고 바이오플라스틱 생산에 활용할 가능성을 제시했다.
우리 대학 건설및환경공학과 명재욱 교수 연구팀이 미국 스탠퍼드 대학교와의 공동연구를 통해, 천연가스의 주요 부성분인 에탄(C2H6)이 ‘편성 메탄산화균(Methylosinus trichosporium OB3b)’의 핵심 대사에 미치는 영향을 규명했다고 7일 밝혔다.
메탄산화균은 산소가 있는 조건에서 메탄을 에너지원으로 사용해 생장할 수 있는 세균으로, 이 중 ‘편성(obligate) 메탄산화균’은 메탄이나 메탄올과 같은 C1 화합물만을 성장 기질로 활용하는 것이 특징이다. 지금까지 이러한 편성 메탄산화균이 비(非)성장 기질인 에탄에 어떻게 반응하는지에 대한 연구는 이뤄지지 않았다.
연구팀은 이번 연구에서는 C2 기질인 에탄이 성장 기질로 사용되지 않음에도 불구하고, 편성 메탄산화균의 메탄 산화, 세포 성장, 생분해성 고분자인 폴리하이드록시부티레이트(Polyhydroxybutyrate, 이하 PHB) 합성 등 주요 대사 경로에 유의미한 영향을 미친다는 사실을 밝혀냈다.
연구팀이 다양한 메탄 및 산소 농도 조건에서 에탄을 첨가해 메탄산화균을 배양한 결과, ▲세포 성장 억제 ▲메탄 소비 감소 ▲PHB 합성 증가의 세 가지 대사 반응이 일관되게 나타났으며, 이러한 변화는 에탄 농도가 증가할수록 더욱 두드려졌다.
이번 연구에 따르면, 에탄은 단독으로는 메탄산화균에서 반응하지 않으며, 세균 역시 에탄만 주어졌을 때는 성장하지 않는다. 그러나 메탄과 함께 존재할 경우, 메탄을 산화하는 핵심 효소 ‘입자상 메탄모노옥시게네이스(pMMO)’를 통해 에탄이 함께 산화되는 ‘동시 산화(co-oxidation)’현상이 관찰됐다.
에탄이 산화되는 과정에서 생성되는 중간 대사산물 ‘아세테이트(acetate)’는 메탄산화균의 세포 성장을 억제하는 동시에, PHB(Polyhydroxybutyrate) 생산을 촉진하는 것으로 나타났다. PHB는 생분해성 바이오플라스틱의 원료로 주목받는 고분자 물질이다.
이러한 작용은 균이 처한 영양 상태에 따라 상반된 양상을 보인다. 영양이 충분한 상태에서는 에탄이 세포 성장에 부정적인 영향을 미치지만, 영양 불균형 상태에서는 오히려 PHB 축적을 유도해 긍정적인 효과를 나타낸다.
한편, 에탄을 첨가했을 때 메탄의 소비량은 감소했지만, 메탄 분해 효소인 pMMO를 구성하는 pmoA 유전자의 발현량에는 유의미한 변화가 없었다. 이는 에탄이 유전자의 전사(transcription) 수준에서는 영향을 미치지 않으며, 대신 효소의 실제 작동 능력(활성 수준)이나 전사 이후 조절 단계에서 영향을 준다는 사실을 입증한다.
연구팀은 에탄이 메탄산화균의 대사 흐름을 간접적으로 조절하는 조절자 역할을 하며, 메탄과 함께 있을 때 의도치 않은 방식으로 세포 성장과 PHB 생산에 영향을 미친다고 분석했다.
명재욱 교수는 “이번 연구는 ‘편성 메탄산화균’이 단일 기질 환경이 아닌 에탄과의 복합 기질 조건에서 어떻게 대사적으로 반응하는지를 체계적으로 규명한 최초의 사례”라며, “에탄과 같은 비성장 기질이 메탄 대사와 생분해성 고분자 생산에 미치는 영향을 밝힘으로써, 생물학적 메탄 저감 기술뿐 아니라 바이오플라스틱 생산에도 새로운 가능성을 제시한다”라고 전했다.
건설및환경공학과 박사과정 박선호 학생이 제1 저자인 이번 연구는 환경미생물학 및 생명공학 분야의 권위 있는 미국미생물학회(American Society for Microbiology) 학회지인 국제 학술지 응용 환경미생물학(Applied and Environmental Microbiology)에 7월 10일 자로 게재됐다.
※ 논문명: Non-growth substrate ethane perturbs core methanotrophy in obligate methanotroph Methylosinus trichosporium OB3b upon nutrient availability
(저자 정보 : 박선호(KAIST, 제1 저자), Chungheon Shin(Standford University), Craig S. Criddle (Standford University), 명재욱(KAIST, 교신저자) 총 4명)
※ DOI: 10.1128/aem.00969-25
한편, 이번 연구는 한국연구재단, 국토교통부, 해양수산부의 지원을 받아 수행됐다.
2025.08.07
조회수 485
-
 스스로 물체를 집고, 걷는 '실시간 프로그래밍 로봇 시트' 개발
접힘 구조는 로봇 설계에서 직관적이면서도 효율적인 형상 변형 메커니즘으로 활용되며, 우주·항공 로봇, 유연 로봇, 접이식 그리퍼(손) 등 다양한 응용이 시도되고 있다. 그러나 기존의 접힘 메커니즘은 접는 위치(hinge)나 방향이 사전에 고정돼 있어, 환경과 작업이 바뀔 때마다 구조를 새로 설계·제작해야 하는 한계가 있었다. 한국 연구진이 실시간으로 현장에 따라 프로그래밍하는‘접이식 로봇 시트 기술’을 개발해 로봇의 형태 변화 능력을 획기적으로 향상함으로써, 향후 로봇 공학 분야에 새로운 가능성을 열어줄 것으로 기대된다.
우리 대학 기계공학과 김정 교수, 박인규 교수 공동 연구팀이 형상을 실시간으로 프로그래밍할 수 있는 로봇 시트 원천 기술(field-programmable robotic folding sheet)을 개발했다고 6일 밝혔다.
이번 기술은 ‘필드 프로그래밍(field-programmability)’이라는 개념을 접이식 구조에 성공적으로 도입한 사례로, ‘접힘을 어디서, 어느 방향으로, 얼마나 크게 할지’라는 사용자의 명령을 소재 형상에 실시간으로 반영할 수 있는 소재 기술 및 프로그래밍 방법론을 통합적으로 제안했다.
해당 ‘로봇 시트’는 얇고 유연한 고분자 기판 내에 미세 금속 저항 네트워크가 내장된 구조로, 각 금속 저항이 히터이자 온도 센서 역할을 동시에 수행해, 별도의 외부 장치 없이도 시트의 접힘 상태를 실시간으로 감지하고 제어한다.
또한 유전 알고리즘(genetic algorithm) 및 심층 신경망(deep neural network)을 결합한 소프트웨어를 통해 사용자가 원하는 접힘 위치와 방향, 강도를 소프트웨어적으로 입력하면, 스스로 가열·냉각을 반복하며 정확한 형상을 만들어낸다.
특히, 온도 분포에 대한 폐루프 제어(closed-loop control)를 적용해 실시간 접힘 정밀성을 향상하고, 환경 변화로 인한 영향을 보정했으며, 열 변형 기반 접힘 기술이 지니던 느린 반응 속도 문제도 개선했다.
이러한 형상의 실시간 프로그래밍은 복잡한 하드웨어 재설계 없이도 다양한 로봇의 기능성을 즉석에서 구현할 수 있게 했다는 데에 의미가 있다.
실제로 연구팀은 단일 소재로 다양한 물체 형상에 맞춰 어떻게 잡을지 결정하는 파지(grasping) 전략을 바꿔가며 적용할 수 있는 적응형 로봇 손(그리퍼)를 구현했고, 동일한 ‘로봇 시트(얇고 유연한 형태의 로봇)’를 바닥에 두어 보행하거나 기어가게 하는 등 생체 모방적 이동 전략을 선보였다. 이를 통해 환경 변화에 따라 스스로 형태를 바꾸는 환경 적응형 자율 로봇으로의 확장 가능성도 제시했다.
김정 교수는 “이번 연구는 자기 몸을 바꾸면서 똑똑하게 움직이는 기술 즉, 형상 자체가 지능이 되는‘형상 지능(morphological intelligence)’구현에 한 걸음 다가간 사례로 평가된다. 향후 더 높은 하중 지지와 빠른 냉각을 위한 소재·구조 개선, 배선 없는 일체형 전극에도 다양한 형태·크기로의 확장 등을 통해 재난 현장 대응 로봇, 맞춤형 의료 보조기기, 우주 탐사 장비 등 다양한 분야에 응용될 수 있는 차세대 피지컬 AI 플랫폼으로 발전시킬 계획이다”라고 말했다.
우리 대학 박현규 박사(現 삼성전자 삼성종합기술원)와 정용록 교수(現 경북대학교)가 공동 제1 저자인 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’에 2025년 8월 온라인판에 출판됐다.
※논문명: Field-programmable robotic folding sheet
※DOI: https://www.nature.com/articles/s41467-025-61838-3
한편 이번 연구는 한국연구재단(과학기술정보통신부)의 지원을 받아 수행됐다.
스스로 물체를 집고, 걷는 '실시간 프로그래밍 로봇 시트' 개발
접힘 구조는 로봇 설계에서 직관적이면서도 효율적인 형상 변형 메커니즘으로 활용되며, 우주·항공 로봇, 유연 로봇, 접이식 그리퍼(손) 등 다양한 응용이 시도되고 있다. 그러나 기존의 접힘 메커니즘은 접는 위치(hinge)나 방향이 사전에 고정돼 있어, 환경과 작업이 바뀔 때마다 구조를 새로 설계·제작해야 하는 한계가 있었다. 한국 연구진이 실시간으로 현장에 따라 프로그래밍하는‘접이식 로봇 시트 기술’을 개발해 로봇의 형태 변화 능력을 획기적으로 향상함으로써, 향후 로봇 공학 분야에 새로운 가능성을 열어줄 것으로 기대된다.
우리 대학 기계공학과 김정 교수, 박인규 교수 공동 연구팀이 형상을 실시간으로 프로그래밍할 수 있는 로봇 시트 원천 기술(field-programmable robotic folding sheet)을 개발했다고 6일 밝혔다.
이번 기술은 ‘필드 프로그래밍(field-programmability)’이라는 개념을 접이식 구조에 성공적으로 도입한 사례로, ‘접힘을 어디서, 어느 방향으로, 얼마나 크게 할지’라는 사용자의 명령을 소재 형상에 실시간으로 반영할 수 있는 소재 기술 및 프로그래밍 방법론을 통합적으로 제안했다.
해당 ‘로봇 시트’는 얇고 유연한 고분자 기판 내에 미세 금속 저항 네트워크가 내장된 구조로, 각 금속 저항이 히터이자 온도 센서 역할을 동시에 수행해, 별도의 외부 장치 없이도 시트의 접힘 상태를 실시간으로 감지하고 제어한다.
또한 유전 알고리즘(genetic algorithm) 및 심층 신경망(deep neural network)을 결합한 소프트웨어를 통해 사용자가 원하는 접힘 위치와 방향, 강도를 소프트웨어적으로 입력하면, 스스로 가열·냉각을 반복하며 정확한 형상을 만들어낸다.
특히, 온도 분포에 대한 폐루프 제어(closed-loop control)를 적용해 실시간 접힘 정밀성을 향상하고, 환경 변화로 인한 영향을 보정했으며, 열 변형 기반 접힘 기술이 지니던 느린 반응 속도 문제도 개선했다.
이러한 형상의 실시간 프로그래밍은 복잡한 하드웨어 재설계 없이도 다양한 로봇의 기능성을 즉석에서 구현할 수 있게 했다는 데에 의미가 있다.
실제로 연구팀은 단일 소재로 다양한 물체 형상에 맞춰 어떻게 잡을지 결정하는 파지(grasping) 전략을 바꿔가며 적용할 수 있는 적응형 로봇 손(그리퍼)를 구현했고, 동일한 ‘로봇 시트(얇고 유연한 형태의 로봇)’를 바닥에 두어 보행하거나 기어가게 하는 등 생체 모방적 이동 전략을 선보였다. 이를 통해 환경 변화에 따라 스스로 형태를 바꾸는 환경 적응형 자율 로봇으로의 확장 가능성도 제시했다.
김정 교수는 “이번 연구는 자기 몸을 바꾸면서 똑똑하게 움직이는 기술 즉, 형상 자체가 지능이 되는‘형상 지능(morphological intelligence)’구현에 한 걸음 다가간 사례로 평가된다. 향후 더 높은 하중 지지와 빠른 냉각을 위한 소재·구조 개선, 배선 없는 일체형 전극에도 다양한 형태·크기로의 확장 등을 통해 재난 현장 대응 로봇, 맞춤형 의료 보조기기, 우주 탐사 장비 등 다양한 분야에 응용될 수 있는 차세대 피지컬 AI 플랫폼으로 발전시킬 계획이다”라고 말했다.
우리 대학 박현규 박사(現 삼성전자 삼성종합기술원)와 정용록 교수(現 경북대학교)가 공동 제1 저자인 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’에 2025년 8월 온라인판에 출판됐다.
※논문명: Field-programmable robotic folding sheet
※DOI: https://www.nature.com/articles/s41467-025-61838-3
한편 이번 연구는 한국연구재단(과학기술정보통신부)의 지원을 받아 수행됐다.
2025.08.06
조회수 634
-
 주변 빛에너지로 24시간 건강 모니터링이 가능하다고?
심박수, 혈중산소포화도, 땀 성분 분석 등 지속적인 건강 모니터링을 위한 의료용 웨어러블 기기의 소형화와 경량화는 여전히 큰 도전 과제다. 특히 광학 센서는 LED 구동과 무선 전송에 많은 전력을 소모해 무겁고 부피가 큰 배터리를 필요로 한다. 이런 한계를 극복하기 위해 우리 연구진은 주변 빛을 에너지원으로 활용하고, 전력 상황에 따라 최적화된 관리를 통해 24시간 연속 측정이 가능한 차세대 웨어러블 플랫폼을 개발했다.
우리 대학 전기및전자공학부 권경하 교수팀이 미국 노스웨스턴대학교 박찬호 박사팀과 공동연구를 통해, 주변 빛을 활용해 배터리 전력 부담을 줄인 적응형 무선 웨어러블 플랫폼을 개발했다고 30일 밝혔다.
의료용 웨어러블 기기의 배터리 문제를 해결하기 위해, 권경하 교수 연구팀은 주변의 자연광을 에너지원으로 활용하는 혁신적인 플랫폼을 개발했다. 이 플랫폼은 세 가지 상호 보완적인 빛 에너지 기술을 통합한 것이 특징이다.
첫 번째 핵심 기술인 ‘광 측정 방식(Photometric Method)’은 주변 광원의 세기에 따라 LED 밝기를 적응적으로 조절하는 기술이다. 주변 자연광과 LED 빛을 합쳐 일정한 총 조명량을 유지하되, 자연광이 강할 때는 LED를 어둡게, 자연광이 약할 때는 LED를 밝게 자동 조절한다.
기존 센서가 환경과 관계없이 LED를 일정하게 켜야 했다면, 이 기술은 주변 환경에 맞춰 LED 전력을 실시간으로 최적화할 수 있다. 실험 결과, 충분한 조명 환경에서 전력 소모를 86.22%나 줄였다.
두 번째는 ‘고효율 다접합 태양전지(Photovoltaic Method)’ 기술이다. 이는 단순한 태양광 발전을 넘어서 실내외 모든 환경의 빛을 전력으로 변환한다. 특히 적응형 전력 관리 시스템을 통해 주변 환경과 배터리 상태에 따라 11가지 서로 다른 전력 구성으로 자동 전환되어 최적의 에너지 효율을 달성한다.
세 번째 혁신 기술은 ‘축광/발광(Photoluminescent Method)’기술이다. 스트론튬 알루미네이트 미세입자*를 센서의 실리콘 캡슐화 구조에 혼합해, 낮 동안 주변 빛을 흡수해 저장했다가 어둠 속에서 서서히 방출한다. 이를 통해 태양광 500W/m²에 10분간 노출되면 완전한 어둠에서도 2.5분간 연속 측정이 가능하다.
*스트론튬 알루미네이트 미세입자: 야광페인트나 안전 표지판에 사용되는 형광체로, 빛을 흡수한 후 어둠 속에서 오랫동안 발광하는 축광 소재
이 세 가지 기술이 상호 보완적으로 작동해 밝은 환경에서는 첫 번째와 두 번째 방식이, 어두운 환경에서는 세 번째 방식이 추가로 지원하는 방식으로 24시간 연속 작동을 가능하게 한다.
연구팀은 이 플랫폼을 다양한 의료 센서에 적용해 실용성을 검증했다. 광용적맥파 측정 센서는 심박수와 혈중산소포화도를 실시간으로 모니터링해 심혈관 질환의 조기 발견을 가능하게 한다. 청색광 노출량 측정 센서는 피부 노화와 손상을 유발하는 블루라이트를 정확히 측정해 개인 맞춤형 피부 보호 가이드를 제공한다. 땀 분석 센서는 마이크로 유체 기술을 활용, 땀 속 염분, 포도당, pH를 동시에 분석해 탈수나 전해질 불균형을 실시간으로 감지할 수 있다.
추가적으로 센서 내 데이터 처리 기술을 도입해 무선 통신으로 인한 전력 소모도 대폭 줄였다. 기존에는 모든 원시 데이터를 외부로 전송해야 했지만, 이제는 센서 내부에서 필요한 결과만 계산해 전송함으로써 데이터 전송량을 400B/s에서 4B/s로 100배 감소시켰다.
연구팀은 성능 검증을 위해 건강한 성인 피험자를 대상으로 밝은 실내조명, 어두운 조명, 적외선 조명, 완전한 어둠 등 4가지 서로 다른 환경에서 테스트했다. 그 결과, 모든 조건에서 상용 의료기기와 동등한 측정 정확도를 보였다. 생쥐 모델을 이용한 저산소 상태 실험에서도 정확한 혈중산소포화도 측정이 가능함을 확인했다.
연구를 주도한 권경하 교수는 “이 기술을 활용해 24시간 연속 건강 모니터링이 가능해짐에 따라 의료 패러다임이 치료 중심에서 예방 중심으로 전환될 수 있을 것”이라며, “조기 진단을 통한 의료비 절감 효과와 함께 차세대 웨어러블 헬스케어 시장에서의 기술경쟁력 확보도 기대된다”라고 말했다.
이번 연구 결과는 인공지능반도체대학원 박도윤 박사과정 학생이 공동 제 1 저자로 국제 학술지 네이처 커뮤니케이션스(Nature Communications)에 7월 1일 발표됐다.
※논문명 : Adaptive Electronics for Photovoltaic, Photoluminescent and Photometric Methods in Power Harvesting for Wireless and Wearable Sensors;
※DOI: URL: https://www.nature.com/articles/s41467-025-60911-1
한편, 이번 연구는 한국연구재단 우수신진연구, 지역혁신 선도연구센터 과제, 과학기술정보통신부 정보통신기획평가원(IITP) 인공지능반도체대학원 과제, 그리고 BK FOUR 프로그램(Connected AI Education & Research Program for Industry and Society Innovation, KAIST EE)의 지원을 받아 수행됐다.
주변 빛에너지로 24시간 건강 모니터링이 가능하다고?
심박수, 혈중산소포화도, 땀 성분 분석 등 지속적인 건강 모니터링을 위한 의료용 웨어러블 기기의 소형화와 경량화는 여전히 큰 도전 과제다. 특히 광학 센서는 LED 구동과 무선 전송에 많은 전력을 소모해 무겁고 부피가 큰 배터리를 필요로 한다. 이런 한계를 극복하기 위해 우리 연구진은 주변 빛을 에너지원으로 활용하고, 전력 상황에 따라 최적화된 관리를 통해 24시간 연속 측정이 가능한 차세대 웨어러블 플랫폼을 개발했다.
우리 대학 전기및전자공학부 권경하 교수팀이 미국 노스웨스턴대학교 박찬호 박사팀과 공동연구를 통해, 주변 빛을 활용해 배터리 전력 부담을 줄인 적응형 무선 웨어러블 플랫폼을 개발했다고 30일 밝혔다.
의료용 웨어러블 기기의 배터리 문제를 해결하기 위해, 권경하 교수 연구팀은 주변의 자연광을 에너지원으로 활용하는 혁신적인 플랫폼을 개발했다. 이 플랫폼은 세 가지 상호 보완적인 빛 에너지 기술을 통합한 것이 특징이다.
첫 번째 핵심 기술인 ‘광 측정 방식(Photometric Method)’은 주변 광원의 세기에 따라 LED 밝기를 적응적으로 조절하는 기술이다. 주변 자연광과 LED 빛을 합쳐 일정한 총 조명량을 유지하되, 자연광이 강할 때는 LED를 어둡게, 자연광이 약할 때는 LED를 밝게 자동 조절한다.
기존 센서가 환경과 관계없이 LED를 일정하게 켜야 했다면, 이 기술은 주변 환경에 맞춰 LED 전력을 실시간으로 최적화할 수 있다. 실험 결과, 충분한 조명 환경에서 전력 소모를 86.22%나 줄였다.
두 번째는 ‘고효율 다접합 태양전지(Photovoltaic Method)’ 기술이다. 이는 단순한 태양광 발전을 넘어서 실내외 모든 환경의 빛을 전력으로 변환한다. 특히 적응형 전력 관리 시스템을 통해 주변 환경과 배터리 상태에 따라 11가지 서로 다른 전력 구성으로 자동 전환되어 최적의 에너지 효율을 달성한다.
세 번째 혁신 기술은 ‘축광/발광(Photoluminescent Method)’기술이다. 스트론튬 알루미네이트 미세입자*를 센서의 실리콘 캡슐화 구조에 혼합해, 낮 동안 주변 빛을 흡수해 저장했다가 어둠 속에서 서서히 방출한다. 이를 통해 태양광 500W/m²에 10분간 노출되면 완전한 어둠에서도 2.5분간 연속 측정이 가능하다.
*스트론튬 알루미네이트 미세입자: 야광페인트나 안전 표지판에 사용되는 형광체로, 빛을 흡수한 후 어둠 속에서 오랫동안 발광하는 축광 소재
이 세 가지 기술이 상호 보완적으로 작동해 밝은 환경에서는 첫 번째와 두 번째 방식이, 어두운 환경에서는 세 번째 방식이 추가로 지원하는 방식으로 24시간 연속 작동을 가능하게 한다.
연구팀은 이 플랫폼을 다양한 의료 센서에 적용해 실용성을 검증했다. 광용적맥파 측정 센서는 심박수와 혈중산소포화도를 실시간으로 모니터링해 심혈관 질환의 조기 발견을 가능하게 한다. 청색광 노출량 측정 센서는 피부 노화와 손상을 유발하는 블루라이트를 정확히 측정해 개인 맞춤형 피부 보호 가이드를 제공한다. 땀 분석 센서는 마이크로 유체 기술을 활용, 땀 속 염분, 포도당, pH를 동시에 분석해 탈수나 전해질 불균형을 실시간으로 감지할 수 있다.
추가적으로 센서 내 데이터 처리 기술을 도입해 무선 통신으로 인한 전력 소모도 대폭 줄였다. 기존에는 모든 원시 데이터를 외부로 전송해야 했지만, 이제는 센서 내부에서 필요한 결과만 계산해 전송함으로써 데이터 전송량을 400B/s에서 4B/s로 100배 감소시켰다.
연구팀은 성능 검증을 위해 건강한 성인 피험자를 대상으로 밝은 실내조명, 어두운 조명, 적외선 조명, 완전한 어둠 등 4가지 서로 다른 환경에서 테스트했다. 그 결과, 모든 조건에서 상용 의료기기와 동등한 측정 정확도를 보였다. 생쥐 모델을 이용한 저산소 상태 실험에서도 정확한 혈중산소포화도 측정이 가능함을 확인했다.
연구를 주도한 권경하 교수는 “이 기술을 활용해 24시간 연속 건강 모니터링이 가능해짐에 따라 의료 패러다임이 치료 중심에서 예방 중심으로 전환될 수 있을 것”이라며, “조기 진단을 통한 의료비 절감 효과와 함께 차세대 웨어러블 헬스케어 시장에서의 기술경쟁력 확보도 기대된다”라고 말했다.
이번 연구 결과는 인공지능반도체대학원 박도윤 박사과정 학생이 공동 제 1 저자로 국제 학술지 네이처 커뮤니케이션스(Nature Communications)에 7월 1일 발표됐다.
※논문명 : Adaptive Electronics for Photovoltaic, Photoluminescent and Photometric Methods in Power Harvesting for Wireless and Wearable Sensors;
※DOI: URL: https://www.nature.com/articles/s41467-025-60911-1
한편, 이번 연구는 한국연구재단 우수신진연구, 지역혁신 선도연구센터 과제, 과학기술정보통신부 정보통신기획평가원(IITP) 인공지능반도체대학원 과제, 그리고 BK FOUR 프로그램(Connected AI Education & Research Program for Industry and Society Innovation, KAIST EE)의 지원을 받아 수행됐다.
2025.07.31
조회수 761
-
 빛으로 단백질 · mRNA를 원할 때 꺼내 쓴다
기존의 ‘광유전학적 분자 응축물 기술(생체 분자를 빛을 사용해 특정한 덩어리(응축체)로 뭉치게 하거나 풀리게 조절하는 기술)’은 세포 안에서 여러 단백질이나 RNA가 다양하게 섞이기 때문에 원하는 분자만 골라서 다루기 어렵다는 한계가 있었다. 이 한계를 넘어, 우리 연구진이 ‘빛’을 쪼여 세포 속 특정 단백질이나 유전정보(mRNA)를 원하는 시점에 꺼내 쓸 수 있는 기술을 개발하여 유전자 조절 기술, 신약 개발 등에서의 새로운 가능성을 제시했다.
우리 대학 생명과학과 허원도 석좌교수 연구팀이 물리학과 박용근 석좌교수 연구팀과 협력하여, 단백질 및 mRNA를 세포 내에서 빛으로 원하는 시점에 저장(Store)하고 방출(Release)할 수 있는 ‘릴리저 기술(RELISR, REversible Light-Induced Store and Release)’을 개발했다고 23일 밝혔다.
이번 연구는 세포 내 다양한 생체 분자가 막이 없는 응축체(Biomolecular Condensate)에 저장돼 기능을 조절한다는 최신 세포기능 조절 원리를 빛으로 구현한 기술이다.
연구팀은 특정 분자와 선택적으로 결합하는 표적 부위가 부착된 광유전학 단백질 복합체를 증폭해, 빛 반응 분자 저장·방출 시스템인 릴리저 기술을 설계했다. 이를 통해 세포 및 생체 내에서 특정 단백질 혹은 mRNA를 릴리저에 안정적으로 저장해 빛을 비추면 원하는 시점에 방출할 수 있음을 증명했다.
연구팀은 다양한 세포주와 신경세포, 그리고 생쥐 간 조직 등에서 해당 시스템의 효과를 입증했다.
연구팀은 단백질을 저장⸱방출하는 단백질 방출시스템인 ‘단백질 릴리저 (Protein-RELISR)’를 통해 세포 모양 변화, 신경세포 내 국소 단백질 활성 등 미세 환경에서의 생화학 반응을 실시간으로 제어하는 데 성공했다.
아울러, mRNA를 표적으로 하는 mRNA 방출시스템인‘mRNA 릴리저 (mRNA-RELISR)’를 활용해, mRNA가 세포질 내에서 번역될 시점을 빛으로 조절하는 데 성공했으며, 실제 생쥐 모델에서도 mRNA 번역 조절이 가능함을 확인했다.
빛으로 표적 분자를 순간적으로 ‘가두는’ 기존 연구 LARIAT(단백질 올가미, 2014), mRNA-LARIAT(mRNA 올가미, 2019)에서 나아가, 이번 연구에서는 동일한 광자극으로 세포 내 무막 응축체에 저장된 단백질과 mRNA를 즉시 ‘방출해’단백질의 기능을 복원하고 mRNA 번역을 활성화할 수 있는 새로운 플랫폼을 제시했다.
연구를 주도한 허원도 석좌교수는 “릴리저(RELISR) 플랫폼은 광유전학 원리를 기반으로 단백질과 mRNA를 원하는 시간, 장소에서 저장하고 방출할 수 있는 범용 도구로, 뇌 신경세포 연구나 세포치료제, 차세대 신약 개발 등에 폭넓게 응용될 수 있다”며 “향후 유전자 가위(CRISPR-Cas) 시스템 등과의 결합이나, 조직 특이적 전달 기술(AAV 등)과 접목할 경우, 더욱 정밀한 치료 도구로 확장될 수 있을 것”이라고 설명했다.
이번 연구는 생명과학과 허원도 석좌교수(교신저자)의 지도로, 이채연 박사(연구 당시 학생, 제1 저자)가 중심이 되어 연구를 수행했다. 공동 교신저자인 물리학과 유다슬이 박사와 박용근 석좌교수도 연구에 참여했으며, 특히 박용근 교수 연구팀은 이미징 기반 분석을 통해 세포 내에서 ‘릴리저(RELISR)’ 시스템이 유도하는 생물리학적 변화를 정량적으로 평가하고, 실험 결과의 신뢰성과 객관성을 높이는 데 중요한 역할을 담당했다.
생명과학연구소 이채연 박사가 제1 저자로 주도한 이 연구는 국제 학술지 ‘네이처 커뮤니케이션스(Nature Communications)’에 2025년 7월 7일자로 게재됐다.
논문명: Optogenetic storage and release of protein and mRNA in live cells and animals
DOI: 10.1038/s41467-025-61322-y
한편, 이번 연구는 삼성미래기술육성재단과 한국연구재단 유전자편집·제어·복원기반기술개발사업의 지원을 받아 수행됐다.
빛으로 단백질 · mRNA를 원할 때 꺼내 쓴다
기존의 ‘광유전학적 분자 응축물 기술(생체 분자를 빛을 사용해 특정한 덩어리(응축체)로 뭉치게 하거나 풀리게 조절하는 기술)’은 세포 안에서 여러 단백질이나 RNA가 다양하게 섞이기 때문에 원하는 분자만 골라서 다루기 어렵다는 한계가 있었다. 이 한계를 넘어, 우리 연구진이 ‘빛’을 쪼여 세포 속 특정 단백질이나 유전정보(mRNA)를 원하는 시점에 꺼내 쓸 수 있는 기술을 개발하여 유전자 조절 기술, 신약 개발 등에서의 새로운 가능성을 제시했다.
우리 대학 생명과학과 허원도 석좌교수 연구팀이 물리학과 박용근 석좌교수 연구팀과 협력하여, 단백질 및 mRNA를 세포 내에서 빛으로 원하는 시점에 저장(Store)하고 방출(Release)할 수 있는 ‘릴리저 기술(RELISR, REversible Light-Induced Store and Release)’을 개발했다고 23일 밝혔다.
이번 연구는 세포 내 다양한 생체 분자가 막이 없는 응축체(Biomolecular Condensate)에 저장돼 기능을 조절한다는 최신 세포기능 조절 원리를 빛으로 구현한 기술이다.
연구팀은 특정 분자와 선택적으로 결합하는 표적 부위가 부착된 광유전학 단백질 복합체를 증폭해, 빛 반응 분자 저장·방출 시스템인 릴리저 기술을 설계했다. 이를 통해 세포 및 생체 내에서 특정 단백질 혹은 mRNA를 릴리저에 안정적으로 저장해 빛을 비추면 원하는 시점에 방출할 수 있음을 증명했다.
연구팀은 다양한 세포주와 신경세포, 그리고 생쥐 간 조직 등에서 해당 시스템의 효과를 입증했다.
연구팀은 단백질을 저장⸱방출하는 단백질 방출시스템인 ‘단백질 릴리저 (Protein-RELISR)’를 통해 세포 모양 변화, 신경세포 내 국소 단백질 활성 등 미세 환경에서의 생화학 반응을 실시간으로 제어하는 데 성공했다.
아울러, mRNA를 표적으로 하는 mRNA 방출시스템인‘mRNA 릴리저 (mRNA-RELISR)’를 활용해, mRNA가 세포질 내에서 번역될 시점을 빛으로 조절하는 데 성공했으며, 실제 생쥐 모델에서도 mRNA 번역 조절이 가능함을 확인했다.
빛으로 표적 분자를 순간적으로 ‘가두는’ 기존 연구 LARIAT(단백질 올가미, 2014), mRNA-LARIAT(mRNA 올가미, 2019)에서 나아가, 이번 연구에서는 동일한 광자극으로 세포 내 무막 응축체에 저장된 단백질과 mRNA를 즉시 ‘방출해’단백질의 기능을 복원하고 mRNA 번역을 활성화할 수 있는 새로운 플랫폼을 제시했다.
연구를 주도한 허원도 석좌교수는 “릴리저(RELISR) 플랫폼은 광유전학 원리를 기반으로 단백질과 mRNA를 원하는 시간, 장소에서 저장하고 방출할 수 있는 범용 도구로, 뇌 신경세포 연구나 세포치료제, 차세대 신약 개발 등에 폭넓게 응용될 수 있다”며 “향후 유전자 가위(CRISPR-Cas) 시스템 등과의 결합이나, 조직 특이적 전달 기술(AAV 등)과 접목할 경우, 더욱 정밀한 치료 도구로 확장될 수 있을 것”이라고 설명했다.
이번 연구는 생명과학과 허원도 석좌교수(교신저자)의 지도로, 이채연 박사(연구 당시 학생, 제1 저자)가 중심이 되어 연구를 수행했다. 공동 교신저자인 물리학과 유다슬이 박사와 박용근 석좌교수도 연구에 참여했으며, 특히 박용근 교수 연구팀은 이미징 기반 분석을 통해 세포 내에서 ‘릴리저(RELISR)’ 시스템이 유도하는 생물리학적 변화를 정량적으로 평가하고, 실험 결과의 신뢰성과 객관성을 높이는 데 중요한 역할을 담당했다.
생명과학연구소 이채연 박사가 제1 저자로 주도한 이 연구는 국제 학술지 ‘네이처 커뮤니케이션스(Nature Communications)’에 2025년 7월 7일자로 게재됐다.
논문명: Optogenetic storage and release of protein and mRNA in live cells and animals
DOI: 10.1038/s41467-025-61322-y
한편, 이번 연구는 삼성미래기술육성재단과 한국연구재단 유전자편집·제어·복원기반기술개발사업의 지원을 받아 수행됐다.
2025.07.23
조회수 1318
-
 대기 오염 저감 위한 신개념 원자 촉매 설계
백금 셀레나이드는 백금(Pt)과 셀레늄(Se)이 층상 구조로 결합된 이차원 물질로, 우수한 결정성과 층간 상호작용의 정밀한 제어를 통해 다양한 물리적·화학적 특성의 조절이 가능한 것으로 알려져 있다. 이러한 특성으로 인해, 반도체, 광검출기, 전기화학 소자 등 다양한 분야에서 활발히 연구되어 왔다. 이번 연구진은 백금 셀레나이드 표면에 존재하는 원자 수준의 백금이 기체 반응에 대해 촉매로 기능할 수 있다는 새로운 설계 개념을 제시했으며, 이를 통해 고효율 이산화탄소 전환 및 일산화탄소 저감 등을 위한 차세대 기체상 촉매 기술로서의 가능성을 입증했다.
우리 대학 화학과 박정영 석좌교수 연구팀이 충남대학교 김현유 교수, 미국 센트럴플로리다대학교(UCF) 정연웅 교수 연구팀과 공동연구를 통해, 이차원 전이금속 칼코겐화합물인 백금 셀레나이드(PtSe₂) 표면에 노출된 백금 원자를 활용하여 우수한 일산화탄소 산화 성능을 구현하는 데 성공했다고 22일 밝혔다.
연구진은 촉매 성능을 극대화하기 위해 기존의 백금 덩어리 촉매 형태에서 백금 원자가 고밀도로 표면에 분산되도록 하여, 더 적은 양의 백금으로 더 많은 촉매반응을 유도하였으며, 표면의 전자 구조를 제어하여 백금과 셀레늄 사이의 전자 상호작용을 활발하게 일어나도록 유도하였다. 이 과정을 통해 제작된 수 나노미터 두께의 백금 셀레나이드 박막은, 동일 조건에서 일반 백금 박막보다 전 온도 범위에서 더 우수한 일산화탄소 산화 성능을 나타냈다.
특히, 표면에서는 일산화탄소와 산소가 골고루 비슷한 비율로 흡착되어 서로 반응할 기회가 높아졌고, 이로 인해 촉매 반응이 크게 향상됐다. 이러한 성능 향상의 핵심은 ‘셀레늄 결손(Se-vacancy)’으로 인해 노출이 확대된 표면 백금 원자들이 드러나면서 기체들이 붙을 수 있는 흡착점도 늘어났다는 데 있다.
연구진은 해당 백금 원자들이 실제 반응 과정에서 흡착점으로 작용했다는 사실을 포항가속기연구소에서 수행된 상압 엑스선 광전자분광(AP-XPS) 분석을 통해 실시간으로 확인했다. 이러한 고정밀 분석은 1나노미터 수준의 표면을 상압 환경에서 관찰할 수 있는 고도 장비 덕분에 가능했다. 동시에 컴퓨터 시뮬레이션 (밀도범함수이론*) 계산을 통해, 백금 셀레나이드가 일반 백금과는 다른 전자 흐름의 특성을 가지고 있음을 이론적으로도 입증했다.
*밀도범함수이론(Density Functional Theory, DFT): 전자 밀도(electron density)를 기반으로 시스템의 전체 에너지를 계산하는 방법
박정영 교수는 “이번 연구는 기존 백금 촉매와 다른 이차원 층상 구조의 백금 셀레나이드를 활용해, 기체 반응에 특화된 촉매 기능을 이끌어낸 새로운 설계 전략을 제시한 것”이라며, “백금과 셀레늄 사이의 전자적 상호작용이 일산화탄소와 산소를 균형있게 흡착하는 반응 조건을 만들었고 기존 백금보다 전체 온도내에서 반응성이 높도록 설계하여 실제 적용성이 향상되게 하였다. 이로써 원자 단위 설계, 2차원 물질 플랫폼, 흡착 조절 기술 등을 통해 고효율 촉매 반응 메커니즘을 구현할 수 있었다”고 밝혔다.
이번 연구는 우리 대학 화학과 한규호 박사, 충남대 신소재공학과 최혁 박사, 인하대 김종훈 교수가 공동 제1 저자로 참여했으며, 세계적 권위의 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 지난 7월 3일 자로 게재됐다.
※ 논문 제목: Enhanced catalytic activity on atomically dispersed PtSe2 two-dimensional layers
※DOI: 10.1038/s41467-025-61320-0
한편, 이번 연구는 과학기술정보통신부의 중견연구자지원사업과 교육부의 중점연구소사업, 국가전략기술소재개발사업, 미국 국립과학재단(NSF) CAREER 프로그램, 인하대학교 연구비, UCF 박사후연구자 프로그램(P3)의 지원을 받아 수행됐으며, 포항가속기연구소 및 한국기초과학지원연구원(KBSI)의 협조로 가속기 기반 분석이 진행됐다.
대기 오염 저감 위한 신개념 원자 촉매 설계
백금 셀레나이드는 백금(Pt)과 셀레늄(Se)이 층상 구조로 결합된 이차원 물질로, 우수한 결정성과 층간 상호작용의 정밀한 제어를 통해 다양한 물리적·화학적 특성의 조절이 가능한 것으로 알려져 있다. 이러한 특성으로 인해, 반도체, 광검출기, 전기화학 소자 등 다양한 분야에서 활발히 연구되어 왔다. 이번 연구진은 백금 셀레나이드 표면에 존재하는 원자 수준의 백금이 기체 반응에 대해 촉매로 기능할 수 있다는 새로운 설계 개념을 제시했으며, 이를 통해 고효율 이산화탄소 전환 및 일산화탄소 저감 등을 위한 차세대 기체상 촉매 기술로서의 가능성을 입증했다.
우리 대학 화학과 박정영 석좌교수 연구팀이 충남대학교 김현유 교수, 미국 센트럴플로리다대학교(UCF) 정연웅 교수 연구팀과 공동연구를 통해, 이차원 전이금속 칼코겐화합물인 백금 셀레나이드(PtSe₂) 표면에 노출된 백금 원자를 활용하여 우수한 일산화탄소 산화 성능을 구현하는 데 성공했다고 22일 밝혔다.
연구진은 촉매 성능을 극대화하기 위해 기존의 백금 덩어리 촉매 형태에서 백금 원자가 고밀도로 표면에 분산되도록 하여, 더 적은 양의 백금으로 더 많은 촉매반응을 유도하였으며, 표면의 전자 구조를 제어하여 백금과 셀레늄 사이의 전자 상호작용을 활발하게 일어나도록 유도하였다. 이 과정을 통해 제작된 수 나노미터 두께의 백금 셀레나이드 박막은, 동일 조건에서 일반 백금 박막보다 전 온도 범위에서 더 우수한 일산화탄소 산화 성능을 나타냈다.
특히, 표면에서는 일산화탄소와 산소가 골고루 비슷한 비율로 흡착되어 서로 반응할 기회가 높아졌고, 이로 인해 촉매 반응이 크게 향상됐다. 이러한 성능 향상의 핵심은 ‘셀레늄 결손(Se-vacancy)’으로 인해 노출이 확대된 표면 백금 원자들이 드러나면서 기체들이 붙을 수 있는 흡착점도 늘어났다는 데 있다.
연구진은 해당 백금 원자들이 실제 반응 과정에서 흡착점으로 작용했다는 사실을 포항가속기연구소에서 수행된 상압 엑스선 광전자분광(AP-XPS) 분석을 통해 실시간으로 확인했다. 이러한 고정밀 분석은 1나노미터 수준의 표면을 상압 환경에서 관찰할 수 있는 고도 장비 덕분에 가능했다. 동시에 컴퓨터 시뮬레이션 (밀도범함수이론*) 계산을 통해, 백금 셀레나이드가 일반 백금과는 다른 전자 흐름의 특성을 가지고 있음을 이론적으로도 입증했다.
*밀도범함수이론(Density Functional Theory, DFT): 전자 밀도(electron density)를 기반으로 시스템의 전체 에너지를 계산하는 방법
박정영 교수는 “이번 연구는 기존 백금 촉매와 다른 이차원 층상 구조의 백금 셀레나이드를 활용해, 기체 반응에 특화된 촉매 기능을 이끌어낸 새로운 설계 전략을 제시한 것”이라며, “백금과 셀레늄 사이의 전자적 상호작용이 일산화탄소와 산소를 균형있게 흡착하는 반응 조건을 만들었고 기존 백금보다 전체 온도내에서 반응성이 높도록 설계하여 실제 적용성이 향상되게 하였다. 이로써 원자 단위 설계, 2차원 물질 플랫폼, 흡착 조절 기술 등을 통해 고효율 촉매 반응 메커니즘을 구현할 수 있었다”고 밝혔다.
이번 연구는 우리 대학 화학과 한규호 박사, 충남대 신소재공학과 최혁 박사, 인하대 김종훈 교수가 공동 제1 저자로 참여했으며, 세계적 권위의 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 지난 7월 3일 자로 게재됐다.
※ 논문 제목: Enhanced catalytic activity on atomically dispersed PtSe2 two-dimensional layers
※DOI: 10.1038/s41467-025-61320-0
한편, 이번 연구는 과학기술정보통신부의 중견연구자지원사업과 교육부의 중점연구소사업, 국가전략기술소재개발사업, 미국 국립과학재단(NSF) CAREER 프로그램, 인하대학교 연구비, UCF 박사후연구자 프로그램(P3)의 지원을 받아 수행됐으며, 포항가속기연구소 및 한국기초과학지원연구원(KBSI)의 협조로 가속기 기반 분석이 진행됐다.
2025.07.22
조회수 977
-
 음주로 인한 간염 유발 원리 최초 밝혔다
과도한 음주는 알코올성 간질환을 유발하며, 이 중 약 20%는 알코올 지방간염으로 진행되고 이는 간경변증과 간부전으로 이어질 수 있어 조기 진단과 치료가 매우 중요하다. 우리 연구진은 음주 시 활성산소(ROS)가 발생해 간세포 사멸과 염증 반응을 유발하는 새로운 분자 메커니즘을 규명했다. 아울러, 간세포가 신경계의 시냅스처럼 신호를 주고 받는 유사시냅스를 형성하고 염증을 유도하는 ‘새로운 신경학적 경로’를 세계 최초로 밝혀냈다.
우리 대학 의과학대학원 정원일 교수 연구팀이 서울대 보라매 병원 김원 교수 연구팀과의 공동 연구를 통해, 음주로 인한 간 손상 및 염증(알코올 지방간염, Alcohol-associated Steatohepatitis, ASH)의 발생 기전을 분자 수준에서 규명해 알코올 간질환의 진단과 치료에 단서를 제시했다고 17일 밝혔다.
정원일 교수 연구팀은 만성 음주 시 ‘소포성 글루탐산 수송체(VGLUT3)’의 발현 증가로 글루탐산이 간세포에 축적되며, 이후 폭음으로 인한 간세포 내 칼슘 농도의 급격한 변화가 글루탐산* 분비를 유도함을 확인했다.
*글루탐산: 아미노산의 일종으로, 뇌와 간을 포함한 다양한 조직에서 세포 간 신호전달, 단백질 합성, 에너지 대사 등에 관여하며 지나치게 많으면 신경세포가 과흥분하여 세포 손상 또는 사멸하게 함
분비된 글루탐산은 간 내 상주 대식세포인 쿠퍼세포의 글루탐산 수용체(mGluR5)를 자극해 활성산소(ROS) 생성을 유도하고, 이는 곧 간세포 사멸과 염증 반응으로 이어지는 병리적 경로를 형성한다는 사실을 밝혀냈다.
특히 이번 연구의 핵심은, 음주 시 간 내에서 간세포와 쿠퍼세포가 일시적으로 신경계에서만 관찰되던 시냅스와 비슷한 구조인‘유사시냅스(pseudosynapse)’를 형성해 신호를 주고받는 현상을 처음으로 규명했다는 점이다.
이 유사시냅스 혹은 대사시냅스(metabolic synapse)는 음주로 인해 간세포가 팽창(ballooning)되면서 쿠퍼세포와 물리적으로 밀착될 때 형성된다. 즉, 손상된 간세포가 단순히 사멸하는 것이 아니라, 인접한 쿠퍼세포에 신호를 보내 면역 반응을 유도할 수 있다는 의미이다.
이러한 발견은 말초 장기에서도 ‘세포 간 밀접한 구조적 접촉을 통해 신호전달이 가능하다’라는 새로운 패러다임을 제시하며, 단순한 간세포 손상을 넘어 알코올로 손상된 간세포가 능동적으로 대식세포를 자극해 간세포의 사멸을 통한 재생을 유도하는‘자율 회복기능’도 존재함을 보여줬다.
실제로 연구팀은 글루탐산 수송체(VGLUT3), 글루탐산 수용체(mGluR5) 및 활성산소 생성 효소(NOX2)를 유전적 또는 약리적으로 억제하면 알코올 매개 간 손상이 줄어든다는 사실을 동물 모델을 통해 입증했다. 이러한 기전을 기반으로, 연구팀은 알코올성 간질환 환자의 혈액과 간 조직을 분석해 해당 메커니즘이 임상적으로도 적용될 수 있음을 제시했다.
의과학대학원 정원일 교수는 “이는 향후 알코올 지방간염(ASH)의 발병 초기 단계에서 진단용으로 혹은 치료를 위한 새로운 분자 표적으로 활용될 수 있다”라고 말했다.
의과학대학원 양경모 박사(현, 여의도 성모병원)와 김규래 박사과정생이 공동 제1 저자로 참여한 이번 연구는 서울대 보라매병원 김원 교수 연구팀과 함께 진행됐으며, 국제 학술지 `네이처 커뮤니케이션즈(Nature communications)' 지난 7월 1일 자로 출판됐다.
※ 논문명: Binge drinking triggers VGLUT3-mediated glutamate secretion and subsequent hepatic inflammation by activating mGluR5/NOX2 in Kupffer cells
※ DOI: 10.1038/s41467-025-60820-3.
한편, 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 글로벌 리더연구, 중견연구자사업 및 바이오·의료기술개발사업의 지원으로 수행됐다.
음주로 인한 간염 유발 원리 최초 밝혔다
과도한 음주는 알코올성 간질환을 유발하며, 이 중 약 20%는 알코올 지방간염으로 진행되고 이는 간경변증과 간부전으로 이어질 수 있어 조기 진단과 치료가 매우 중요하다. 우리 연구진은 음주 시 활성산소(ROS)가 발생해 간세포 사멸과 염증 반응을 유발하는 새로운 분자 메커니즘을 규명했다. 아울러, 간세포가 신경계의 시냅스처럼 신호를 주고 받는 유사시냅스를 형성하고 염증을 유도하는 ‘새로운 신경학적 경로’를 세계 최초로 밝혀냈다.
우리 대학 의과학대학원 정원일 교수 연구팀이 서울대 보라매 병원 김원 교수 연구팀과의 공동 연구를 통해, 음주로 인한 간 손상 및 염증(알코올 지방간염, Alcohol-associated Steatohepatitis, ASH)의 발생 기전을 분자 수준에서 규명해 알코올 간질환의 진단과 치료에 단서를 제시했다고 17일 밝혔다.
정원일 교수 연구팀은 만성 음주 시 ‘소포성 글루탐산 수송체(VGLUT3)’의 발현 증가로 글루탐산이 간세포에 축적되며, 이후 폭음으로 인한 간세포 내 칼슘 농도의 급격한 변화가 글루탐산* 분비를 유도함을 확인했다.
*글루탐산: 아미노산의 일종으로, 뇌와 간을 포함한 다양한 조직에서 세포 간 신호전달, 단백질 합성, 에너지 대사 등에 관여하며 지나치게 많으면 신경세포가 과흥분하여 세포 손상 또는 사멸하게 함
분비된 글루탐산은 간 내 상주 대식세포인 쿠퍼세포의 글루탐산 수용체(mGluR5)를 자극해 활성산소(ROS) 생성을 유도하고, 이는 곧 간세포 사멸과 염증 반응으로 이어지는 병리적 경로를 형성한다는 사실을 밝혀냈다.
특히 이번 연구의 핵심은, 음주 시 간 내에서 간세포와 쿠퍼세포가 일시적으로 신경계에서만 관찰되던 시냅스와 비슷한 구조인‘유사시냅스(pseudosynapse)’를 형성해 신호를 주고받는 현상을 처음으로 규명했다는 점이다.
이 유사시냅스 혹은 대사시냅스(metabolic synapse)는 음주로 인해 간세포가 팽창(ballooning)되면서 쿠퍼세포와 물리적으로 밀착될 때 형성된다. 즉, 손상된 간세포가 단순히 사멸하는 것이 아니라, 인접한 쿠퍼세포에 신호를 보내 면역 반응을 유도할 수 있다는 의미이다.
이러한 발견은 말초 장기에서도 ‘세포 간 밀접한 구조적 접촉을 통해 신호전달이 가능하다’라는 새로운 패러다임을 제시하며, 단순한 간세포 손상을 넘어 알코올로 손상된 간세포가 능동적으로 대식세포를 자극해 간세포의 사멸을 통한 재생을 유도하는‘자율 회복기능’도 존재함을 보여줬다.
실제로 연구팀은 글루탐산 수송체(VGLUT3), 글루탐산 수용체(mGluR5) 및 활성산소 생성 효소(NOX2)를 유전적 또는 약리적으로 억제하면 알코올 매개 간 손상이 줄어든다는 사실을 동물 모델을 통해 입증했다. 이러한 기전을 기반으로, 연구팀은 알코올성 간질환 환자의 혈액과 간 조직을 분석해 해당 메커니즘이 임상적으로도 적용될 수 있음을 제시했다.
의과학대학원 정원일 교수는 “이는 향후 알코올 지방간염(ASH)의 발병 초기 단계에서 진단용으로 혹은 치료를 위한 새로운 분자 표적으로 활용될 수 있다”라고 말했다.
의과학대학원 양경모 박사(현, 여의도 성모병원)와 김규래 박사과정생이 공동 제1 저자로 참여한 이번 연구는 서울대 보라매병원 김원 교수 연구팀과 함께 진행됐으며, 국제 학술지 `네이처 커뮤니케이션즈(Nature communications)' 지난 7월 1일 자로 출판됐다.
※ 논문명: Binge drinking triggers VGLUT3-mediated glutamate secretion and subsequent hepatic inflammation by activating mGluR5/NOX2 in Kupffer cells
※ DOI: 10.1038/s41467-025-60820-3.
한편, 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 글로벌 리더연구, 중견연구자사업 및 바이오·의료기술개발사업의 지원으로 수행됐다.
2025.07.17
조회수 1202
-
 6배 정밀한 3D 뇌 모사 플랫폼 구현 성공
기존의 3차원(3D) 신경세포 배양 기술은 뇌의 복잡한 다층 구조를 정밀하게 구현하기 어렵고, 구조와 기능을 동시에 분석할 수 있는 플랫폼이 부족해 뇌 연구에 제약이 있었다. 우리 연구진이 뇌처럼 층을 이루는 신경세포 구조를 3D 프린팅 기술로 구현하고, 그 안에서 신경세포의 활동까지 정밀하게 측정할 수 있는 통합 플랫폼 개발에 성공했다.
우리 대학 바이오및뇌공학과 박제균·남윤기 교수 공동연구팀이 뇌 조직과 유사한 기계적 특성을 가진 저점도 천연 하이드로겔을 이용해 고해상도 3D 다층 신경세포 네트워크를 제작하고, 구조적·기능적 연결성을 동시에 분석할 수 있는 통합 플랫폼을 개발했다고 16일 밝혔다.
기존 바이오프린팅 기술은 구조적 안정성을 위해 고점도 바이오잉크를 사용하지만, 이는 신경세포의 증식과 신경돌기 성장을 제한하고, 반대로 신경세포 친화적인 저점도 하이드로겔은 정밀한 패턴 형성이 어려워 구조적 안정성과 생물학적 기능 사이의 근본적인 상충 관계가 있었다.
연구팀은 묽은 젤로도 정밀한 뇌 구조를 만들고, 층마다 정확히 정렬하며, 신경세포의 활동까지 동시에 관찰할 수 있는 3대 핵심기술을 결합해 정교하고 안정적인 뇌 모사 플랫폼을 완성했다.
3대 핵심기술은 ▲ 묽은 젤(하이드로겔)이 흐르지 않도록 스테인리스 철망(마이크로메시) 위에 딱 붙게 만들어 주는‘모세관 고정 효과’ 기술로 기존보다 6배 더 정밀하게 (해상도 500μm 이하) 뇌 구조를 재현했고 ▲ 프린팅된 층들이 삐뚤어지지 않고 정확히 쌓이도록 맞춰주는 원통형 설계인 ‘3D 프린팅 정렬기’로 다층 구조체의 정밀한 조립과 미세 전극 칩과의 안정적 결합을 보장하였고 ▲ 아래쪽은 전기신호를 측정하고, 위쪽은 빛(칼슘 이미징)으로 동시에 세포 활동을 관찰하는 ‘이중 모드 분석 시스템’기술로 층간 연결이 실제로 작동하는지를 여러 방식으로 동시에 확인할 수 있다.
연구팀은 뇌와 유사한 탄성 특성을 지닌 피브린 하이드로겔을 이용해 3층으로 구성된 미니 뇌 구조를 3D 프린팅으로 구현하고, 그 안에서 실제 신경세포들이 신호를 주고받는 과정을 실험을 통해 입증했다.
위층과 아래층에는 대뇌 신경세포를 배치하고, 가운데층은 비어 있지만, 신경세포들이 가운데를 뚫고 지나가며 연결되도록 설계했다. 아래층에는 미세 센서(전극칩)를 달아 전기신호를 측정하고, 위층은 빛(칼슘 이미징)으로 세포 활동을 관찰한 결과, 전기 자극을 줬을 때 위아래층 신경세포가 동시에 반응했고, 신경 연결을 차단하는 약물(시냅스 차단제)을 넣었더니 반응이 줄어들어 신경세포들이 진짜로 연결돼서 신호를 주고받고 있다는 것을 입증했다.
바이오및뇌공학과 박제균 교수는 “이번 연구는 뇌 조직의 복잡한 다층 구조와 기능을 동시에 재현할 수 있는 통합 플랫폼의 공동개발 성과”임을 강조하며, “기존 기술로 14일 이상은 신호 측정이 불가했던 것에 비해 27일 이상 안정적인 미세 전극 칩 인터페이스를 유지하면서 구조-기능 관계를 실시간으로 분석할 수 있어, 향후 신경질환 모델링, 뇌 기능 연구, 신경독성 평가 및 신경 보호 약물 스크리닝 등 다양한 뇌 연구 분야에 활용할 수 있을 것”이라고 말했다.
바이오및뇌공학과 김수지 박사와 윤동조 박사가 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘바이오센서스 앤 바이오일렉트로닉스(Biosensors and Bioelectronics)’에 2025년 6월 11일 자로 온라인판에 게재됐다.
※논문명: Hybrid biofabrication of multilayered 3D neuronal networks with structural and functional interlayer connectivity
※DOI: https://doi.org/10.1016/j.bios.2025.117688
한편, 이번 연구는 한국연구재단 글로벌 기초연구실지원사업, 중견연구 및 바이오·의료기술개발사업의 지원을 받아 수행됐다.
6배 정밀한 3D 뇌 모사 플랫폼 구현 성공
기존의 3차원(3D) 신경세포 배양 기술은 뇌의 복잡한 다층 구조를 정밀하게 구현하기 어렵고, 구조와 기능을 동시에 분석할 수 있는 플랫폼이 부족해 뇌 연구에 제약이 있었다. 우리 연구진이 뇌처럼 층을 이루는 신경세포 구조를 3D 프린팅 기술로 구현하고, 그 안에서 신경세포의 활동까지 정밀하게 측정할 수 있는 통합 플랫폼 개발에 성공했다.
우리 대학 바이오및뇌공학과 박제균·남윤기 교수 공동연구팀이 뇌 조직과 유사한 기계적 특성을 가진 저점도 천연 하이드로겔을 이용해 고해상도 3D 다층 신경세포 네트워크를 제작하고, 구조적·기능적 연결성을 동시에 분석할 수 있는 통합 플랫폼을 개발했다고 16일 밝혔다.
기존 바이오프린팅 기술은 구조적 안정성을 위해 고점도 바이오잉크를 사용하지만, 이는 신경세포의 증식과 신경돌기 성장을 제한하고, 반대로 신경세포 친화적인 저점도 하이드로겔은 정밀한 패턴 형성이 어려워 구조적 안정성과 생물학적 기능 사이의 근본적인 상충 관계가 있었다.
연구팀은 묽은 젤로도 정밀한 뇌 구조를 만들고, 층마다 정확히 정렬하며, 신경세포의 활동까지 동시에 관찰할 수 있는 3대 핵심기술을 결합해 정교하고 안정적인 뇌 모사 플랫폼을 완성했다.
3대 핵심기술은 ▲ 묽은 젤(하이드로겔)이 흐르지 않도록 스테인리스 철망(마이크로메시) 위에 딱 붙게 만들어 주는‘모세관 고정 효과’ 기술로 기존보다 6배 더 정밀하게 (해상도 500μm 이하) 뇌 구조를 재현했고 ▲ 프린팅된 층들이 삐뚤어지지 않고 정확히 쌓이도록 맞춰주는 원통형 설계인 ‘3D 프린팅 정렬기’로 다층 구조체의 정밀한 조립과 미세 전극 칩과의 안정적 결합을 보장하였고 ▲ 아래쪽은 전기신호를 측정하고, 위쪽은 빛(칼슘 이미징)으로 동시에 세포 활동을 관찰하는 ‘이중 모드 분석 시스템’기술로 층간 연결이 실제로 작동하는지를 여러 방식으로 동시에 확인할 수 있다.
연구팀은 뇌와 유사한 탄성 특성을 지닌 피브린 하이드로겔을 이용해 3층으로 구성된 미니 뇌 구조를 3D 프린팅으로 구현하고, 그 안에서 실제 신경세포들이 신호를 주고받는 과정을 실험을 통해 입증했다.
위층과 아래층에는 대뇌 신경세포를 배치하고, 가운데층은 비어 있지만, 신경세포들이 가운데를 뚫고 지나가며 연결되도록 설계했다. 아래층에는 미세 센서(전극칩)를 달아 전기신호를 측정하고, 위층은 빛(칼슘 이미징)으로 세포 활동을 관찰한 결과, 전기 자극을 줬을 때 위아래층 신경세포가 동시에 반응했고, 신경 연결을 차단하는 약물(시냅스 차단제)을 넣었더니 반응이 줄어들어 신경세포들이 진짜로 연결돼서 신호를 주고받고 있다는 것을 입증했다.
바이오및뇌공학과 박제균 교수는 “이번 연구는 뇌 조직의 복잡한 다층 구조와 기능을 동시에 재현할 수 있는 통합 플랫폼의 공동개발 성과”임을 강조하며, “기존 기술로 14일 이상은 신호 측정이 불가했던 것에 비해 27일 이상 안정적인 미세 전극 칩 인터페이스를 유지하면서 구조-기능 관계를 실시간으로 분석할 수 있어, 향후 신경질환 모델링, 뇌 기능 연구, 신경독성 평가 및 신경 보호 약물 스크리닝 등 다양한 뇌 연구 분야에 활용할 수 있을 것”이라고 말했다.
바이오및뇌공학과 김수지 박사와 윤동조 박사가 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘바이오센서스 앤 바이오일렉트로닉스(Biosensors and Bioelectronics)’에 2025년 6월 11일 자로 온라인판에 게재됐다.
※논문명: Hybrid biofabrication of multilayered 3D neuronal networks with structural and functional interlayer connectivity
※DOI: https://doi.org/10.1016/j.bios.2025.117688
한편, 이번 연구는 한국연구재단 글로벌 기초연구실지원사업, 중견연구 및 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2025.07.16
조회수 997
-
 로봇도 사람처럼 위험할때만 즉각 반응한다
인공지능과 로봇 기술의 동반 발전 속에서, 로봇이 사람처럼 효율적으로 환경을 인식하고 반응하는 기술 확보가 중요한 과제로 떠오르고 있다. 이에 한국 연구진이 별도의 복잡한 소프트웨어나 회로 없이도 생명체의 감각 신경계를 모사한 인공 감각 신경계를 새롭게 구현해 주목받고 있다. 이 기술은 에너지 소모를 최소화하면서 외부 자극에 지능적으로 반응할 수 있어, 초소형 로봇이나 로봇 의수 등 의료 및 특수 환경에서의 활용이 기대된다.
우리 대학 전기및전자공학부 최신현 석좌교수, 충남대학교 반도체융합학과 이종원 교수 공동연구팀이 생명체의 감각 신경계 기능을 모사하는 차세대 뉴로모픽 반도체 기반 인공 감각 신경계를 개발하고, 이를 통해 외부 자극에 효율적으로 대응하는 신개념 로봇 시스템을 증명했다고 15일 밝혔다.
사람을 포함한 동물은 안전하거나 익숙한 자극은 무시하고, 중요한 자극에는 선별적으로 민감하게 반응함으로써, 에너지 낭비를 방지하면서도 중요한 자극에 집중해 민첩하게 외부 변화에 대응할 수 있다.
예를 들면, 여름철 에어컨 소리나 옷이 피부에 닿는 감촉은 곧 익숙해져 신경 쓰지 않게 되지만, 누군가 이름을 부르거나 날카로운 물체가 피부에 닿으면 재빠르게 집중하고 대응한다.
이는 감각 신경계에서의 ‘습관화’ 그리고 ‘민감화’기능에 의해서 조절됨을 보여주며, 사람처럼 효율적으로 외부 환경에 대응하는 로봇 구현을 위해, 이러한 생명체의 감각 신경계 기능을 로봇에 적용하려는 시도가 꾸준히 진행돼왔다.
그러나, 습관화나 민감화와 같은 복잡한 신경 특성을 로봇에 구현하기 위해선 별도 소프트웨어가 필요하거나, 복잡한 회로가 필요해 소형화와 에너지 효율 측면에서의 어려움이 있었다.
특히 뉴로모픽 반도체인 멤리스터(memristor)1 소자를 활용하는 시도도 있었지만, 기존 멤리스터는 단순한 전도도 변화만 가능해 신경계의 복잡한 특성을 모사하는 데 한계가 있었다.
1멤리스터: 메모리(memory)와 저항(resistor)의 합성어로 두 단자 사이로 과거에 흐른 전하량과 방향에 따라 저항값이 결정되는 차세대 전기소자
이러한 한계를 극복하기 위해 연구팀은 하나의 멤리스터 소자 안에 서로 반대 방향으로 전도도를 변화시키는 층을 형성해, 실제 감각 신경계에서처럼 습관화와 민감화 등의 기능을 모사할 수 있는 새로운 멤리스터를 개발했다.
이 소자는 자극이 반복되면 점차 반응이 줄어들다가, 위험 신호가 감지되면 다시 민감하게 반응하는 등, 실제 신경계의 복잡한 시냅스 반응 패턴을 사실적으로 재현할 수 있다.
연구팀은 이 멤리스터를 이용해 촉각과 고통을 인식하는 멤리스터 기반 인공 감각 신경계를 제작하고, 이를 실제 로봇 손에 적용해 그 효율성을 실험했다.
반복적으로 안전한 촉각 자극을 가하자, 처음에는 낯선 촉각 자극에 민감하게 반응하던 로봇 손이 점차 자극을 무시하는 습관화 특성을 보였고, 이후 전기 충격과 함께 자극을 가했을 때는 이를 위험 신호로 인식해 다시 민감하게 반응하는 민감화 특성도 확인됐다.
이를 통해, 별도의 복잡한 소프트웨어나 프로세서 없이도 로봇이 사람처럼 효율적으로 자극에 대응할 수 있음을 실험적으로 입증하며, 에너지 측면에서 효율적인 신경계 모사 로봇(neuro-inspired robot)의 개발 가능성을 검증했다.
박시온 연구원은 “사람의 감각 신경계를 차세대 반도체로 모사해, 더 똑똑하고 에너지 측면에서 효율적으로 외부 환경에 대응하는 신개념 로봇 구현의 가능성을 열었다”라며, “앞으로 초소형 로봇, 군용 로봇, 로봇 의수 같은 의료용 로봇 등 차세대 반도체와 로보틱스의 여러 융합 분야에서 활용될 것으로 기대된다”고 밝혔다.
이번 연구는 박시온 석박통합과정 연구원이 제 1저자로 국제 학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 지난 7월 1일 자로 온라인 게재됐다.
※ 논문 제목: Experimental demonstration of third-order memristor-based artificial sensory nervous system for neuro-inspired robotics
※ DOI: https://doi.org/10.1038/s41467-025-60818-x
이번 연구는 한국연구재단의 차세대지능형반도체기술개발사업, 중견연구사업, PIM인공지능반도체핵심기술개발사업, 우수신진연구사업, 그리고 나노종합기술원의 나노메디컬 디바이스 사업의 지원을 받아 수행됐다.
로봇도 사람처럼 위험할때만 즉각 반응한다
인공지능과 로봇 기술의 동반 발전 속에서, 로봇이 사람처럼 효율적으로 환경을 인식하고 반응하는 기술 확보가 중요한 과제로 떠오르고 있다. 이에 한국 연구진이 별도의 복잡한 소프트웨어나 회로 없이도 생명체의 감각 신경계를 모사한 인공 감각 신경계를 새롭게 구현해 주목받고 있다. 이 기술은 에너지 소모를 최소화하면서 외부 자극에 지능적으로 반응할 수 있어, 초소형 로봇이나 로봇 의수 등 의료 및 특수 환경에서의 활용이 기대된다.
우리 대학 전기및전자공학부 최신현 석좌교수, 충남대학교 반도체융합학과 이종원 교수 공동연구팀이 생명체의 감각 신경계 기능을 모사하는 차세대 뉴로모픽 반도체 기반 인공 감각 신경계를 개발하고, 이를 통해 외부 자극에 효율적으로 대응하는 신개념 로봇 시스템을 증명했다고 15일 밝혔다.
사람을 포함한 동물은 안전하거나 익숙한 자극은 무시하고, 중요한 자극에는 선별적으로 민감하게 반응함으로써, 에너지 낭비를 방지하면서도 중요한 자극에 집중해 민첩하게 외부 변화에 대응할 수 있다.
예를 들면, 여름철 에어컨 소리나 옷이 피부에 닿는 감촉은 곧 익숙해져 신경 쓰지 않게 되지만, 누군가 이름을 부르거나 날카로운 물체가 피부에 닿으면 재빠르게 집중하고 대응한다.
이는 감각 신경계에서의 ‘습관화’ 그리고 ‘민감화’기능에 의해서 조절됨을 보여주며, 사람처럼 효율적으로 외부 환경에 대응하는 로봇 구현을 위해, 이러한 생명체의 감각 신경계 기능을 로봇에 적용하려는 시도가 꾸준히 진행돼왔다.
그러나, 습관화나 민감화와 같은 복잡한 신경 특성을 로봇에 구현하기 위해선 별도 소프트웨어가 필요하거나, 복잡한 회로가 필요해 소형화와 에너지 효율 측면에서의 어려움이 있었다.
특히 뉴로모픽 반도체인 멤리스터(memristor)1 소자를 활용하는 시도도 있었지만, 기존 멤리스터는 단순한 전도도 변화만 가능해 신경계의 복잡한 특성을 모사하는 데 한계가 있었다.
1멤리스터: 메모리(memory)와 저항(resistor)의 합성어로 두 단자 사이로 과거에 흐른 전하량과 방향에 따라 저항값이 결정되는 차세대 전기소자
이러한 한계를 극복하기 위해 연구팀은 하나의 멤리스터 소자 안에 서로 반대 방향으로 전도도를 변화시키는 층을 형성해, 실제 감각 신경계에서처럼 습관화와 민감화 등의 기능을 모사할 수 있는 새로운 멤리스터를 개발했다.
이 소자는 자극이 반복되면 점차 반응이 줄어들다가, 위험 신호가 감지되면 다시 민감하게 반응하는 등, 실제 신경계의 복잡한 시냅스 반응 패턴을 사실적으로 재현할 수 있다.
연구팀은 이 멤리스터를 이용해 촉각과 고통을 인식하는 멤리스터 기반 인공 감각 신경계를 제작하고, 이를 실제 로봇 손에 적용해 그 효율성을 실험했다.
반복적으로 안전한 촉각 자극을 가하자, 처음에는 낯선 촉각 자극에 민감하게 반응하던 로봇 손이 점차 자극을 무시하는 습관화 특성을 보였고, 이후 전기 충격과 함께 자극을 가했을 때는 이를 위험 신호로 인식해 다시 민감하게 반응하는 민감화 특성도 확인됐다.
이를 통해, 별도의 복잡한 소프트웨어나 프로세서 없이도 로봇이 사람처럼 효율적으로 자극에 대응할 수 있음을 실험적으로 입증하며, 에너지 측면에서 효율적인 신경계 모사 로봇(neuro-inspired robot)의 개발 가능성을 검증했다.
박시온 연구원은 “사람의 감각 신경계를 차세대 반도체로 모사해, 더 똑똑하고 에너지 측면에서 효율적으로 외부 환경에 대응하는 신개념 로봇 구현의 가능성을 열었다”라며, “앞으로 초소형 로봇, 군용 로봇, 로봇 의수 같은 의료용 로봇 등 차세대 반도체와 로보틱스의 여러 융합 분야에서 활용될 것으로 기대된다”고 밝혔다.
이번 연구는 박시온 석박통합과정 연구원이 제 1저자로 국제 학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 지난 7월 1일 자로 온라인 게재됐다.
※ 논문 제목: Experimental demonstration of third-order memristor-based artificial sensory nervous system for neuro-inspired robotics
※ DOI: https://doi.org/10.1038/s41467-025-60818-x
이번 연구는 한국연구재단의 차세대지능형반도체기술개발사업, 중견연구사업, PIM인공지능반도체핵심기술개발사업, 우수신진연구사업, 그리고 나노종합기술원의 나노메디컬 디바이스 사업의 지원을 받아 수행됐다.
2025.07.15
조회수 997
-
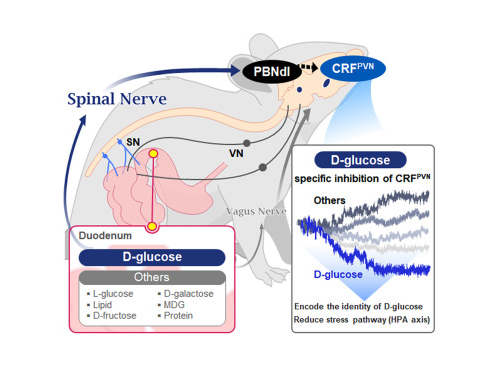 뇌는 포도당을 구별한다..비만·당뇨 치료의 단서 찾아
‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해낼까?’ 우리 대학 연구진은 이 질문에서 출발해, 뇌가 단순히 총열량(칼로리)을 감지하는 수준을 넘어 특정 영양소, 특히 포도당을 선택적으로 인식할 수 있다는 사실을 입증했다. 이번 연구는 향후 식욕 조절 및 대사성 질환 치료 전략에 새로운 패러다임을 제시할 수 있을 것으로 기대된다.
우리 대학 생명과학과 서성배 교수 연구팀이 바이오및뇌공학과 박영균 교수팀, 생명과학과 이승희 교수팀, 뉴욕 알버트 아인슈타인 의과대학과의 협력을 통해, 배고픔 상태에서 포도당이 결핍된 동물이 장내의 포도당을 선택적으로 인식하고 선호하도록 유도하는 장-뇌 회로의 존재를 규명했다고 9일 밝혔다.
생물은 당, 단백질, 지방 등 다양한 영양소로부터 에너지를 얻는다. 기존 연구들은 장내 총열량 정보가 시상하부의 배고픔 뉴런(hunger neurons)을 억제함으로써 식욕을 조절한다는 사실을 밝혀왔으나, 특정 포도당에 특이적으로 반응하는 장-뇌 회로와 이에 반응하는 특정 뇌세포의 존재는 규명되지 않았다.
연구팀은 이번 연구를 통해 뇌의 기능에 필수적인 포도당을 감지하고 필요한 영양소에 대한 섭취 행동을 조절하는 ‘장-뇌 회로’를 밝혀내는 데 성공했다.
또한, 이 회로는 뇌의 ‘스트레스 반응 세포(CRF 뉴런*)’가 배고픔이나 외부 자극뿐만 아니라, 소장에 직접 유입된 특정 열량 영양소에 대해서도 초 단위로 반응하며, 특히 ‘포도당(D-glucose)’에 선택적으로 반응한다는 점을 처음으로 입증했다.
*CRF 뉴런: 우리 몸이 심리적·물리적 스트레스에 대응하는 핵심 생리 시스템은 시상하부-뇌하수체-부신 축(Hypothalamus-Pituitary-Adrenal Axis, HPA axis)이다. 이 축의 중심에는 시상하부에서 CRF(부신피질호르몬 방출인자)를 분비하는 뉴런이 있으며, 이들은 다양한 스트레스 자극에 반응해 코르티솔 분비를 유도하고, 생리 및 대사 균형을 유지하는 신경 내분비 조절의 중추로 알려져 있다.
연구팀은 실시간 뇌 속을 정밀하게 추적할 수 있는 광유전학 기반 신경 활성 조절 및 회로 추적 기법을 활용해서, 포도당(D-글루코스, L-글루코스,) 아미노산, 지방 등 다양한 영양소의 쥐의 소장 내 직접 주입하고 관찰했다.
그 결과, 뇌 시상하부의 ‘시상하부 시상핵(PVN)* 부위’에 있는 CRF 뉴런 중 D-글루코스(glucose) 포도당에만 선택적으로 반응하며, 다른 당류나 단백질·지방류에는 반응하지 않거나 반대 방향의 반응을 보이는 것을 확인했다. 이는 뇌가 장내 영양소가 유입 시 반응에 대해 단일 뇌세포 수준에서 어떤 방향성을 유도한다는 것을 처음 확인한 것을 의미한다.
* 시상하부 시상핵(paraventricular nucleus, PVN): 뇌의 시상하부(hypothalamus) 안에 있는 매우 중요한 신경핵(뉴런 무리)으로, 신체 항상성(몸의 균형 유지)을 조절하는 핵심 구조
또한, 연구팀은 소장의 포도당 감지 신호가 ‘척수신경’을 거쳐 뇌의 특정 부위(등쪽 외측 팔곁핵,parabrachial nucleus, PBNdl)을 통해 PVN의 CRF 뉴런으로 전달되는 특징적인 회로를 밝혀냈다. 반면, 아미노산이나 지방 등 기타 영양소는 미주신경(vagus nerve)이란 다른 통로로 뇌에 전달된다는 사실도 확인했다.
광유전학적 억제 실험에서도, 공복 상태의 생쥐에서 CRF 뉴런을 억제하면 동물은 더 이상 포도당을 선호하지 않게 됐으며, 이 회로가 영양소 선택에 있어 포도당 특이적 선호를 유도하는 데 필수적임이 드러났다.
이 연구는 서 교수가 뉴욕대(NYU) 재직 시절 초파리를 모델로, 장내 포도당(글루코스) 및 당을 선택적으로 감지하는 ‘DH44 뉴런’을 발견했던 점을 착안해, 포유류에서도 시상하부 뉴런이 포도당 특이적 반응에 있어 기능적 유사성을 보일 것이라는 가설에서 시작되었다.
이 가설을 입증하기 위해 서 교수 연구팀 김진은 박사(KAIST 박사 졸, 現 캘리포니아공과대학교 연수연구원)가 학위과정 중 생쥐 실험을 통해 배고픈 쥐는 장에 주입된 다양한 영양소 중 열량을 지닌 포도당을 선호하며, CRF 뉴런이 빠르고 특이적인 반응을 보인다는 사실을 확인했다.
또한, 같은 팀 정원교 연구원(KAIST 학사 졸, 現 캘리포니아공과대학교 박사과정)과 함께 실험과 모델링을 통해 CRF 뉴런의 중요성을 규명했고, 김신혜 박사는 협업을 통해 장-뇌 회로 중 특정 척추 신경세포가 장의 정보를 뇌로 전달 한다는 놀라운 발견을 입증했다.
김진은 박사와 김신혜 박사는 “이 연구는 ‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해내는가?’라는 단순하지만, 본질적인 질문에서 시작됐고, 이번 연구에서 장-뇌 연결 회로의 핵심 축인 척수신경의 역할을 규명하고 장내 특정 영양소를 감지한 후 이를 뇌에 전달하는 척수 기반 신경 회로가 우리 몸의 에너지 대사 조절과 항상성 유지에 핵심적일 것이라는 것을 밝혀냈다”고 말했다.
서성배 교수는 “이번 연구는 포도당에 특화된 장-뇌 신호 경로를 규명함으로써, 비만·당뇨병 등 대사 질환의 새로운 치료 표적을 제시할 수 있다”며 “향후 아미노산, 지방 등 다른 필수 영양소를 감지하는 유사 회로의 존재와 그 상호작용 메커니즘을 밝히는 연구로 확장될 예정”이라고 밝혔다.
우리 대학 김진은 박사, 김신혜 박사, 정원교 학생이 공동 제1 저자로 참여한 이번 연구의 결과는 국제 학술지 ‘뉴런(Neuron)’에 2025년 6월 20일 온라인 게재됐다.
※논문명: Encoding the glucose identity by discrete hypothalamic neurons via the gut-brain axis
※DOI: https://doi.org/10.1016/j.neuron.2025.05.024
이번 연구는 삼성미래기술육성사업, 한국연구재단 리더과제, 포스코 청암재단 사이언스 펠로십, 아산재단 의생명과학 장학사업, 기초과학연구원, KAIST KAIX 사업의 지원을 통해 수행됐다.
뇌는 포도당을 구별한다..비만·당뇨 치료의 단서 찾아
‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해낼까?’ 우리 대학 연구진은 이 질문에서 출발해, 뇌가 단순히 총열량(칼로리)을 감지하는 수준을 넘어 특정 영양소, 특히 포도당을 선택적으로 인식할 수 있다는 사실을 입증했다. 이번 연구는 향후 식욕 조절 및 대사성 질환 치료 전략에 새로운 패러다임을 제시할 수 있을 것으로 기대된다.
우리 대학 생명과학과 서성배 교수 연구팀이 바이오및뇌공학과 박영균 교수팀, 생명과학과 이승희 교수팀, 뉴욕 알버트 아인슈타인 의과대학과의 협력을 통해, 배고픔 상태에서 포도당이 결핍된 동물이 장내의 포도당을 선택적으로 인식하고 선호하도록 유도하는 장-뇌 회로의 존재를 규명했다고 9일 밝혔다.
생물은 당, 단백질, 지방 등 다양한 영양소로부터 에너지를 얻는다. 기존 연구들은 장내 총열량 정보가 시상하부의 배고픔 뉴런(hunger neurons)을 억제함으로써 식욕을 조절한다는 사실을 밝혀왔으나, 특정 포도당에 특이적으로 반응하는 장-뇌 회로와 이에 반응하는 특정 뇌세포의 존재는 규명되지 않았다.
연구팀은 이번 연구를 통해 뇌의 기능에 필수적인 포도당을 감지하고 필요한 영양소에 대한 섭취 행동을 조절하는 ‘장-뇌 회로’를 밝혀내는 데 성공했다.
또한, 이 회로는 뇌의 ‘스트레스 반응 세포(CRF 뉴런*)’가 배고픔이나 외부 자극뿐만 아니라, 소장에 직접 유입된 특정 열량 영양소에 대해서도 초 단위로 반응하며, 특히 ‘포도당(D-glucose)’에 선택적으로 반응한다는 점을 처음으로 입증했다.
*CRF 뉴런: 우리 몸이 심리적·물리적 스트레스에 대응하는 핵심 생리 시스템은 시상하부-뇌하수체-부신 축(Hypothalamus-Pituitary-Adrenal Axis, HPA axis)이다. 이 축의 중심에는 시상하부에서 CRF(부신피질호르몬 방출인자)를 분비하는 뉴런이 있으며, 이들은 다양한 스트레스 자극에 반응해 코르티솔 분비를 유도하고, 생리 및 대사 균형을 유지하는 신경 내분비 조절의 중추로 알려져 있다.
연구팀은 실시간 뇌 속을 정밀하게 추적할 수 있는 광유전학 기반 신경 활성 조절 및 회로 추적 기법을 활용해서, 포도당(D-글루코스, L-글루코스,) 아미노산, 지방 등 다양한 영양소의 쥐의 소장 내 직접 주입하고 관찰했다.
그 결과, 뇌 시상하부의 ‘시상하부 시상핵(PVN)* 부위’에 있는 CRF 뉴런 중 D-글루코스(glucose) 포도당에만 선택적으로 반응하며, 다른 당류나 단백질·지방류에는 반응하지 않거나 반대 방향의 반응을 보이는 것을 확인했다. 이는 뇌가 장내 영양소가 유입 시 반응에 대해 단일 뇌세포 수준에서 어떤 방향성을 유도한다는 것을 처음 확인한 것을 의미한다.
* 시상하부 시상핵(paraventricular nucleus, PVN): 뇌의 시상하부(hypothalamus) 안에 있는 매우 중요한 신경핵(뉴런 무리)으로, 신체 항상성(몸의 균형 유지)을 조절하는 핵심 구조
또한, 연구팀은 소장의 포도당 감지 신호가 ‘척수신경’을 거쳐 뇌의 특정 부위(등쪽 외측 팔곁핵,parabrachial nucleus, PBNdl)을 통해 PVN의 CRF 뉴런으로 전달되는 특징적인 회로를 밝혀냈다. 반면, 아미노산이나 지방 등 기타 영양소는 미주신경(vagus nerve)이란 다른 통로로 뇌에 전달된다는 사실도 확인했다.
광유전학적 억제 실험에서도, 공복 상태의 생쥐에서 CRF 뉴런을 억제하면 동물은 더 이상 포도당을 선호하지 않게 됐으며, 이 회로가 영양소 선택에 있어 포도당 특이적 선호를 유도하는 데 필수적임이 드러났다.
이 연구는 서 교수가 뉴욕대(NYU) 재직 시절 초파리를 모델로, 장내 포도당(글루코스) 및 당을 선택적으로 감지하는 ‘DH44 뉴런’을 발견했던 점을 착안해, 포유류에서도 시상하부 뉴런이 포도당 특이적 반응에 있어 기능적 유사성을 보일 것이라는 가설에서 시작되었다.
이 가설을 입증하기 위해 서 교수 연구팀 김진은 박사(KAIST 박사 졸, 現 캘리포니아공과대학교 연수연구원)가 학위과정 중 생쥐 실험을 통해 배고픈 쥐는 장에 주입된 다양한 영양소 중 열량을 지닌 포도당을 선호하며, CRF 뉴런이 빠르고 특이적인 반응을 보인다는 사실을 확인했다.
또한, 같은 팀 정원교 연구원(KAIST 학사 졸, 現 캘리포니아공과대학교 박사과정)과 함께 실험과 모델링을 통해 CRF 뉴런의 중요성을 규명했고, 김신혜 박사는 협업을 통해 장-뇌 회로 중 특정 척추 신경세포가 장의 정보를 뇌로 전달 한다는 놀라운 발견을 입증했다.
김진은 박사와 김신혜 박사는 “이 연구는 ‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해내는가?’라는 단순하지만, 본질적인 질문에서 시작됐고, 이번 연구에서 장-뇌 연결 회로의 핵심 축인 척수신경의 역할을 규명하고 장내 특정 영양소를 감지한 후 이를 뇌에 전달하는 척수 기반 신경 회로가 우리 몸의 에너지 대사 조절과 항상성 유지에 핵심적일 것이라는 것을 밝혀냈다”고 말했다.
서성배 교수는 “이번 연구는 포도당에 특화된 장-뇌 신호 경로를 규명함으로써, 비만·당뇨병 등 대사 질환의 새로운 치료 표적을 제시할 수 있다”며 “향후 아미노산, 지방 등 다른 필수 영양소를 감지하는 유사 회로의 존재와 그 상호작용 메커니즘을 밝히는 연구로 확장될 예정”이라고 밝혔다.
우리 대학 김진은 박사, 김신혜 박사, 정원교 학생이 공동 제1 저자로 참여한 이번 연구의 결과는 국제 학술지 ‘뉴런(Neuron)’에 2025년 6월 20일 온라인 게재됐다.
※논문명: Encoding the glucose identity by discrete hypothalamic neurons via the gut-brain axis
※DOI: https://doi.org/10.1016/j.neuron.2025.05.024
이번 연구는 삼성미래기술육성사업, 한국연구재단 리더과제, 포스코 청암재단 사이언스 펠로십, 아산재단 의생명과학 장학사업, 기초과학연구원, KAIST KAIX 사업의 지원을 통해 수행됐다.
2025.07.09
조회수 1176
-
 부작용·내성 극복한 신개념 칸디다증 치료제 개발
칸디다증은 곰팡이균(진균)의 일종인 칸디다(Candida)가 혈액을 통해 전신으로 퍼지며 장기 손상과 패혈증을 유발할 수 있는 치명적인 감염 질환이다. 최근 면역 저하 치료, 장기 이식, 의료기기 사용 등이 증가함에 따라 칸디다증 발병이 급증하고 있다. 한국 연구진이 기존 항진균제와 달리, 칸디다균에만 선택적으로 작용해 높은 치료 효능과 낮은 부작용을 동시에 갖춘 차세대 치료제를 개발하는데 성공했다.
우리 대학 생명과학과 정현정 교수 연구팀이 서울아산병원 정용필 교수팀과의 협력을 통해, 칸디다 세포벽의 두 핵심 효소를 동시에 저해하는 유전자 기반 나노치료제(FTNx)를 개발했다고 8일 밝혔다.
현재 사용 중인 칸디다의 항진균제들은 표적 선택성이 낮아 인체 세포에도 영향을 미칠 수 있으며, 이에 내성을 가지는 새로운 균의 출현으로 인해 치료 효과가 점차 떨어지고 있다. 특히 면역력이 저하된 환자들에게는 감염의 진행이 빠르고 예후도 좋지 않아, 기존 치료제의 한계를 극복할 수 있는 새로운 치료법의 개발이 시급한 상황이다.
이에 연구팀이 개발한 치료제는 전신 투여가 가능하며, 유전자 억제 기술과 나노소재 기술을 융합함으로써 기존 화합물 기반의 약물들이 가지는 구조적 한계를 효과적으로 극복하고, 칸디다균에만 선택적으로 치료하는데 성공했다.
연구팀은 칸디다라는 곰팡이균의 세포벽을 만드는 데 중요한 두 가지 효소 — β‑1,3‑글루칸 합성효소(FKS1)와 키틴 합성효소(CHS3)를 동시에 표적하는 짧은 DNA 조각(antisense oligonucleotide, ASO)을 탑재한 금 나노입자 기반의 복합체를 제작했다.
여기에 칸디다 세포벽의 특정 당지질 구조(당과 지방이 결합된 구조)와 결합하는 표면 코팅 기술을 적용하여 표적유도장치를 장착함으로써, 인체 세포에는 아예 전달되지 않고 칸디다에만 선택적으로 작용하는 정밀 타겟팅 효과를 구현하는 데 성공했다.
이 복합체는 칸디다 세포 내로 진입한 후, FKS1 및 CHS3의 유전자가 만들어내는 mRNA를 잘라버려서 번역을 억제해 세포벽 성분인 β‑1,3‑글루칸과 키틴의 합성을 동시에 차단한다. 이로 인해 칸디다 세포벽은 구조적 안정성을 유지하지 못하고 붕괴되며, 세균의 생존과 증식이 억제된다.
실제로 쥐에서 전신 칸디다증 모델 실험을 통해 치료 효과를 검증한 결과, 치료군에서 칸디다의 장기 내 균 수 감소, 면역 반응 정상화, 그리고 생존율의 유의미한 증가가 관찰됐다.
연구를 주도한 정현정 교수는 “이번 연구는 기존 치료제가 인체 독성과 약제내성 확산 문제를 극복하는 방법을 제시하며, 유전자 치료의 전신 감염 적용 가능성을 보여주는 중요한 전환점”이라며, “향후 임상 적용을 위한 투여 방식 최적화 및 독성 검증 연구를 지속적으로 진행할 계획”이라고 밝혔다.
해당 연구는 생명과학과 정주연 학생 및 서울아산병원 홍윤경 박사가 제1 저자로 참여했으며, 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 7월 1일 자로 게재됐다.
※ 논문명 : Effective treatment of systemic candidiasis by synergistic targeting of cell wall synthesis
※ DOI : 10.1038/s41467-025-60684-7
이번 연구는 보건복지부 및 한국연구재단의 지원을 받아 수행됐다.
부작용·내성 극복한 신개념 칸디다증 치료제 개발
칸디다증은 곰팡이균(진균)의 일종인 칸디다(Candida)가 혈액을 통해 전신으로 퍼지며 장기 손상과 패혈증을 유발할 수 있는 치명적인 감염 질환이다. 최근 면역 저하 치료, 장기 이식, 의료기기 사용 등이 증가함에 따라 칸디다증 발병이 급증하고 있다. 한국 연구진이 기존 항진균제와 달리, 칸디다균에만 선택적으로 작용해 높은 치료 효능과 낮은 부작용을 동시에 갖춘 차세대 치료제를 개발하는데 성공했다.
우리 대학 생명과학과 정현정 교수 연구팀이 서울아산병원 정용필 교수팀과의 협력을 통해, 칸디다 세포벽의 두 핵심 효소를 동시에 저해하는 유전자 기반 나노치료제(FTNx)를 개발했다고 8일 밝혔다.
현재 사용 중인 칸디다의 항진균제들은 표적 선택성이 낮아 인체 세포에도 영향을 미칠 수 있으며, 이에 내성을 가지는 새로운 균의 출현으로 인해 치료 효과가 점차 떨어지고 있다. 특히 면역력이 저하된 환자들에게는 감염의 진행이 빠르고 예후도 좋지 않아, 기존 치료제의 한계를 극복할 수 있는 새로운 치료법의 개발이 시급한 상황이다.
이에 연구팀이 개발한 치료제는 전신 투여가 가능하며, 유전자 억제 기술과 나노소재 기술을 융합함으로써 기존 화합물 기반의 약물들이 가지는 구조적 한계를 효과적으로 극복하고, 칸디다균에만 선택적으로 치료하는데 성공했다.
연구팀은 칸디다라는 곰팡이균의 세포벽을 만드는 데 중요한 두 가지 효소 — β‑1,3‑글루칸 합성효소(FKS1)와 키틴 합성효소(CHS3)를 동시에 표적하는 짧은 DNA 조각(antisense oligonucleotide, ASO)을 탑재한 금 나노입자 기반의 복합체를 제작했다.
여기에 칸디다 세포벽의 특정 당지질 구조(당과 지방이 결합된 구조)와 결합하는 표면 코팅 기술을 적용하여 표적유도장치를 장착함으로써, 인체 세포에는 아예 전달되지 않고 칸디다에만 선택적으로 작용하는 정밀 타겟팅 효과를 구현하는 데 성공했다.
이 복합체는 칸디다 세포 내로 진입한 후, FKS1 및 CHS3의 유전자가 만들어내는 mRNA를 잘라버려서 번역을 억제해 세포벽 성분인 β‑1,3‑글루칸과 키틴의 합성을 동시에 차단한다. 이로 인해 칸디다 세포벽은 구조적 안정성을 유지하지 못하고 붕괴되며, 세균의 생존과 증식이 억제된다.
실제로 쥐에서 전신 칸디다증 모델 실험을 통해 치료 효과를 검증한 결과, 치료군에서 칸디다의 장기 내 균 수 감소, 면역 반응 정상화, 그리고 생존율의 유의미한 증가가 관찰됐다.
연구를 주도한 정현정 교수는 “이번 연구는 기존 치료제가 인체 독성과 약제내성 확산 문제를 극복하는 방법을 제시하며, 유전자 치료의 전신 감염 적용 가능성을 보여주는 중요한 전환점”이라며, “향후 임상 적용을 위한 투여 방식 최적화 및 독성 검증 연구를 지속적으로 진행할 계획”이라고 밝혔다.
해당 연구는 생명과학과 정주연 학생 및 서울아산병원 홍윤경 박사가 제1 저자로 참여했으며, 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 7월 1일 자로 게재됐다.
※ 논문명 : Effective treatment of systemic candidiasis by synergistic targeting of cell wall synthesis
※ DOI : 10.1038/s41467-025-60684-7
이번 연구는 보건복지부 및 한국연구재단의 지원을 받아 수행됐다.
2025.07.08
조회수 1592
-
 마이크로 OLED로 난치성 뇌질환 치료 '게임 체인저' 기술 제시
광유전학 기술은 빛에 반응하는 광 단백질이 발현된 뉴런에 특정 파장의 빛 자극을 통해 뉴런의 활성을 조절하는 기술로 다양한 뇌질환의 원인을 규명하며 난치성 뇌질환의 새로운 치료 방법을 개발할 가능성을 열고 있다. 이 기술은 인체의 뇌에 삽입하여 자극을 주는 의료 기기인 ‘뉴럴 프로브’를 통해 정확하게 자극하고 무른 뇌 조직의 손상을 최소화해야 한다. 이에 우리 연구진이 마이크로 OLED를 활용해 얇고 유연한 인체 삽입형 의료기기로 구현함으로써 뉴럴 프로브의 새로운 패러다임을 제시했다.
우리 대학 전기및전자공학부 최경철 교수와 이현주 연구팀이 공동 연구를 통해, 유연한 마이크로 OLED가 집적된 광유전학용 뉴럴 프로브 개발에 성공했다고 6일 밝혔다.
광유전학 연구에서 주요 기술은 광원의 빛을 뇌로 전달하는 방식으로 외부 광원으로부터의 깊은 뇌 영역까지 빛을 전달하기 위해 수십 년간 광섬유를 사용해 왔다. 하지만 단일 뉴런을 자극하기 위한 유연 광섬유, 초미세 광원 집적 뉴럴 프로브 등 관련 연구가 이뤄지고 있다.
연구팀은 마이크로 OLED는 높은 공간적 해상도와 유연성을 가져, 매우 작은 영역의 뉴런에서도 정확하게 빛을 조사할 수 있어 세밀한 뇌 회로 분석이 가능하고 동물의 움직임에 불편함을 주지 않으면서 부작용을 최소화하는 장점에 주목했다. 그뿐만 아니라, 미세한 파장 조절을 통해 정밀한 빛 조절이 가능하며 다중 자극을 통한 복잡한 뇌 기능 연구가 가능하다.
하지만, 체내 수분이나 물에 의해 전기적 특성이 쉽게 열화되기 때문에 생체 삽입형 전자장치로 활용되는데 한계가 있었고, 얇고 유연한 탐침 위 고해상도 집적 공정에 대한 세부적인 최적화도 필요했다.
공동연구팀은 수분과 산소가 많은 생체 내 환경에서 OLED의 구동 신뢰성을 높이며 생체 삽입 시 조직 손상을 최소화하고자, 산화알루미늄/파릴렌-C(Al2O3/parylene-C)로 구성된 초박막 유연 봉지막*을 얇은 탐침 형태인 260~600마이크로미터(μm) 너비로 패터닝해 생체친화성을 유지했다.
* 봉지막: 소자를 외부 환경요인인 산소와 물 분자로부터 완전히 차단하는 막 기술로 소자의 수명을 유지시키고 신뢰성을 줌
또한, 고해상도 마이크로 OLED를 집적함에 있어 전체 소자의 유연성과 생체친화성을 유지하기 위해, 봉지막과 동일한 생체친화 재료인 파릴렌-C(parylene-C)를 활용하였다. 아울러, 인접한 OLED 픽셀 간 전기적 간섭 현상을 제거하고 각 픽셀을 공간적으로 분리하기 위해 구조적 레이어인 ‘화소 정의막(pixel define layer)’을 도입함으로써, 8개의 마이크로 OLED를 독립적으로 개별 구동할 수 있도록 구현했다.
마지막으로, 소자 내 다중 박막층의 잔류 응력과 두께를 정밀하게 조절함으로써, 생체 내 환경에서도 소자의 유연성을 유지할 수 있도록 하였다. 이를 통해 외부 셔틀이나 바늘과 같은 보조 장치 없이도 단일 탐침만으로 휘어짐 없이 삽입이 가능하도록, 소자의 기계적 스트레스를 최적화해 설계했다.
결론적으로 연구팀은 채널로돕신2의 활성화에 적합한 470나노미터(nm) 파장에서 1밀리와트/제곱밀리미터(mW/mm2)이상의 광 파워 밀도를 가지는 즉, 광유전학 및 생체조직 자극 응용에서 상당히 높은 수준의 광출력을 가진 마이크로 OLED 집적 유연 뉴럴 프로브를 개발했다.
또한, 초박막 유연 봉지막은 2.66×10⁻⁵ g/m²/day의 낮은 수분 투습률을 보이며 소자 수명은 10년 이상 유지할 수 있고, 패릴렌-C(parylene-C)를 기반으로 생체 내 높은 봉지막 성능을 발휘하며, 전기적 간섭과 휨 이슈 없이 집적된 OLED의 개별 구동을 성공적으로 시연했다.
이번 연구를 주도한 최경철 교수 연구팀의 이소민 박사는 “고유연·고해상도의 마이크로 OLED를 얇은 유연 탐침 위에 집적하는 세부 공정 및 생체 적용성, 친화성 향상에 집중했다”며 “이번 연구는 기존 연구를 넘어 유연 프로브 형태에 최초로 개발해 보고된 사례로, 유연 OLED가 인체 삽입형 측정 및 치료 의료기기로서의 새로운 패러다임을 제시할 것으로 기대된다”고 말했다.
이번 연구는 전기및전자공학부 이소민 박사가 제1 저자로 나노 분야의 권위 있는 국제 학술지 `어드밴스드 펑셔널 머터리얼즈(Advanced Functional Materials, IF 18.5)'에 지난 3월 26일 字로 온라인 게재됐으며, 전면 표지 논문으로 이번 7월에 선정됐다.
※ 논문명: Advanced Micro-OLED Integration on Thin and Flexible Polymer Neural Probes for Targeted Optogenetic Stimulation
※ DOI: https://doi.org/10.1002/adfm.202420758
한편, 이번 연구는 과학기술정보통신부 한국연구재단의 전자약 기술개발사업(연구 과제명: 뇌인지-정서 향상 빛 자극 전자약의 핵심원천기술 개발 및 생체 적용가능성 검증)의 지원을 받아 수행됐다.
마이크로 OLED로 난치성 뇌질환 치료 '게임 체인저' 기술 제시
광유전학 기술은 빛에 반응하는 광 단백질이 발현된 뉴런에 특정 파장의 빛 자극을 통해 뉴런의 활성을 조절하는 기술로 다양한 뇌질환의 원인을 규명하며 난치성 뇌질환의 새로운 치료 방법을 개발할 가능성을 열고 있다. 이 기술은 인체의 뇌에 삽입하여 자극을 주는 의료 기기인 ‘뉴럴 프로브’를 통해 정확하게 자극하고 무른 뇌 조직의 손상을 최소화해야 한다. 이에 우리 연구진이 마이크로 OLED를 활용해 얇고 유연한 인체 삽입형 의료기기로 구현함으로써 뉴럴 프로브의 새로운 패러다임을 제시했다.
우리 대학 전기및전자공학부 최경철 교수와 이현주 연구팀이 공동 연구를 통해, 유연한 마이크로 OLED가 집적된 광유전학용 뉴럴 프로브 개발에 성공했다고 6일 밝혔다.
광유전학 연구에서 주요 기술은 광원의 빛을 뇌로 전달하는 방식으로 외부 광원으로부터의 깊은 뇌 영역까지 빛을 전달하기 위해 수십 년간 광섬유를 사용해 왔다. 하지만 단일 뉴런을 자극하기 위한 유연 광섬유, 초미세 광원 집적 뉴럴 프로브 등 관련 연구가 이뤄지고 있다.
연구팀은 마이크로 OLED는 높은 공간적 해상도와 유연성을 가져, 매우 작은 영역의 뉴런에서도 정확하게 빛을 조사할 수 있어 세밀한 뇌 회로 분석이 가능하고 동물의 움직임에 불편함을 주지 않으면서 부작용을 최소화하는 장점에 주목했다. 그뿐만 아니라, 미세한 파장 조절을 통해 정밀한 빛 조절이 가능하며 다중 자극을 통한 복잡한 뇌 기능 연구가 가능하다.
하지만, 체내 수분이나 물에 의해 전기적 특성이 쉽게 열화되기 때문에 생체 삽입형 전자장치로 활용되는데 한계가 있었고, 얇고 유연한 탐침 위 고해상도 집적 공정에 대한 세부적인 최적화도 필요했다.
공동연구팀은 수분과 산소가 많은 생체 내 환경에서 OLED의 구동 신뢰성을 높이며 생체 삽입 시 조직 손상을 최소화하고자, 산화알루미늄/파릴렌-C(Al2O3/parylene-C)로 구성된 초박막 유연 봉지막*을 얇은 탐침 형태인 260~600마이크로미터(μm) 너비로 패터닝해 생체친화성을 유지했다.
* 봉지막: 소자를 외부 환경요인인 산소와 물 분자로부터 완전히 차단하는 막 기술로 소자의 수명을 유지시키고 신뢰성을 줌
또한, 고해상도 마이크로 OLED를 집적함에 있어 전체 소자의 유연성과 생체친화성을 유지하기 위해, 봉지막과 동일한 생체친화 재료인 파릴렌-C(parylene-C)를 활용하였다. 아울러, 인접한 OLED 픽셀 간 전기적 간섭 현상을 제거하고 각 픽셀을 공간적으로 분리하기 위해 구조적 레이어인 ‘화소 정의막(pixel define layer)’을 도입함으로써, 8개의 마이크로 OLED를 독립적으로 개별 구동할 수 있도록 구현했다.
마지막으로, 소자 내 다중 박막층의 잔류 응력과 두께를 정밀하게 조절함으로써, 생체 내 환경에서도 소자의 유연성을 유지할 수 있도록 하였다. 이를 통해 외부 셔틀이나 바늘과 같은 보조 장치 없이도 단일 탐침만으로 휘어짐 없이 삽입이 가능하도록, 소자의 기계적 스트레스를 최적화해 설계했다.
결론적으로 연구팀은 채널로돕신2의 활성화에 적합한 470나노미터(nm) 파장에서 1밀리와트/제곱밀리미터(mW/mm2)이상의 광 파워 밀도를 가지는 즉, 광유전학 및 생체조직 자극 응용에서 상당히 높은 수준의 광출력을 가진 마이크로 OLED 집적 유연 뉴럴 프로브를 개발했다.
또한, 초박막 유연 봉지막은 2.66×10⁻⁵ g/m²/day의 낮은 수분 투습률을 보이며 소자 수명은 10년 이상 유지할 수 있고, 패릴렌-C(parylene-C)를 기반으로 생체 내 높은 봉지막 성능을 발휘하며, 전기적 간섭과 휨 이슈 없이 집적된 OLED의 개별 구동을 성공적으로 시연했다.
이번 연구를 주도한 최경철 교수 연구팀의 이소민 박사는 “고유연·고해상도의 마이크로 OLED를 얇은 유연 탐침 위에 집적하는 세부 공정 및 생체 적용성, 친화성 향상에 집중했다”며 “이번 연구는 기존 연구를 넘어 유연 프로브 형태에 최초로 개발해 보고된 사례로, 유연 OLED가 인체 삽입형 측정 및 치료 의료기기로서의 새로운 패러다임을 제시할 것으로 기대된다”고 말했다.
이번 연구는 전기및전자공학부 이소민 박사가 제1 저자로 나노 분야의 권위 있는 국제 학술지 `어드밴스드 펑셔널 머터리얼즈(Advanced Functional Materials, IF 18.5)'에 지난 3월 26일 字로 온라인 게재됐으며, 전면 표지 논문으로 이번 7월에 선정됐다.
※ 논문명: Advanced Micro-OLED Integration on Thin and Flexible Polymer Neural Probes for Targeted Optogenetic Stimulation
※ DOI: https://doi.org/10.1002/adfm.202420758
한편, 이번 연구는 과학기술정보통신부 한국연구재단의 전자약 기술개발사업(연구 과제명: 뇌인지-정서 향상 빛 자극 전자약의 핵심원천기술 개발 및 생체 적용가능성 검증)의 지원을 받아 수행됐다.
2025.07.07
조회수 1300
-
 정확도·효율성 높인 생명과학 데이터 분석 도구 'scICE' 개발
기존보다 최대 30배 빠른 속도로 안정적인 결과만을 자동으로 선별하여 대규모 생명과학 데이터 분석의 정확도와 효율성을 획기적으로 향상하는 방법이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀은 세포 분류(클러스터링) 결과의 안정성을 수학적으로 평가해 불안정한 결과를 걸러내는 새로운 분석 도구인 ‘scICE(single-cell Inconsistency Clustering Estimator)’를 개발했다.
단일세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석법(scRNA-seq)은 현대 생명과학 연구의 핵심 도구로 자리 잡았다. 이 과정에서 클러스터링은 유사한 유전자 발현 특성을 가진 세포들을 그룹으로 묶는 작업으로, 암세포와 정상 세포를 구분하거나 새로운 세포 유형을 발견하는 데 중요한 첫걸음이다. 하지만 클러스터링 알고리즘은 무작위로 세포를 분류해 같은 데이터를 분석해도 결과가 달라지는 경우가 많다.
제1 저자인 김현 선임연구원은 “일부 정상 세포가 암세포로 잘못 분류되거나 중요한 세포 유형이 누락되는 불안정성으로 인해 연구자들은 다시 분석하거나 복잡한 계산을 통해 신뢰도가 높은 결과를 선별해야 했다”며, “기존 방법들은 분석을 여러 번 반복해 합의된 결과를 도출하는 방식으로, 계산량이 방대하고 수만 개 이상의 세포가 포함된 대용량 데이터에는 적합하지 않다”고 말했다.
연구팀이 개발한 scICE는 한 번의 분석만으로도 얼마나 일관성 있게 결과가 도출됐는지를 수학적으로 평가한다. 새로 도입한 ‘불일치 계수(Inconsistency Coefficient, IC)’를 통해 많은 계산량이 요구되는 연산 없이도 클러스터 간 안정성을 정량적으로 판단할 수 있다. 모든 세포를 일일이 비교하던 기존 방식과 달리, 불일치 계수를 활용한 안정성 평가는 클러스터 구조 간 유사성만 평가해 비교 대상을 획기적으로 줄일 수 있어 분석 시간을 크게 단축한다.
연구팀은 뇌, 폐, 혈액 등 다양한 조직에서 수집된 48개의 실제 및 모의 scRNA-seq 데이터에 scICE를 적용하여 그 유효성을 입증했다. 그 결과, 기존 분석 결과 중 약 3분의 2는 통계적으로 불안정하며 신뢰하기 어렵다는 사실을 밝혀냈다. 반면, scICE는 신뢰할 수 있는 결과만을 선별해 연구자의 시간과 계산 자원을 절약하면서도 정확도를 한층 높였다.
또한, scICE는 일반적인 클러스터링으로는 놓치기 쉬운 희귀한 세포 유형을 효과적으로 탐지했다. 실제로 일부 데이터에서 찾기 어려웠던 희귀 면역세포들을 scICE 기반의 서브클러스터링을 통해 안정적으로 식별해냈다. 예를 들어, 매우 복잡한 분석을 거쳐야만 식별할 수 있던 여러 대식세포(macrophage) 아형들을 훨씬 간편하고 정확하게 구분해냈다.
scICE에 관심 있는 연구자는 누구나 깃허브 사이트(https://github.com/Mathbiomed/scICE)를 통해 쉽게 활용해볼 수 있다.
김재경 교수는 “이번 연구는 수학적 아이디어가 어떻게 생명과학의 핵심 문제를 해결하고 분석 과정을 혁신할 수 있는지를 보여주는 성과”라며, “클러스터링 신뢰도의 중요성이 간과되어 온 측면이 있는데, 이번 기회로 scICE가 생명과학 분야에서 신뢰도 높은 데이터 해석을 가능케 하는 표준 도구로 자리 잡기를 기대한다”고 전했다.
우리 대학 박종은 교수 연구팀, POSTECH 김종경 교수 연구팀, 고려대 서민석 교수 연구팀과 공동으로 참여한 이번 연구결과는 세계적인 국제학술지 네이처 커뮤니케이션즈(Nature Communications, IF 14.7)에 7월 2일 온라인 게재됐다.
정확도·효율성 높인 생명과학 데이터 분석 도구 'scICE' 개발
기존보다 최대 30배 빠른 속도로 안정적인 결과만을 자동으로 선별하여 대규모 생명과학 데이터 분석의 정확도와 효율성을 획기적으로 향상하는 방법이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀은 세포 분류(클러스터링) 결과의 안정성을 수학적으로 평가해 불안정한 결과를 걸러내는 새로운 분석 도구인 ‘scICE(single-cell Inconsistency Clustering Estimator)’를 개발했다.
단일세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석법(scRNA-seq)은 현대 생명과학 연구의 핵심 도구로 자리 잡았다. 이 과정에서 클러스터링은 유사한 유전자 발현 특성을 가진 세포들을 그룹으로 묶는 작업으로, 암세포와 정상 세포를 구분하거나 새로운 세포 유형을 발견하는 데 중요한 첫걸음이다. 하지만 클러스터링 알고리즘은 무작위로 세포를 분류해 같은 데이터를 분석해도 결과가 달라지는 경우가 많다.
제1 저자인 김현 선임연구원은 “일부 정상 세포가 암세포로 잘못 분류되거나 중요한 세포 유형이 누락되는 불안정성으로 인해 연구자들은 다시 분석하거나 복잡한 계산을 통해 신뢰도가 높은 결과를 선별해야 했다”며, “기존 방법들은 분석을 여러 번 반복해 합의된 결과를 도출하는 방식으로, 계산량이 방대하고 수만 개 이상의 세포가 포함된 대용량 데이터에는 적합하지 않다”고 말했다.
연구팀이 개발한 scICE는 한 번의 분석만으로도 얼마나 일관성 있게 결과가 도출됐는지를 수학적으로 평가한다. 새로 도입한 ‘불일치 계수(Inconsistency Coefficient, IC)’를 통해 많은 계산량이 요구되는 연산 없이도 클러스터 간 안정성을 정량적으로 판단할 수 있다. 모든 세포를 일일이 비교하던 기존 방식과 달리, 불일치 계수를 활용한 안정성 평가는 클러스터 구조 간 유사성만 평가해 비교 대상을 획기적으로 줄일 수 있어 분석 시간을 크게 단축한다.
연구팀은 뇌, 폐, 혈액 등 다양한 조직에서 수집된 48개의 실제 및 모의 scRNA-seq 데이터에 scICE를 적용하여 그 유효성을 입증했다. 그 결과, 기존 분석 결과 중 약 3분의 2는 통계적으로 불안정하며 신뢰하기 어렵다는 사실을 밝혀냈다. 반면, scICE는 신뢰할 수 있는 결과만을 선별해 연구자의 시간과 계산 자원을 절약하면서도 정확도를 한층 높였다.
또한, scICE는 일반적인 클러스터링으로는 놓치기 쉬운 희귀한 세포 유형을 효과적으로 탐지했다. 실제로 일부 데이터에서 찾기 어려웠던 희귀 면역세포들을 scICE 기반의 서브클러스터링을 통해 안정적으로 식별해냈다. 예를 들어, 매우 복잡한 분석을 거쳐야만 식별할 수 있던 여러 대식세포(macrophage) 아형들을 훨씬 간편하고 정확하게 구분해냈다.
scICE에 관심 있는 연구자는 누구나 깃허브 사이트(https://github.com/Mathbiomed/scICE)를 통해 쉽게 활용해볼 수 있다.
김재경 교수는 “이번 연구는 수학적 아이디어가 어떻게 생명과학의 핵심 문제를 해결하고 분석 과정을 혁신할 수 있는지를 보여주는 성과”라며, “클러스터링 신뢰도의 중요성이 간과되어 온 측면이 있는데, 이번 기회로 scICE가 생명과학 분야에서 신뢰도 높은 데이터 해석을 가능케 하는 표준 도구로 자리 잡기를 기대한다”고 전했다.
우리 대학 박종은 교수 연구팀, POSTECH 김종경 교수 연구팀, 고려대 서민석 교수 연구팀과 공동으로 참여한 이번 연구결과는 세계적인 국제학술지 네이처 커뮤니케이션즈(Nature Communications, IF 14.7)에 7월 2일 온라인 게재됐다.
2025.07.03
조회수 1437
 에탄이 온실가스 줄이고, 플라스틱도 만든다고요?
메탄은 이산화탄소(CO₂)보다 약 25배 강한 온실가스로, 기후변화 대응에서 가장 시급한 감축 대상 중 하나로 천연가스, 매립지 가스, 축산·폐수 처리 등 다양한 배출원에서 종종 에탄과 혼합된 형태로 존재한다. 천연가스 중 에탄도 큰 비중을 차지하며, 메탄 다음으로 최대 15%까지 포함돼 있다. 우리 연구진이 에탄이 이런 메탄을 에너지원으로 사용하는 ‘편성 메탄산화균’의 대사에 영향을 줘서 메탄을 저감시키고 바이오플라스틱 생산에 활용할 가능성을 제시했다.
우리 대학 건설및환경공학과 명재욱 교수 연구팀이 미국 스탠퍼드 대학교와의 공동연구를 통해, 천연가스의 주요 부성분인 에탄(C2H6)이 ‘편성 메탄산화균(Methylosinus trichosporium OB3b)’의 핵심 대사에 미치는 영향을 규명했다고 7일 밝혔다.
메탄산화균은 산소가 있는 조건에서 메탄을 에너지원으로 사용해 생장할 수 있는 세균으로, 이 중 ‘편성(obligate) 메탄산화균’은 메탄이나 메탄올과 같은 C1 화합물만을 성장 기질로 활용하는 것이 특징이다. 지금까지 이러한 편성 메탄산화균이 비(非)성장 기질인 에탄에 어떻게 반응하는지에 대한 연구는 이뤄지지 않았다.
연구팀은 이번 연구에서는 C2 기질인 에탄이 성장 기질로 사용되지 않음에도 불구하고, 편성 메탄산화균의 메탄 산화, 세포 성장, 생분해성 고분자인 폴리하이드록시부티레이트(Polyhydroxybutyrate, 이하 PHB) 합성 등 주요 대사 경로에 유의미한 영향을 미친다는 사실을 밝혀냈다.
연구팀이 다양한 메탄 및 산소 농도 조건에서 에탄을 첨가해 메탄산화균을 배양한 결과, ▲세포 성장 억제 ▲메탄 소비 감소 ▲PHB 합성 증가의 세 가지 대사 반응이 일관되게 나타났으며, 이러한 변화는 에탄 농도가 증가할수록 더욱 두드려졌다.
이번 연구에 따르면, 에탄은 단독으로는 메탄산화균에서 반응하지 않으며, 세균 역시 에탄만 주어졌을 때는 성장하지 않는다. 그러나 메탄과 함께 존재할 경우, 메탄을 산화하는 핵심 효소 ‘입자상 메탄모노옥시게네이스(pMMO)’를 통해 에탄이 함께 산화되는 ‘동시 산화(co-oxidation)’현상이 관찰됐다.
에탄이 산화되는 과정에서 생성되는 중간 대사산물 ‘아세테이트(acetate)’는 메탄산화균의 세포 성장을 억제하는 동시에, PHB(Polyhydroxybutyrate) 생산을 촉진하는 것으로 나타났다. PHB는 생분해성 바이오플라스틱의 원료로 주목받는 고분자 물질이다.
이러한 작용은 균이 처한 영양 상태에 따라 상반된 양상을 보인다. 영양이 충분한 상태에서는 에탄이 세포 성장에 부정적인 영향을 미치지만, 영양 불균형 상태에서는 오히려 PHB 축적을 유도해 긍정적인 효과를 나타낸다.
한편, 에탄을 첨가했을 때 메탄의 소비량은 감소했지만, 메탄 분해 효소인 pMMO를 구성하는 pmoA 유전자의 발현량에는 유의미한 변화가 없었다. 이는 에탄이 유전자의 전사(transcription) 수준에서는 영향을 미치지 않으며, 대신 효소의 실제 작동 능력(활성 수준)이나 전사 이후 조절 단계에서 영향을 준다는 사실을 입증한다.
연구팀은 에탄이 메탄산화균의 대사 흐름을 간접적으로 조절하는 조절자 역할을 하며, 메탄과 함께 있을 때 의도치 않은 방식으로 세포 성장과 PHB 생산에 영향을 미친다고 분석했다.
명재욱 교수는 “이번 연구는 ‘편성 메탄산화균’이 단일 기질 환경이 아닌 에탄과의 복합 기질 조건에서 어떻게 대사적으로 반응하는지를 체계적으로 규명한 최초의 사례”라며, “에탄과 같은 비성장 기질이 메탄 대사와 생분해성 고분자 생산에 미치는 영향을 밝힘으로써, 생물학적 메탄 저감 기술뿐 아니라 바이오플라스틱 생산에도 새로운 가능성을 제시한다”라고 전했다.
건설및환경공학과 박사과정 박선호 학생이 제1 저자인 이번 연구는 환경미생물학 및 생명공학 분야의 권위 있는 미국미생물학회(American Society for Microbiology) 학회지인 국제 학술지 응용 환경미생물학(Applied and Environmental Microbiology)에 7월 10일 자로 게재됐다.
※ 논문명: Non-growth substrate ethane perturbs core methanotrophy in obligate methanotroph Methylosinus trichosporium OB3b upon nutrient availability
(저자 정보 : 박선호(KAIST, 제1 저자), Chungheon Shin(Standford University), Craig S. Criddle (Standford University), 명재욱(KAIST, 교신저자) 총 4명)
※ DOI: 10.1128/aem.00969-25
한편, 이번 연구는 한국연구재단, 국토교통부, 해양수산부의 지원을 받아 수행됐다.
2025.08.07 조회수 485
에탄이 온실가스 줄이고, 플라스틱도 만든다고요?
메탄은 이산화탄소(CO₂)보다 약 25배 강한 온실가스로, 기후변화 대응에서 가장 시급한 감축 대상 중 하나로 천연가스, 매립지 가스, 축산·폐수 처리 등 다양한 배출원에서 종종 에탄과 혼합된 형태로 존재한다. 천연가스 중 에탄도 큰 비중을 차지하며, 메탄 다음으로 최대 15%까지 포함돼 있다. 우리 연구진이 에탄이 이런 메탄을 에너지원으로 사용하는 ‘편성 메탄산화균’의 대사에 영향을 줘서 메탄을 저감시키고 바이오플라스틱 생산에 활용할 가능성을 제시했다.
우리 대학 건설및환경공학과 명재욱 교수 연구팀이 미국 스탠퍼드 대학교와의 공동연구를 통해, 천연가스의 주요 부성분인 에탄(C2H6)이 ‘편성 메탄산화균(Methylosinus trichosporium OB3b)’의 핵심 대사에 미치는 영향을 규명했다고 7일 밝혔다.
메탄산화균은 산소가 있는 조건에서 메탄을 에너지원으로 사용해 생장할 수 있는 세균으로, 이 중 ‘편성(obligate) 메탄산화균’은 메탄이나 메탄올과 같은 C1 화합물만을 성장 기질로 활용하는 것이 특징이다. 지금까지 이러한 편성 메탄산화균이 비(非)성장 기질인 에탄에 어떻게 반응하는지에 대한 연구는 이뤄지지 않았다.
연구팀은 이번 연구에서는 C2 기질인 에탄이 성장 기질로 사용되지 않음에도 불구하고, 편성 메탄산화균의 메탄 산화, 세포 성장, 생분해성 고분자인 폴리하이드록시부티레이트(Polyhydroxybutyrate, 이하 PHB) 합성 등 주요 대사 경로에 유의미한 영향을 미친다는 사실을 밝혀냈다.
연구팀이 다양한 메탄 및 산소 농도 조건에서 에탄을 첨가해 메탄산화균을 배양한 결과, ▲세포 성장 억제 ▲메탄 소비 감소 ▲PHB 합성 증가의 세 가지 대사 반응이 일관되게 나타났으며, 이러한 변화는 에탄 농도가 증가할수록 더욱 두드려졌다.
이번 연구에 따르면, 에탄은 단독으로는 메탄산화균에서 반응하지 않으며, 세균 역시 에탄만 주어졌을 때는 성장하지 않는다. 그러나 메탄과 함께 존재할 경우, 메탄을 산화하는 핵심 효소 ‘입자상 메탄모노옥시게네이스(pMMO)’를 통해 에탄이 함께 산화되는 ‘동시 산화(co-oxidation)’현상이 관찰됐다.
에탄이 산화되는 과정에서 생성되는 중간 대사산물 ‘아세테이트(acetate)’는 메탄산화균의 세포 성장을 억제하는 동시에, PHB(Polyhydroxybutyrate) 생산을 촉진하는 것으로 나타났다. PHB는 생분해성 바이오플라스틱의 원료로 주목받는 고분자 물질이다.
이러한 작용은 균이 처한 영양 상태에 따라 상반된 양상을 보인다. 영양이 충분한 상태에서는 에탄이 세포 성장에 부정적인 영향을 미치지만, 영양 불균형 상태에서는 오히려 PHB 축적을 유도해 긍정적인 효과를 나타낸다.
한편, 에탄을 첨가했을 때 메탄의 소비량은 감소했지만, 메탄 분해 효소인 pMMO를 구성하는 pmoA 유전자의 발현량에는 유의미한 변화가 없었다. 이는 에탄이 유전자의 전사(transcription) 수준에서는 영향을 미치지 않으며, 대신 효소의 실제 작동 능력(활성 수준)이나 전사 이후 조절 단계에서 영향을 준다는 사실을 입증한다.
연구팀은 에탄이 메탄산화균의 대사 흐름을 간접적으로 조절하는 조절자 역할을 하며, 메탄과 함께 있을 때 의도치 않은 방식으로 세포 성장과 PHB 생산에 영향을 미친다고 분석했다.
명재욱 교수는 “이번 연구는 ‘편성 메탄산화균’이 단일 기질 환경이 아닌 에탄과의 복합 기질 조건에서 어떻게 대사적으로 반응하는지를 체계적으로 규명한 최초의 사례”라며, “에탄과 같은 비성장 기질이 메탄 대사와 생분해성 고분자 생산에 미치는 영향을 밝힘으로써, 생물학적 메탄 저감 기술뿐 아니라 바이오플라스틱 생산에도 새로운 가능성을 제시한다”라고 전했다.
건설및환경공학과 박사과정 박선호 학생이 제1 저자인 이번 연구는 환경미생물학 및 생명공학 분야의 권위 있는 미국미생물학회(American Society for Microbiology) 학회지인 국제 학술지 응용 환경미생물학(Applied and Environmental Microbiology)에 7월 10일 자로 게재됐다.
※ 논문명: Non-growth substrate ethane perturbs core methanotrophy in obligate methanotroph Methylosinus trichosporium OB3b upon nutrient availability
(저자 정보 : 박선호(KAIST, 제1 저자), Chungheon Shin(Standford University), Craig S. Criddle (Standford University), 명재욱(KAIST, 교신저자) 총 4명)
※ DOI: 10.1128/aem.00969-25
한편, 이번 연구는 한국연구재단, 국토교통부, 해양수산부의 지원을 받아 수행됐다.
2025.08.07 조회수 485 스스로 물체를 집고, 걷는 '실시간 프로그래밍 로봇 시트' 개발
접힘 구조는 로봇 설계에서 직관적이면서도 효율적인 형상 변형 메커니즘으로 활용되며, 우주·항공 로봇, 유연 로봇, 접이식 그리퍼(손) 등 다양한 응용이 시도되고 있다. 그러나 기존의 접힘 메커니즘은 접는 위치(hinge)나 방향이 사전에 고정돼 있어, 환경과 작업이 바뀔 때마다 구조를 새로 설계·제작해야 하는 한계가 있었다. 한국 연구진이 실시간으로 현장에 따라 프로그래밍하는‘접이식 로봇 시트 기술’을 개발해 로봇의 형태 변화 능력을 획기적으로 향상함으로써, 향후 로봇 공학 분야에 새로운 가능성을 열어줄 것으로 기대된다.
우리 대학 기계공학과 김정 교수, 박인규 교수 공동 연구팀이 형상을 실시간으로 프로그래밍할 수 있는 로봇 시트 원천 기술(field-programmable robotic folding sheet)을 개발했다고 6일 밝혔다.
이번 기술은 ‘필드 프로그래밍(field-programmability)’이라는 개념을 접이식 구조에 성공적으로 도입한 사례로, ‘접힘을 어디서, 어느 방향으로, 얼마나 크게 할지’라는 사용자의 명령을 소재 형상에 실시간으로 반영할 수 있는 소재 기술 및 프로그래밍 방법론을 통합적으로 제안했다.
해당 ‘로봇 시트’는 얇고 유연한 고분자 기판 내에 미세 금속 저항 네트워크가 내장된 구조로, 각 금속 저항이 히터이자 온도 센서 역할을 동시에 수행해, 별도의 외부 장치 없이도 시트의 접힘 상태를 실시간으로 감지하고 제어한다.
또한 유전 알고리즘(genetic algorithm) 및 심층 신경망(deep neural network)을 결합한 소프트웨어를 통해 사용자가 원하는 접힘 위치와 방향, 강도를 소프트웨어적으로 입력하면, 스스로 가열·냉각을 반복하며 정확한 형상을 만들어낸다.
특히, 온도 분포에 대한 폐루프 제어(closed-loop control)를 적용해 실시간 접힘 정밀성을 향상하고, 환경 변화로 인한 영향을 보정했으며, 열 변형 기반 접힘 기술이 지니던 느린 반응 속도 문제도 개선했다.
이러한 형상의 실시간 프로그래밍은 복잡한 하드웨어 재설계 없이도 다양한 로봇의 기능성을 즉석에서 구현할 수 있게 했다는 데에 의미가 있다.
실제로 연구팀은 단일 소재로 다양한 물체 형상에 맞춰 어떻게 잡을지 결정하는 파지(grasping) 전략을 바꿔가며 적용할 수 있는 적응형 로봇 손(그리퍼)를 구현했고, 동일한 ‘로봇 시트(얇고 유연한 형태의 로봇)’를 바닥에 두어 보행하거나 기어가게 하는 등 생체 모방적 이동 전략을 선보였다. 이를 통해 환경 변화에 따라 스스로 형태를 바꾸는 환경 적응형 자율 로봇으로의 확장 가능성도 제시했다.
김정 교수는 “이번 연구는 자기 몸을 바꾸면서 똑똑하게 움직이는 기술 즉, 형상 자체가 지능이 되는‘형상 지능(morphological intelligence)’구현에 한 걸음 다가간 사례로 평가된다. 향후 더 높은 하중 지지와 빠른 냉각을 위한 소재·구조 개선, 배선 없는 일체형 전극에도 다양한 형태·크기로의 확장 등을 통해 재난 현장 대응 로봇, 맞춤형 의료 보조기기, 우주 탐사 장비 등 다양한 분야에 응용될 수 있는 차세대 피지컬 AI 플랫폼으로 발전시킬 계획이다”라고 말했다.
우리 대학 박현규 박사(現 삼성전자 삼성종합기술원)와 정용록 교수(現 경북대학교)가 공동 제1 저자인 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’에 2025년 8월 온라인판에 출판됐다.
※논문명: Field-programmable robotic folding sheet
※DOI: https://www.nature.com/articles/s41467-025-61838-3
한편 이번 연구는 한국연구재단(과학기술정보통신부)의 지원을 받아 수행됐다.
2025.08.06 조회수 634
스스로 물체를 집고, 걷는 '실시간 프로그래밍 로봇 시트' 개발
접힘 구조는 로봇 설계에서 직관적이면서도 효율적인 형상 변형 메커니즘으로 활용되며, 우주·항공 로봇, 유연 로봇, 접이식 그리퍼(손) 등 다양한 응용이 시도되고 있다. 그러나 기존의 접힘 메커니즘은 접는 위치(hinge)나 방향이 사전에 고정돼 있어, 환경과 작업이 바뀔 때마다 구조를 새로 설계·제작해야 하는 한계가 있었다. 한국 연구진이 실시간으로 현장에 따라 프로그래밍하는‘접이식 로봇 시트 기술’을 개발해 로봇의 형태 변화 능력을 획기적으로 향상함으로써, 향후 로봇 공학 분야에 새로운 가능성을 열어줄 것으로 기대된다.
우리 대학 기계공학과 김정 교수, 박인규 교수 공동 연구팀이 형상을 실시간으로 프로그래밍할 수 있는 로봇 시트 원천 기술(field-programmable robotic folding sheet)을 개발했다고 6일 밝혔다.
이번 기술은 ‘필드 프로그래밍(field-programmability)’이라는 개념을 접이식 구조에 성공적으로 도입한 사례로, ‘접힘을 어디서, 어느 방향으로, 얼마나 크게 할지’라는 사용자의 명령을 소재 형상에 실시간으로 반영할 수 있는 소재 기술 및 프로그래밍 방법론을 통합적으로 제안했다.
해당 ‘로봇 시트’는 얇고 유연한 고분자 기판 내에 미세 금속 저항 네트워크가 내장된 구조로, 각 금속 저항이 히터이자 온도 센서 역할을 동시에 수행해, 별도의 외부 장치 없이도 시트의 접힘 상태를 실시간으로 감지하고 제어한다.
또한 유전 알고리즘(genetic algorithm) 및 심층 신경망(deep neural network)을 결합한 소프트웨어를 통해 사용자가 원하는 접힘 위치와 방향, 강도를 소프트웨어적으로 입력하면, 스스로 가열·냉각을 반복하며 정확한 형상을 만들어낸다.
특히, 온도 분포에 대한 폐루프 제어(closed-loop control)를 적용해 실시간 접힘 정밀성을 향상하고, 환경 변화로 인한 영향을 보정했으며, 열 변형 기반 접힘 기술이 지니던 느린 반응 속도 문제도 개선했다.
이러한 형상의 실시간 프로그래밍은 복잡한 하드웨어 재설계 없이도 다양한 로봇의 기능성을 즉석에서 구현할 수 있게 했다는 데에 의미가 있다.
실제로 연구팀은 단일 소재로 다양한 물체 형상에 맞춰 어떻게 잡을지 결정하는 파지(grasping) 전략을 바꿔가며 적용할 수 있는 적응형 로봇 손(그리퍼)를 구현했고, 동일한 ‘로봇 시트(얇고 유연한 형태의 로봇)’를 바닥에 두어 보행하거나 기어가게 하는 등 생체 모방적 이동 전략을 선보였다. 이를 통해 환경 변화에 따라 스스로 형태를 바꾸는 환경 적응형 자율 로봇으로의 확장 가능성도 제시했다.
김정 교수는 “이번 연구는 자기 몸을 바꾸면서 똑똑하게 움직이는 기술 즉, 형상 자체가 지능이 되는‘형상 지능(morphological intelligence)’구현에 한 걸음 다가간 사례로 평가된다. 향후 더 높은 하중 지지와 빠른 냉각을 위한 소재·구조 개선, 배선 없는 일체형 전극에도 다양한 형태·크기로의 확장 등을 통해 재난 현장 대응 로봇, 맞춤형 의료 보조기기, 우주 탐사 장비 등 다양한 분야에 응용될 수 있는 차세대 피지컬 AI 플랫폼으로 발전시킬 계획이다”라고 말했다.
우리 대학 박현규 박사(現 삼성전자 삼성종합기술원)와 정용록 교수(現 경북대학교)가 공동 제1 저자인 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’에 2025년 8월 온라인판에 출판됐다.
※논문명: Field-programmable robotic folding sheet
※DOI: https://www.nature.com/articles/s41467-025-61838-3
한편 이번 연구는 한국연구재단(과학기술정보통신부)의 지원을 받아 수행됐다.
2025.08.06 조회수 634 주변 빛에너지로 24시간 건강 모니터링이 가능하다고?
심박수, 혈중산소포화도, 땀 성분 분석 등 지속적인 건강 모니터링을 위한 의료용 웨어러블 기기의 소형화와 경량화는 여전히 큰 도전 과제다. 특히 광학 센서는 LED 구동과 무선 전송에 많은 전력을 소모해 무겁고 부피가 큰 배터리를 필요로 한다. 이런 한계를 극복하기 위해 우리 연구진은 주변 빛을 에너지원으로 활용하고, 전력 상황에 따라 최적화된 관리를 통해 24시간 연속 측정이 가능한 차세대 웨어러블 플랫폼을 개발했다.
우리 대학 전기및전자공학부 권경하 교수팀이 미국 노스웨스턴대학교 박찬호 박사팀과 공동연구를 통해, 주변 빛을 활용해 배터리 전력 부담을 줄인 적응형 무선 웨어러블 플랫폼을 개발했다고 30일 밝혔다.
의료용 웨어러블 기기의 배터리 문제를 해결하기 위해, 권경하 교수 연구팀은 주변의 자연광을 에너지원으로 활용하는 혁신적인 플랫폼을 개발했다. 이 플랫폼은 세 가지 상호 보완적인 빛 에너지 기술을 통합한 것이 특징이다.
첫 번째 핵심 기술인 ‘광 측정 방식(Photometric Method)’은 주변 광원의 세기에 따라 LED 밝기를 적응적으로 조절하는 기술이다. 주변 자연광과 LED 빛을 합쳐 일정한 총 조명량을 유지하되, 자연광이 강할 때는 LED를 어둡게, 자연광이 약할 때는 LED를 밝게 자동 조절한다.
기존 센서가 환경과 관계없이 LED를 일정하게 켜야 했다면, 이 기술은 주변 환경에 맞춰 LED 전력을 실시간으로 최적화할 수 있다. 실험 결과, 충분한 조명 환경에서 전력 소모를 86.22%나 줄였다.
두 번째는 ‘고효율 다접합 태양전지(Photovoltaic Method)’ 기술이다. 이는 단순한 태양광 발전을 넘어서 실내외 모든 환경의 빛을 전력으로 변환한다. 특히 적응형 전력 관리 시스템을 통해 주변 환경과 배터리 상태에 따라 11가지 서로 다른 전력 구성으로 자동 전환되어 최적의 에너지 효율을 달성한다.
세 번째 혁신 기술은 ‘축광/발광(Photoluminescent Method)’기술이다. 스트론튬 알루미네이트 미세입자*를 센서의 실리콘 캡슐화 구조에 혼합해, 낮 동안 주변 빛을 흡수해 저장했다가 어둠 속에서 서서히 방출한다. 이를 통해 태양광 500W/m²에 10분간 노출되면 완전한 어둠에서도 2.5분간 연속 측정이 가능하다.
*스트론튬 알루미네이트 미세입자: 야광페인트나 안전 표지판에 사용되는 형광체로, 빛을 흡수한 후 어둠 속에서 오랫동안 발광하는 축광 소재
이 세 가지 기술이 상호 보완적으로 작동해 밝은 환경에서는 첫 번째와 두 번째 방식이, 어두운 환경에서는 세 번째 방식이 추가로 지원하는 방식으로 24시간 연속 작동을 가능하게 한다.
연구팀은 이 플랫폼을 다양한 의료 센서에 적용해 실용성을 검증했다. 광용적맥파 측정 센서는 심박수와 혈중산소포화도를 실시간으로 모니터링해 심혈관 질환의 조기 발견을 가능하게 한다. 청색광 노출량 측정 센서는 피부 노화와 손상을 유발하는 블루라이트를 정확히 측정해 개인 맞춤형 피부 보호 가이드를 제공한다. 땀 분석 센서는 마이크로 유체 기술을 활용, 땀 속 염분, 포도당, pH를 동시에 분석해 탈수나 전해질 불균형을 실시간으로 감지할 수 있다.
추가적으로 센서 내 데이터 처리 기술을 도입해 무선 통신으로 인한 전력 소모도 대폭 줄였다. 기존에는 모든 원시 데이터를 외부로 전송해야 했지만, 이제는 센서 내부에서 필요한 결과만 계산해 전송함으로써 데이터 전송량을 400B/s에서 4B/s로 100배 감소시켰다.
연구팀은 성능 검증을 위해 건강한 성인 피험자를 대상으로 밝은 실내조명, 어두운 조명, 적외선 조명, 완전한 어둠 등 4가지 서로 다른 환경에서 테스트했다. 그 결과, 모든 조건에서 상용 의료기기와 동등한 측정 정확도를 보였다. 생쥐 모델을 이용한 저산소 상태 실험에서도 정확한 혈중산소포화도 측정이 가능함을 확인했다.
연구를 주도한 권경하 교수는 “이 기술을 활용해 24시간 연속 건강 모니터링이 가능해짐에 따라 의료 패러다임이 치료 중심에서 예방 중심으로 전환될 수 있을 것”이라며, “조기 진단을 통한 의료비 절감 효과와 함께 차세대 웨어러블 헬스케어 시장에서의 기술경쟁력 확보도 기대된다”라고 말했다.
이번 연구 결과는 인공지능반도체대학원 박도윤 박사과정 학생이 공동 제 1 저자로 국제 학술지 네이처 커뮤니케이션스(Nature Communications)에 7월 1일 발표됐다.
※논문명 : Adaptive Electronics for Photovoltaic, Photoluminescent and Photometric Methods in Power Harvesting for Wireless and Wearable Sensors;
※DOI: URL: https://www.nature.com/articles/s41467-025-60911-1
한편, 이번 연구는 한국연구재단 우수신진연구, 지역혁신 선도연구센터 과제, 과학기술정보통신부 정보통신기획평가원(IITP) 인공지능반도체대학원 과제, 그리고 BK FOUR 프로그램(Connected AI Education & Research Program for Industry and Society Innovation, KAIST EE)의 지원을 받아 수행됐다.
2025.07.31 조회수 761
주변 빛에너지로 24시간 건강 모니터링이 가능하다고?
심박수, 혈중산소포화도, 땀 성분 분석 등 지속적인 건강 모니터링을 위한 의료용 웨어러블 기기의 소형화와 경량화는 여전히 큰 도전 과제다. 특히 광학 센서는 LED 구동과 무선 전송에 많은 전력을 소모해 무겁고 부피가 큰 배터리를 필요로 한다. 이런 한계를 극복하기 위해 우리 연구진은 주변 빛을 에너지원으로 활용하고, 전력 상황에 따라 최적화된 관리를 통해 24시간 연속 측정이 가능한 차세대 웨어러블 플랫폼을 개발했다.
우리 대학 전기및전자공학부 권경하 교수팀이 미국 노스웨스턴대학교 박찬호 박사팀과 공동연구를 통해, 주변 빛을 활용해 배터리 전력 부담을 줄인 적응형 무선 웨어러블 플랫폼을 개발했다고 30일 밝혔다.
의료용 웨어러블 기기의 배터리 문제를 해결하기 위해, 권경하 교수 연구팀은 주변의 자연광을 에너지원으로 활용하는 혁신적인 플랫폼을 개발했다. 이 플랫폼은 세 가지 상호 보완적인 빛 에너지 기술을 통합한 것이 특징이다.
첫 번째 핵심 기술인 ‘광 측정 방식(Photometric Method)’은 주변 광원의 세기에 따라 LED 밝기를 적응적으로 조절하는 기술이다. 주변 자연광과 LED 빛을 합쳐 일정한 총 조명량을 유지하되, 자연광이 강할 때는 LED를 어둡게, 자연광이 약할 때는 LED를 밝게 자동 조절한다.
기존 센서가 환경과 관계없이 LED를 일정하게 켜야 했다면, 이 기술은 주변 환경에 맞춰 LED 전력을 실시간으로 최적화할 수 있다. 실험 결과, 충분한 조명 환경에서 전력 소모를 86.22%나 줄였다.
두 번째는 ‘고효율 다접합 태양전지(Photovoltaic Method)’ 기술이다. 이는 단순한 태양광 발전을 넘어서 실내외 모든 환경의 빛을 전력으로 변환한다. 특히 적응형 전력 관리 시스템을 통해 주변 환경과 배터리 상태에 따라 11가지 서로 다른 전력 구성으로 자동 전환되어 최적의 에너지 효율을 달성한다.
세 번째 혁신 기술은 ‘축광/발광(Photoluminescent Method)’기술이다. 스트론튬 알루미네이트 미세입자*를 센서의 실리콘 캡슐화 구조에 혼합해, 낮 동안 주변 빛을 흡수해 저장했다가 어둠 속에서 서서히 방출한다. 이를 통해 태양광 500W/m²에 10분간 노출되면 완전한 어둠에서도 2.5분간 연속 측정이 가능하다.
*스트론튬 알루미네이트 미세입자: 야광페인트나 안전 표지판에 사용되는 형광체로, 빛을 흡수한 후 어둠 속에서 오랫동안 발광하는 축광 소재
이 세 가지 기술이 상호 보완적으로 작동해 밝은 환경에서는 첫 번째와 두 번째 방식이, 어두운 환경에서는 세 번째 방식이 추가로 지원하는 방식으로 24시간 연속 작동을 가능하게 한다.
연구팀은 이 플랫폼을 다양한 의료 센서에 적용해 실용성을 검증했다. 광용적맥파 측정 센서는 심박수와 혈중산소포화도를 실시간으로 모니터링해 심혈관 질환의 조기 발견을 가능하게 한다. 청색광 노출량 측정 센서는 피부 노화와 손상을 유발하는 블루라이트를 정확히 측정해 개인 맞춤형 피부 보호 가이드를 제공한다. 땀 분석 센서는 마이크로 유체 기술을 활용, 땀 속 염분, 포도당, pH를 동시에 분석해 탈수나 전해질 불균형을 실시간으로 감지할 수 있다.
추가적으로 센서 내 데이터 처리 기술을 도입해 무선 통신으로 인한 전력 소모도 대폭 줄였다. 기존에는 모든 원시 데이터를 외부로 전송해야 했지만, 이제는 센서 내부에서 필요한 결과만 계산해 전송함으로써 데이터 전송량을 400B/s에서 4B/s로 100배 감소시켰다.
연구팀은 성능 검증을 위해 건강한 성인 피험자를 대상으로 밝은 실내조명, 어두운 조명, 적외선 조명, 완전한 어둠 등 4가지 서로 다른 환경에서 테스트했다. 그 결과, 모든 조건에서 상용 의료기기와 동등한 측정 정확도를 보였다. 생쥐 모델을 이용한 저산소 상태 실험에서도 정확한 혈중산소포화도 측정이 가능함을 확인했다.
연구를 주도한 권경하 교수는 “이 기술을 활용해 24시간 연속 건강 모니터링이 가능해짐에 따라 의료 패러다임이 치료 중심에서 예방 중심으로 전환될 수 있을 것”이라며, “조기 진단을 통한 의료비 절감 효과와 함께 차세대 웨어러블 헬스케어 시장에서의 기술경쟁력 확보도 기대된다”라고 말했다.
이번 연구 결과는 인공지능반도체대학원 박도윤 박사과정 학생이 공동 제 1 저자로 국제 학술지 네이처 커뮤니케이션스(Nature Communications)에 7월 1일 발표됐다.
※논문명 : Adaptive Electronics for Photovoltaic, Photoluminescent and Photometric Methods in Power Harvesting for Wireless and Wearable Sensors;
※DOI: URL: https://www.nature.com/articles/s41467-025-60911-1
한편, 이번 연구는 한국연구재단 우수신진연구, 지역혁신 선도연구센터 과제, 과학기술정보통신부 정보통신기획평가원(IITP) 인공지능반도체대학원 과제, 그리고 BK FOUR 프로그램(Connected AI Education & Research Program for Industry and Society Innovation, KAIST EE)의 지원을 받아 수행됐다.
2025.07.31 조회수 761 빛으로 단백질 · mRNA를 원할 때 꺼내 쓴다
기존의 ‘광유전학적 분자 응축물 기술(생체 분자를 빛을 사용해 특정한 덩어리(응축체)로 뭉치게 하거나 풀리게 조절하는 기술)’은 세포 안에서 여러 단백질이나 RNA가 다양하게 섞이기 때문에 원하는 분자만 골라서 다루기 어렵다는 한계가 있었다. 이 한계를 넘어, 우리 연구진이 ‘빛’을 쪼여 세포 속 특정 단백질이나 유전정보(mRNA)를 원하는 시점에 꺼내 쓸 수 있는 기술을 개발하여 유전자 조절 기술, 신약 개발 등에서의 새로운 가능성을 제시했다.
우리 대학 생명과학과 허원도 석좌교수 연구팀이 물리학과 박용근 석좌교수 연구팀과 협력하여, 단백질 및 mRNA를 세포 내에서 빛으로 원하는 시점에 저장(Store)하고 방출(Release)할 수 있는 ‘릴리저 기술(RELISR, REversible Light-Induced Store and Release)’을 개발했다고 23일 밝혔다.
이번 연구는 세포 내 다양한 생체 분자가 막이 없는 응축체(Biomolecular Condensate)에 저장돼 기능을 조절한다는 최신 세포기능 조절 원리를 빛으로 구현한 기술이다.
연구팀은 특정 분자와 선택적으로 결합하는 표적 부위가 부착된 광유전학 단백질 복합체를 증폭해, 빛 반응 분자 저장·방출 시스템인 릴리저 기술을 설계했다. 이를 통해 세포 및 생체 내에서 특정 단백질 혹은 mRNA를 릴리저에 안정적으로 저장해 빛을 비추면 원하는 시점에 방출할 수 있음을 증명했다.
연구팀은 다양한 세포주와 신경세포, 그리고 생쥐 간 조직 등에서 해당 시스템의 효과를 입증했다.
연구팀은 단백질을 저장⸱방출하는 단백질 방출시스템인 ‘단백질 릴리저 (Protein-RELISR)’를 통해 세포 모양 변화, 신경세포 내 국소 단백질 활성 등 미세 환경에서의 생화학 반응을 실시간으로 제어하는 데 성공했다.
아울러, mRNA를 표적으로 하는 mRNA 방출시스템인‘mRNA 릴리저 (mRNA-RELISR)’를 활용해, mRNA가 세포질 내에서 번역될 시점을 빛으로 조절하는 데 성공했으며, 실제 생쥐 모델에서도 mRNA 번역 조절이 가능함을 확인했다.
빛으로 표적 분자를 순간적으로 ‘가두는’ 기존 연구 LARIAT(단백질 올가미, 2014), mRNA-LARIAT(mRNA 올가미, 2019)에서 나아가, 이번 연구에서는 동일한 광자극으로 세포 내 무막 응축체에 저장된 단백질과 mRNA를 즉시 ‘방출해’단백질의 기능을 복원하고 mRNA 번역을 활성화할 수 있는 새로운 플랫폼을 제시했다.
연구를 주도한 허원도 석좌교수는 “릴리저(RELISR) 플랫폼은 광유전학 원리를 기반으로 단백질과 mRNA를 원하는 시간, 장소에서 저장하고 방출할 수 있는 범용 도구로, 뇌 신경세포 연구나 세포치료제, 차세대 신약 개발 등에 폭넓게 응용될 수 있다”며 “향후 유전자 가위(CRISPR-Cas) 시스템 등과의 결합이나, 조직 특이적 전달 기술(AAV 등)과 접목할 경우, 더욱 정밀한 치료 도구로 확장될 수 있을 것”이라고 설명했다.
이번 연구는 생명과학과 허원도 석좌교수(교신저자)의 지도로, 이채연 박사(연구 당시 학생, 제1 저자)가 중심이 되어 연구를 수행했다. 공동 교신저자인 물리학과 유다슬이 박사와 박용근 석좌교수도 연구에 참여했으며, 특히 박용근 교수 연구팀은 이미징 기반 분석을 통해 세포 내에서 ‘릴리저(RELISR)’ 시스템이 유도하는 생물리학적 변화를 정량적으로 평가하고, 실험 결과의 신뢰성과 객관성을 높이는 데 중요한 역할을 담당했다.
생명과학연구소 이채연 박사가 제1 저자로 주도한 이 연구는 국제 학술지 ‘네이처 커뮤니케이션스(Nature Communications)’에 2025년 7월 7일자로 게재됐다.
논문명: Optogenetic storage and release of protein and mRNA in live cells and animals
DOI: 10.1038/s41467-025-61322-y
한편, 이번 연구는 삼성미래기술육성재단과 한국연구재단 유전자편집·제어·복원기반기술개발사업의 지원을 받아 수행됐다.
2025.07.23 조회수 1318
빛으로 단백질 · mRNA를 원할 때 꺼내 쓴다
기존의 ‘광유전학적 분자 응축물 기술(생체 분자를 빛을 사용해 특정한 덩어리(응축체)로 뭉치게 하거나 풀리게 조절하는 기술)’은 세포 안에서 여러 단백질이나 RNA가 다양하게 섞이기 때문에 원하는 분자만 골라서 다루기 어렵다는 한계가 있었다. 이 한계를 넘어, 우리 연구진이 ‘빛’을 쪼여 세포 속 특정 단백질이나 유전정보(mRNA)를 원하는 시점에 꺼내 쓸 수 있는 기술을 개발하여 유전자 조절 기술, 신약 개발 등에서의 새로운 가능성을 제시했다.
우리 대학 생명과학과 허원도 석좌교수 연구팀이 물리학과 박용근 석좌교수 연구팀과 협력하여, 단백질 및 mRNA를 세포 내에서 빛으로 원하는 시점에 저장(Store)하고 방출(Release)할 수 있는 ‘릴리저 기술(RELISR, REversible Light-Induced Store and Release)’을 개발했다고 23일 밝혔다.
이번 연구는 세포 내 다양한 생체 분자가 막이 없는 응축체(Biomolecular Condensate)에 저장돼 기능을 조절한다는 최신 세포기능 조절 원리를 빛으로 구현한 기술이다.
연구팀은 특정 분자와 선택적으로 결합하는 표적 부위가 부착된 광유전학 단백질 복합체를 증폭해, 빛 반응 분자 저장·방출 시스템인 릴리저 기술을 설계했다. 이를 통해 세포 및 생체 내에서 특정 단백질 혹은 mRNA를 릴리저에 안정적으로 저장해 빛을 비추면 원하는 시점에 방출할 수 있음을 증명했다.
연구팀은 다양한 세포주와 신경세포, 그리고 생쥐 간 조직 등에서 해당 시스템의 효과를 입증했다.
연구팀은 단백질을 저장⸱방출하는 단백질 방출시스템인 ‘단백질 릴리저 (Protein-RELISR)’를 통해 세포 모양 변화, 신경세포 내 국소 단백질 활성 등 미세 환경에서의 생화학 반응을 실시간으로 제어하는 데 성공했다.
아울러, mRNA를 표적으로 하는 mRNA 방출시스템인‘mRNA 릴리저 (mRNA-RELISR)’를 활용해, mRNA가 세포질 내에서 번역될 시점을 빛으로 조절하는 데 성공했으며, 실제 생쥐 모델에서도 mRNA 번역 조절이 가능함을 확인했다.
빛으로 표적 분자를 순간적으로 ‘가두는’ 기존 연구 LARIAT(단백질 올가미, 2014), mRNA-LARIAT(mRNA 올가미, 2019)에서 나아가, 이번 연구에서는 동일한 광자극으로 세포 내 무막 응축체에 저장된 단백질과 mRNA를 즉시 ‘방출해’단백질의 기능을 복원하고 mRNA 번역을 활성화할 수 있는 새로운 플랫폼을 제시했다.
연구를 주도한 허원도 석좌교수는 “릴리저(RELISR) 플랫폼은 광유전학 원리를 기반으로 단백질과 mRNA를 원하는 시간, 장소에서 저장하고 방출할 수 있는 범용 도구로, 뇌 신경세포 연구나 세포치료제, 차세대 신약 개발 등에 폭넓게 응용될 수 있다”며 “향후 유전자 가위(CRISPR-Cas) 시스템 등과의 결합이나, 조직 특이적 전달 기술(AAV 등)과 접목할 경우, 더욱 정밀한 치료 도구로 확장될 수 있을 것”이라고 설명했다.
이번 연구는 생명과학과 허원도 석좌교수(교신저자)의 지도로, 이채연 박사(연구 당시 학생, 제1 저자)가 중심이 되어 연구를 수행했다. 공동 교신저자인 물리학과 유다슬이 박사와 박용근 석좌교수도 연구에 참여했으며, 특히 박용근 교수 연구팀은 이미징 기반 분석을 통해 세포 내에서 ‘릴리저(RELISR)’ 시스템이 유도하는 생물리학적 변화를 정량적으로 평가하고, 실험 결과의 신뢰성과 객관성을 높이는 데 중요한 역할을 담당했다.
생명과학연구소 이채연 박사가 제1 저자로 주도한 이 연구는 국제 학술지 ‘네이처 커뮤니케이션스(Nature Communications)’에 2025년 7월 7일자로 게재됐다.
논문명: Optogenetic storage and release of protein and mRNA in live cells and animals
DOI: 10.1038/s41467-025-61322-y
한편, 이번 연구는 삼성미래기술육성재단과 한국연구재단 유전자편집·제어·복원기반기술개발사업의 지원을 받아 수행됐다.
2025.07.23 조회수 1318 대기 오염 저감 위한 신개념 원자 촉매 설계
백금 셀레나이드는 백금(Pt)과 셀레늄(Se)이 층상 구조로 결합된 이차원 물질로, 우수한 결정성과 층간 상호작용의 정밀한 제어를 통해 다양한 물리적·화학적 특성의 조절이 가능한 것으로 알려져 있다. 이러한 특성으로 인해, 반도체, 광검출기, 전기화학 소자 등 다양한 분야에서 활발히 연구되어 왔다. 이번 연구진은 백금 셀레나이드 표면에 존재하는 원자 수준의 백금이 기체 반응에 대해 촉매로 기능할 수 있다는 새로운 설계 개념을 제시했으며, 이를 통해 고효율 이산화탄소 전환 및 일산화탄소 저감 등을 위한 차세대 기체상 촉매 기술로서의 가능성을 입증했다.
우리 대학 화학과 박정영 석좌교수 연구팀이 충남대학교 김현유 교수, 미국 센트럴플로리다대학교(UCF) 정연웅 교수 연구팀과 공동연구를 통해, 이차원 전이금속 칼코겐화합물인 백금 셀레나이드(PtSe₂) 표면에 노출된 백금 원자를 활용하여 우수한 일산화탄소 산화 성능을 구현하는 데 성공했다고 22일 밝혔다.
연구진은 촉매 성능을 극대화하기 위해 기존의 백금 덩어리 촉매 형태에서 백금 원자가 고밀도로 표면에 분산되도록 하여, 더 적은 양의 백금으로 더 많은 촉매반응을 유도하였으며, 표면의 전자 구조를 제어하여 백금과 셀레늄 사이의 전자 상호작용을 활발하게 일어나도록 유도하였다. 이 과정을 통해 제작된 수 나노미터 두께의 백금 셀레나이드 박막은, 동일 조건에서 일반 백금 박막보다 전 온도 범위에서 더 우수한 일산화탄소 산화 성능을 나타냈다.
특히, 표면에서는 일산화탄소와 산소가 골고루 비슷한 비율로 흡착되어 서로 반응할 기회가 높아졌고, 이로 인해 촉매 반응이 크게 향상됐다. 이러한 성능 향상의 핵심은 ‘셀레늄 결손(Se-vacancy)’으로 인해 노출이 확대된 표면 백금 원자들이 드러나면서 기체들이 붙을 수 있는 흡착점도 늘어났다는 데 있다.
연구진은 해당 백금 원자들이 실제 반응 과정에서 흡착점으로 작용했다는 사실을 포항가속기연구소에서 수행된 상압 엑스선 광전자분광(AP-XPS) 분석을 통해 실시간으로 확인했다. 이러한 고정밀 분석은 1나노미터 수준의 표면을 상압 환경에서 관찰할 수 있는 고도 장비 덕분에 가능했다. 동시에 컴퓨터 시뮬레이션 (밀도범함수이론*) 계산을 통해, 백금 셀레나이드가 일반 백금과는 다른 전자 흐름의 특성을 가지고 있음을 이론적으로도 입증했다.
*밀도범함수이론(Density Functional Theory, DFT): 전자 밀도(electron density)를 기반으로 시스템의 전체 에너지를 계산하는 방법
박정영 교수는 “이번 연구는 기존 백금 촉매와 다른 이차원 층상 구조의 백금 셀레나이드를 활용해, 기체 반응에 특화된 촉매 기능을 이끌어낸 새로운 설계 전략을 제시한 것”이라며, “백금과 셀레늄 사이의 전자적 상호작용이 일산화탄소와 산소를 균형있게 흡착하는 반응 조건을 만들었고 기존 백금보다 전체 온도내에서 반응성이 높도록 설계하여 실제 적용성이 향상되게 하였다. 이로써 원자 단위 설계, 2차원 물질 플랫폼, 흡착 조절 기술 등을 통해 고효율 촉매 반응 메커니즘을 구현할 수 있었다”고 밝혔다.
이번 연구는 우리 대학 화학과 한규호 박사, 충남대 신소재공학과 최혁 박사, 인하대 김종훈 교수가 공동 제1 저자로 참여했으며, 세계적 권위의 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 지난 7월 3일 자로 게재됐다.
※ 논문 제목: Enhanced catalytic activity on atomically dispersed PtSe2 two-dimensional layers
※DOI: 10.1038/s41467-025-61320-0
한편, 이번 연구는 과학기술정보통신부의 중견연구자지원사업과 교육부의 중점연구소사업, 국가전략기술소재개발사업, 미국 국립과학재단(NSF) CAREER 프로그램, 인하대학교 연구비, UCF 박사후연구자 프로그램(P3)의 지원을 받아 수행됐으며, 포항가속기연구소 및 한국기초과학지원연구원(KBSI)의 협조로 가속기 기반 분석이 진행됐다.
2025.07.22 조회수 977
대기 오염 저감 위한 신개념 원자 촉매 설계
백금 셀레나이드는 백금(Pt)과 셀레늄(Se)이 층상 구조로 결합된 이차원 물질로, 우수한 결정성과 층간 상호작용의 정밀한 제어를 통해 다양한 물리적·화학적 특성의 조절이 가능한 것으로 알려져 있다. 이러한 특성으로 인해, 반도체, 광검출기, 전기화학 소자 등 다양한 분야에서 활발히 연구되어 왔다. 이번 연구진은 백금 셀레나이드 표면에 존재하는 원자 수준의 백금이 기체 반응에 대해 촉매로 기능할 수 있다는 새로운 설계 개념을 제시했으며, 이를 통해 고효율 이산화탄소 전환 및 일산화탄소 저감 등을 위한 차세대 기체상 촉매 기술로서의 가능성을 입증했다.
우리 대학 화학과 박정영 석좌교수 연구팀이 충남대학교 김현유 교수, 미국 센트럴플로리다대학교(UCF) 정연웅 교수 연구팀과 공동연구를 통해, 이차원 전이금속 칼코겐화합물인 백금 셀레나이드(PtSe₂) 표면에 노출된 백금 원자를 활용하여 우수한 일산화탄소 산화 성능을 구현하는 데 성공했다고 22일 밝혔다.
연구진은 촉매 성능을 극대화하기 위해 기존의 백금 덩어리 촉매 형태에서 백금 원자가 고밀도로 표면에 분산되도록 하여, 더 적은 양의 백금으로 더 많은 촉매반응을 유도하였으며, 표면의 전자 구조를 제어하여 백금과 셀레늄 사이의 전자 상호작용을 활발하게 일어나도록 유도하였다. 이 과정을 통해 제작된 수 나노미터 두께의 백금 셀레나이드 박막은, 동일 조건에서 일반 백금 박막보다 전 온도 범위에서 더 우수한 일산화탄소 산화 성능을 나타냈다.
특히, 표면에서는 일산화탄소와 산소가 골고루 비슷한 비율로 흡착되어 서로 반응할 기회가 높아졌고, 이로 인해 촉매 반응이 크게 향상됐다. 이러한 성능 향상의 핵심은 ‘셀레늄 결손(Se-vacancy)’으로 인해 노출이 확대된 표면 백금 원자들이 드러나면서 기체들이 붙을 수 있는 흡착점도 늘어났다는 데 있다.
연구진은 해당 백금 원자들이 실제 반응 과정에서 흡착점으로 작용했다는 사실을 포항가속기연구소에서 수행된 상압 엑스선 광전자분광(AP-XPS) 분석을 통해 실시간으로 확인했다. 이러한 고정밀 분석은 1나노미터 수준의 표면을 상압 환경에서 관찰할 수 있는 고도 장비 덕분에 가능했다. 동시에 컴퓨터 시뮬레이션 (밀도범함수이론*) 계산을 통해, 백금 셀레나이드가 일반 백금과는 다른 전자 흐름의 특성을 가지고 있음을 이론적으로도 입증했다.
*밀도범함수이론(Density Functional Theory, DFT): 전자 밀도(electron density)를 기반으로 시스템의 전체 에너지를 계산하는 방법
박정영 교수는 “이번 연구는 기존 백금 촉매와 다른 이차원 층상 구조의 백금 셀레나이드를 활용해, 기체 반응에 특화된 촉매 기능을 이끌어낸 새로운 설계 전략을 제시한 것”이라며, “백금과 셀레늄 사이의 전자적 상호작용이 일산화탄소와 산소를 균형있게 흡착하는 반응 조건을 만들었고 기존 백금보다 전체 온도내에서 반응성이 높도록 설계하여 실제 적용성이 향상되게 하였다. 이로써 원자 단위 설계, 2차원 물질 플랫폼, 흡착 조절 기술 등을 통해 고효율 촉매 반응 메커니즘을 구현할 수 있었다”고 밝혔다.
이번 연구는 우리 대학 화학과 한규호 박사, 충남대 신소재공학과 최혁 박사, 인하대 김종훈 교수가 공동 제1 저자로 참여했으며, 세계적 권위의 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 지난 7월 3일 자로 게재됐다.
※ 논문 제목: Enhanced catalytic activity on atomically dispersed PtSe2 two-dimensional layers
※DOI: 10.1038/s41467-025-61320-0
한편, 이번 연구는 과학기술정보통신부의 중견연구자지원사업과 교육부의 중점연구소사업, 국가전략기술소재개발사업, 미국 국립과학재단(NSF) CAREER 프로그램, 인하대학교 연구비, UCF 박사후연구자 프로그램(P3)의 지원을 받아 수행됐으며, 포항가속기연구소 및 한국기초과학지원연구원(KBSI)의 협조로 가속기 기반 분석이 진행됐다.
2025.07.22 조회수 977 음주로 인한 간염 유발 원리 최초 밝혔다
과도한 음주는 알코올성 간질환을 유발하며, 이 중 약 20%는 알코올 지방간염으로 진행되고 이는 간경변증과 간부전으로 이어질 수 있어 조기 진단과 치료가 매우 중요하다. 우리 연구진은 음주 시 활성산소(ROS)가 발생해 간세포 사멸과 염증 반응을 유발하는 새로운 분자 메커니즘을 규명했다. 아울러, 간세포가 신경계의 시냅스처럼 신호를 주고 받는 유사시냅스를 형성하고 염증을 유도하는 ‘새로운 신경학적 경로’를 세계 최초로 밝혀냈다.
우리 대학 의과학대학원 정원일 교수 연구팀이 서울대 보라매 병원 김원 교수 연구팀과의 공동 연구를 통해, 음주로 인한 간 손상 및 염증(알코올 지방간염, Alcohol-associated Steatohepatitis, ASH)의 발생 기전을 분자 수준에서 규명해 알코올 간질환의 진단과 치료에 단서를 제시했다고 17일 밝혔다.
정원일 교수 연구팀은 만성 음주 시 ‘소포성 글루탐산 수송체(VGLUT3)’의 발현 증가로 글루탐산이 간세포에 축적되며, 이후 폭음으로 인한 간세포 내 칼슘 농도의 급격한 변화가 글루탐산* 분비를 유도함을 확인했다.
*글루탐산: 아미노산의 일종으로, 뇌와 간을 포함한 다양한 조직에서 세포 간 신호전달, 단백질 합성, 에너지 대사 등에 관여하며 지나치게 많으면 신경세포가 과흥분하여 세포 손상 또는 사멸하게 함
분비된 글루탐산은 간 내 상주 대식세포인 쿠퍼세포의 글루탐산 수용체(mGluR5)를 자극해 활성산소(ROS) 생성을 유도하고, 이는 곧 간세포 사멸과 염증 반응으로 이어지는 병리적 경로를 형성한다는 사실을 밝혀냈다.
특히 이번 연구의 핵심은, 음주 시 간 내에서 간세포와 쿠퍼세포가 일시적으로 신경계에서만 관찰되던 시냅스와 비슷한 구조인‘유사시냅스(pseudosynapse)’를 형성해 신호를 주고받는 현상을 처음으로 규명했다는 점이다.
이 유사시냅스 혹은 대사시냅스(metabolic synapse)는 음주로 인해 간세포가 팽창(ballooning)되면서 쿠퍼세포와 물리적으로 밀착될 때 형성된다. 즉, 손상된 간세포가 단순히 사멸하는 것이 아니라, 인접한 쿠퍼세포에 신호를 보내 면역 반응을 유도할 수 있다는 의미이다.
이러한 발견은 말초 장기에서도 ‘세포 간 밀접한 구조적 접촉을 통해 신호전달이 가능하다’라는 새로운 패러다임을 제시하며, 단순한 간세포 손상을 넘어 알코올로 손상된 간세포가 능동적으로 대식세포를 자극해 간세포의 사멸을 통한 재생을 유도하는‘자율 회복기능’도 존재함을 보여줬다.
실제로 연구팀은 글루탐산 수송체(VGLUT3), 글루탐산 수용체(mGluR5) 및 활성산소 생성 효소(NOX2)를 유전적 또는 약리적으로 억제하면 알코올 매개 간 손상이 줄어든다는 사실을 동물 모델을 통해 입증했다. 이러한 기전을 기반으로, 연구팀은 알코올성 간질환 환자의 혈액과 간 조직을 분석해 해당 메커니즘이 임상적으로도 적용될 수 있음을 제시했다.
의과학대학원 정원일 교수는 “이는 향후 알코올 지방간염(ASH)의 발병 초기 단계에서 진단용으로 혹은 치료를 위한 새로운 분자 표적으로 활용될 수 있다”라고 말했다.
의과학대학원 양경모 박사(현, 여의도 성모병원)와 김규래 박사과정생이 공동 제1 저자로 참여한 이번 연구는 서울대 보라매병원 김원 교수 연구팀과 함께 진행됐으며, 국제 학술지 `네이처 커뮤니케이션즈(Nature communications)' 지난 7월 1일 자로 출판됐다.
※ 논문명: Binge drinking triggers VGLUT3-mediated glutamate secretion and subsequent hepatic inflammation by activating mGluR5/NOX2 in Kupffer cells
※ DOI: 10.1038/s41467-025-60820-3.
한편, 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 글로벌 리더연구, 중견연구자사업 및 바이오·의료기술개발사업의 지원으로 수행됐다.
2025.07.17 조회수 1202
음주로 인한 간염 유발 원리 최초 밝혔다
과도한 음주는 알코올성 간질환을 유발하며, 이 중 약 20%는 알코올 지방간염으로 진행되고 이는 간경변증과 간부전으로 이어질 수 있어 조기 진단과 치료가 매우 중요하다. 우리 연구진은 음주 시 활성산소(ROS)가 발생해 간세포 사멸과 염증 반응을 유발하는 새로운 분자 메커니즘을 규명했다. 아울러, 간세포가 신경계의 시냅스처럼 신호를 주고 받는 유사시냅스를 형성하고 염증을 유도하는 ‘새로운 신경학적 경로’를 세계 최초로 밝혀냈다.
우리 대학 의과학대학원 정원일 교수 연구팀이 서울대 보라매 병원 김원 교수 연구팀과의 공동 연구를 통해, 음주로 인한 간 손상 및 염증(알코올 지방간염, Alcohol-associated Steatohepatitis, ASH)의 발생 기전을 분자 수준에서 규명해 알코올 간질환의 진단과 치료에 단서를 제시했다고 17일 밝혔다.
정원일 교수 연구팀은 만성 음주 시 ‘소포성 글루탐산 수송체(VGLUT3)’의 발현 증가로 글루탐산이 간세포에 축적되며, 이후 폭음으로 인한 간세포 내 칼슘 농도의 급격한 변화가 글루탐산* 분비를 유도함을 확인했다.
*글루탐산: 아미노산의 일종으로, 뇌와 간을 포함한 다양한 조직에서 세포 간 신호전달, 단백질 합성, 에너지 대사 등에 관여하며 지나치게 많으면 신경세포가 과흥분하여 세포 손상 또는 사멸하게 함
분비된 글루탐산은 간 내 상주 대식세포인 쿠퍼세포의 글루탐산 수용체(mGluR5)를 자극해 활성산소(ROS) 생성을 유도하고, 이는 곧 간세포 사멸과 염증 반응으로 이어지는 병리적 경로를 형성한다는 사실을 밝혀냈다.
특히 이번 연구의 핵심은, 음주 시 간 내에서 간세포와 쿠퍼세포가 일시적으로 신경계에서만 관찰되던 시냅스와 비슷한 구조인‘유사시냅스(pseudosynapse)’를 형성해 신호를 주고받는 현상을 처음으로 규명했다는 점이다.
이 유사시냅스 혹은 대사시냅스(metabolic synapse)는 음주로 인해 간세포가 팽창(ballooning)되면서 쿠퍼세포와 물리적으로 밀착될 때 형성된다. 즉, 손상된 간세포가 단순히 사멸하는 것이 아니라, 인접한 쿠퍼세포에 신호를 보내 면역 반응을 유도할 수 있다는 의미이다.
이러한 발견은 말초 장기에서도 ‘세포 간 밀접한 구조적 접촉을 통해 신호전달이 가능하다’라는 새로운 패러다임을 제시하며, 단순한 간세포 손상을 넘어 알코올로 손상된 간세포가 능동적으로 대식세포를 자극해 간세포의 사멸을 통한 재생을 유도하는‘자율 회복기능’도 존재함을 보여줬다.
실제로 연구팀은 글루탐산 수송체(VGLUT3), 글루탐산 수용체(mGluR5) 및 활성산소 생성 효소(NOX2)를 유전적 또는 약리적으로 억제하면 알코올 매개 간 손상이 줄어든다는 사실을 동물 모델을 통해 입증했다. 이러한 기전을 기반으로, 연구팀은 알코올성 간질환 환자의 혈액과 간 조직을 분석해 해당 메커니즘이 임상적으로도 적용될 수 있음을 제시했다.
의과학대학원 정원일 교수는 “이는 향후 알코올 지방간염(ASH)의 발병 초기 단계에서 진단용으로 혹은 치료를 위한 새로운 분자 표적으로 활용될 수 있다”라고 말했다.
의과학대학원 양경모 박사(현, 여의도 성모병원)와 김규래 박사과정생이 공동 제1 저자로 참여한 이번 연구는 서울대 보라매병원 김원 교수 연구팀과 함께 진행됐으며, 국제 학술지 `네이처 커뮤니케이션즈(Nature communications)' 지난 7월 1일 자로 출판됐다.
※ 논문명: Binge drinking triggers VGLUT3-mediated glutamate secretion and subsequent hepatic inflammation by activating mGluR5/NOX2 in Kupffer cells
※ DOI: 10.1038/s41467-025-60820-3.
한편, 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 글로벌 리더연구, 중견연구자사업 및 바이오·의료기술개발사업의 지원으로 수행됐다.
2025.07.17 조회수 1202 6배 정밀한 3D 뇌 모사 플랫폼 구현 성공
기존의 3차원(3D) 신경세포 배양 기술은 뇌의 복잡한 다층 구조를 정밀하게 구현하기 어렵고, 구조와 기능을 동시에 분석할 수 있는 플랫폼이 부족해 뇌 연구에 제약이 있었다. 우리 연구진이 뇌처럼 층을 이루는 신경세포 구조를 3D 프린팅 기술로 구현하고, 그 안에서 신경세포의 활동까지 정밀하게 측정할 수 있는 통합 플랫폼 개발에 성공했다.
우리 대학 바이오및뇌공학과 박제균·남윤기 교수 공동연구팀이 뇌 조직과 유사한 기계적 특성을 가진 저점도 천연 하이드로겔을 이용해 고해상도 3D 다층 신경세포 네트워크를 제작하고, 구조적·기능적 연결성을 동시에 분석할 수 있는 통합 플랫폼을 개발했다고 16일 밝혔다.
기존 바이오프린팅 기술은 구조적 안정성을 위해 고점도 바이오잉크를 사용하지만, 이는 신경세포의 증식과 신경돌기 성장을 제한하고, 반대로 신경세포 친화적인 저점도 하이드로겔은 정밀한 패턴 형성이 어려워 구조적 안정성과 생물학적 기능 사이의 근본적인 상충 관계가 있었다.
연구팀은 묽은 젤로도 정밀한 뇌 구조를 만들고, 층마다 정확히 정렬하며, 신경세포의 활동까지 동시에 관찰할 수 있는 3대 핵심기술을 결합해 정교하고 안정적인 뇌 모사 플랫폼을 완성했다.
3대 핵심기술은 ▲ 묽은 젤(하이드로겔)이 흐르지 않도록 스테인리스 철망(마이크로메시) 위에 딱 붙게 만들어 주는‘모세관 고정 효과’ 기술로 기존보다 6배 더 정밀하게 (해상도 500μm 이하) 뇌 구조를 재현했고 ▲ 프린팅된 층들이 삐뚤어지지 않고 정확히 쌓이도록 맞춰주는 원통형 설계인 ‘3D 프린팅 정렬기’로 다층 구조체의 정밀한 조립과 미세 전극 칩과의 안정적 결합을 보장하였고 ▲ 아래쪽은 전기신호를 측정하고, 위쪽은 빛(칼슘 이미징)으로 동시에 세포 활동을 관찰하는 ‘이중 모드 분석 시스템’기술로 층간 연결이 실제로 작동하는지를 여러 방식으로 동시에 확인할 수 있다.
연구팀은 뇌와 유사한 탄성 특성을 지닌 피브린 하이드로겔을 이용해 3층으로 구성된 미니 뇌 구조를 3D 프린팅으로 구현하고, 그 안에서 실제 신경세포들이 신호를 주고받는 과정을 실험을 통해 입증했다.
위층과 아래층에는 대뇌 신경세포를 배치하고, 가운데층은 비어 있지만, 신경세포들이 가운데를 뚫고 지나가며 연결되도록 설계했다. 아래층에는 미세 센서(전극칩)를 달아 전기신호를 측정하고, 위층은 빛(칼슘 이미징)으로 세포 활동을 관찰한 결과, 전기 자극을 줬을 때 위아래층 신경세포가 동시에 반응했고, 신경 연결을 차단하는 약물(시냅스 차단제)을 넣었더니 반응이 줄어들어 신경세포들이 진짜로 연결돼서 신호를 주고받고 있다는 것을 입증했다.
바이오및뇌공학과 박제균 교수는 “이번 연구는 뇌 조직의 복잡한 다층 구조와 기능을 동시에 재현할 수 있는 통합 플랫폼의 공동개발 성과”임을 강조하며, “기존 기술로 14일 이상은 신호 측정이 불가했던 것에 비해 27일 이상 안정적인 미세 전극 칩 인터페이스를 유지하면서 구조-기능 관계를 실시간으로 분석할 수 있어, 향후 신경질환 모델링, 뇌 기능 연구, 신경독성 평가 및 신경 보호 약물 스크리닝 등 다양한 뇌 연구 분야에 활용할 수 있을 것”이라고 말했다.
바이오및뇌공학과 김수지 박사와 윤동조 박사가 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘바이오센서스 앤 바이오일렉트로닉스(Biosensors and Bioelectronics)’에 2025년 6월 11일 자로 온라인판에 게재됐다.
※논문명: Hybrid biofabrication of multilayered 3D neuronal networks with structural and functional interlayer connectivity
※DOI: https://doi.org/10.1016/j.bios.2025.117688
한편, 이번 연구는 한국연구재단 글로벌 기초연구실지원사업, 중견연구 및 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2025.07.16 조회수 997
6배 정밀한 3D 뇌 모사 플랫폼 구현 성공
기존의 3차원(3D) 신경세포 배양 기술은 뇌의 복잡한 다층 구조를 정밀하게 구현하기 어렵고, 구조와 기능을 동시에 분석할 수 있는 플랫폼이 부족해 뇌 연구에 제약이 있었다. 우리 연구진이 뇌처럼 층을 이루는 신경세포 구조를 3D 프린팅 기술로 구현하고, 그 안에서 신경세포의 활동까지 정밀하게 측정할 수 있는 통합 플랫폼 개발에 성공했다.
우리 대학 바이오및뇌공학과 박제균·남윤기 교수 공동연구팀이 뇌 조직과 유사한 기계적 특성을 가진 저점도 천연 하이드로겔을 이용해 고해상도 3D 다층 신경세포 네트워크를 제작하고, 구조적·기능적 연결성을 동시에 분석할 수 있는 통합 플랫폼을 개발했다고 16일 밝혔다.
기존 바이오프린팅 기술은 구조적 안정성을 위해 고점도 바이오잉크를 사용하지만, 이는 신경세포의 증식과 신경돌기 성장을 제한하고, 반대로 신경세포 친화적인 저점도 하이드로겔은 정밀한 패턴 형성이 어려워 구조적 안정성과 생물학적 기능 사이의 근본적인 상충 관계가 있었다.
연구팀은 묽은 젤로도 정밀한 뇌 구조를 만들고, 층마다 정확히 정렬하며, 신경세포의 활동까지 동시에 관찰할 수 있는 3대 핵심기술을 결합해 정교하고 안정적인 뇌 모사 플랫폼을 완성했다.
3대 핵심기술은 ▲ 묽은 젤(하이드로겔)이 흐르지 않도록 스테인리스 철망(마이크로메시) 위에 딱 붙게 만들어 주는‘모세관 고정 효과’ 기술로 기존보다 6배 더 정밀하게 (해상도 500μm 이하) 뇌 구조를 재현했고 ▲ 프린팅된 층들이 삐뚤어지지 않고 정확히 쌓이도록 맞춰주는 원통형 설계인 ‘3D 프린팅 정렬기’로 다층 구조체의 정밀한 조립과 미세 전극 칩과의 안정적 결합을 보장하였고 ▲ 아래쪽은 전기신호를 측정하고, 위쪽은 빛(칼슘 이미징)으로 동시에 세포 활동을 관찰하는 ‘이중 모드 분석 시스템’기술로 층간 연결이 실제로 작동하는지를 여러 방식으로 동시에 확인할 수 있다.
연구팀은 뇌와 유사한 탄성 특성을 지닌 피브린 하이드로겔을 이용해 3층으로 구성된 미니 뇌 구조를 3D 프린팅으로 구현하고, 그 안에서 실제 신경세포들이 신호를 주고받는 과정을 실험을 통해 입증했다.
위층과 아래층에는 대뇌 신경세포를 배치하고, 가운데층은 비어 있지만, 신경세포들이 가운데를 뚫고 지나가며 연결되도록 설계했다. 아래층에는 미세 센서(전극칩)를 달아 전기신호를 측정하고, 위층은 빛(칼슘 이미징)으로 세포 활동을 관찰한 결과, 전기 자극을 줬을 때 위아래층 신경세포가 동시에 반응했고, 신경 연결을 차단하는 약물(시냅스 차단제)을 넣었더니 반응이 줄어들어 신경세포들이 진짜로 연결돼서 신호를 주고받고 있다는 것을 입증했다.
바이오및뇌공학과 박제균 교수는 “이번 연구는 뇌 조직의 복잡한 다층 구조와 기능을 동시에 재현할 수 있는 통합 플랫폼의 공동개발 성과”임을 강조하며, “기존 기술로 14일 이상은 신호 측정이 불가했던 것에 비해 27일 이상 안정적인 미세 전극 칩 인터페이스를 유지하면서 구조-기능 관계를 실시간으로 분석할 수 있어, 향후 신경질환 모델링, 뇌 기능 연구, 신경독성 평가 및 신경 보호 약물 스크리닝 등 다양한 뇌 연구 분야에 활용할 수 있을 것”이라고 말했다.
바이오및뇌공학과 김수지 박사와 윤동조 박사가 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘바이오센서스 앤 바이오일렉트로닉스(Biosensors and Bioelectronics)’에 2025년 6월 11일 자로 온라인판에 게재됐다.
※논문명: Hybrid biofabrication of multilayered 3D neuronal networks with structural and functional interlayer connectivity
※DOI: https://doi.org/10.1016/j.bios.2025.117688
한편, 이번 연구는 한국연구재단 글로벌 기초연구실지원사업, 중견연구 및 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2025.07.16 조회수 997 로봇도 사람처럼 위험할때만 즉각 반응한다
인공지능과 로봇 기술의 동반 발전 속에서, 로봇이 사람처럼 효율적으로 환경을 인식하고 반응하는 기술 확보가 중요한 과제로 떠오르고 있다. 이에 한국 연구진이 별도의 복잡한 소프트웨어나 회로 없이도 생명체의 감각 신경계를 모사한 인공 감각 신경계를 새롭게 구현해 주목받고 있다. 이 기술은 에너지 소모를 최소화하면서 외부 자극에 지능적으로 반응할 수 있어, 초소형 로봇이나 로봇 의수 등 의료 및 특수 환경에서의 활용이 기대된다.
우리 대학 전기및전자공학부 최신현 석좌교수, 충남대학교 반도체융합학과 이종원 교수 공동연구팀이 생명체의 감각 신경계 기능을 모사하는 차세대 뉴로모픽 반도체 기반 인공 감각 신경계를 개발하고, 이를 통해 외부 자극에 효율적으로 대응하는 신개념 로봇 시스템을 증명했다고 15일 밝혔다.
사람을 포함한 동물은 안전하거나 익숙한 자극은 무시하고, 중요한 자극에는 선별적으로 민감하게 반응함으로써, 에너지 낭비를 방지하면서도 중요한 자극에 집중해 민첩하게 외부 변화에 대응할 수 있다.
예를 들면, 여름철 에어컨 소리나 옷이 피부에 닿는 감촉은 곧 익숙해져 신경 쓰지 않게 되지만, 누군가 이름을 부르거나 날카로운 물체가 피부에 닿으면 재빠르게 집중하고 대응한다.
이는 감각 신경계에서의 ‘습관화’ 그리고 ‘민감화’기능에 의해서 조절됨을 보여주며, 사람처럼 효율적으로 외부 환경에 대응하는 로봇 구현을 위해, 이러한 생명체의 감각 신경계 기능을 로봇에 적용하려는 시도가 꾸준히 진행돼왔다.
그러나, 습관화나 민감화와 같은 복잡한 신경 특성을 로봇에 구현하기 위해선 별도 소프트웨어가 필요하거나, 복잡한 회로가 필요해 소형화와 에너지 효율 측면에서의 어려움이 있었다.
특히 뉴로모픽 반도체인 멤리스터(memristor)1 소자를 활용하는 시도도 있었지만, 기존 멤리스터는 단순한 전도도 변화만 가능해 신경계의 복잡한 특성을 모사하는 데 한계가 있었다.
1멤리스터: 메모리(memory)와 저항(resistor)의 합성어로 두 단자 사이로 과거에 흐른 전하량과 방향에 따라 저항값이 결정되는 차세대 전기소자
이러한 한계를 극복하기 위해 연구팀은 하나의 멤리스터 소자 안에 서로 반대 방향으로 전도도를 변화시키는 층을 형성해, 실제 감각 신경계에서처럼 습관화와 민감화 등의 기능을 모사할 수 있는 새로운 멤리스터를 개발했다.
이 소자는 자극이 반복되면 점차 반응이 줄어들다가, 위험 신호가 감지되면 다시 민감하게 반응하는 등, 실제 신경계의 복잡한 시냅스 반응 패턴을 사실적으로 재현할 수 있다.
연구팀은 이 멤리스터를 이용해 촉각과 고통을 인식하는 멤리스터 기반 인공 감각 신경계를 제작하고, 이를 실제 로봇 손에 적용해 그 효율성을 실험했다.
반복적으로 안전한 촉각 자극을 가하자, 처음에는 낯선 촉각 자극에 민감하게 반응하던 로봇 손이 점차 자극을 무시하는 습관화 특성을 보였고, 이후 전기 충격과 함께 자극을 가했을 때는 이를 위험 신호로 인식해 다시 민감하게 반응하는 민감화 특성도 확인됐다.
이를 통해, 별도의 복잡한 소프트웨어나 프로세서 없이도 로봇이 사람처럼 효율적으로 자극에 대응할 수 있음을 실험적으로 입증하며, 에너지 측면에서 효율적인 신경계 모사 로봇(neuro-inspired robot)의 개발 가능성을 검증했다.
박시온 연구원은 “사람의 감각 신경계를 차세대 반도체로 모사해, 더 똑똑하고 에너지 측면에서 효율적으로 외부 환경에 대응하는 신개념 로봇 구현의 가능성을 열었다”라며, “앞으로 초소형 로봇, 군용 로봇, 로봇 의수 같은 의료용 로봇 등 차세대 반도체와 로보틱스의 여러 융합 분야에서 활용될 것으로 기대된다”고 밝혔다.
이번 연구는 박시온 석박통합과정 연구원이 제 1저자로 국제 학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 지난 7월 1일 자로 온라인 게재됐다.
※ 논문 제목: Experimental demonstration of third-order memristor-based artificial sensory nervous system for neuro-inspired robotics
※ DOI: https://doi.org/10.1038/s41467-025-60818-x
이번 연구는 한국연구재단의 차세대지능형반도체기술개발사업, 중견연구사업, PIM인공지능반도체핵심기술개발사업, 우수신진연구사업, 그리고 나노종합기술원의 나노메디컬 디바이스 사업의 지원을 받아 수행됐다.
2025.07.15 조회수 997
로봇도 사람처럼 위험할때만 즉각 반응한다
인공지능과 로봇 기술의 동반 발전 속에서, 로봇이 사람처럼 효율적으로 환경을 인식하고 반응하는 기술 확보가 중요한 과제로 떠오르고 있다. 이에 한국 연구진이 별도의 복잡한 소프트웨어나 회로 없이도 생명체의 감각 신경계를 모사한 인공 감각 신경계를 새롭게 구현해 주목받고 있다. 이 기술은 에너지 소모를 최소화하면서 외부 자극에 지능적으로 반응할 수 있어, 초소형 로봇이나 로봇 의수 등 의료 및 특수 환경에서의 활용이 기대된다.
우리 대학 전기및전자공학부 최신현 석좌교수, 충남대학교 반도체융합학과 이종원 교수 공동연구팀이 생명체의 감각 신경계 기능을 모사하는 차세대 뉴로모픽 반도체 기반 인공 감각 신경계를 개발하고, 이를 통해 외부 자극에 효율적으로 대응하는 신개념 로봇 시스템을 증명했다고 15일 밝혔다.
사람을 포함한 동물은 안전하거나 익숙한 자극은 무시하고, 중요한 자극에는 선별적으로 민감하게 반응함으로써, 에너지 낭비를 방지하면서도 중요한 자극에 집중해 민첩하게 외부 변화에 대응할 수 있다.
예를 들면, 여름철 에어컨 소리나 옷이 피부에 닿는 감촉은 곧 익숙해져 신경 쓰지 않게 되지만, 누군가 이름을 부르거나 날카로운 물체가 피부에 닿으면 재빠르게 집중하고 대응한다.
이는 감각 신경계에서의 ‘습관화’ 그리고 ‘민감화’기능에 의해서 조절됨을 보여주며, 사람처럼 효율적으로 외부 환경에 대응하는 로봇 구현을 위해, 이러한 생명체의 감각 신경계 기능을 로봇에 적용하려는 시도가 꾸준히 진행돼왔다.
그러나, 습관화나 민감화와 같은 복잡한 신경 특성을 로봇에 구현하기 위해선 별도 소프트웨어가 필요하거나, 복잡한 회로가 필요해 소형화와 에너지 효율 측면에서의 어려움이 있었다.
특히 뉴로모픽 반도체인 멤리스터(memristor)1 소자를 활용하는 시도도 있었지만, 기존 멤리스터는 단순한 전도도 변화만 가능해 신경계의 복잡한 특성을 모사하는 데 한계가 있었다.
1멤리스터: 메모리(memory)와 저항(resistor)의 합성어로 두 단자 사이로 과거에 흐른 전하량과 방향에 따라 저항값이 결정되는 차세대 전기소자
이러한 한계를 극복하기 위해 연구팀은 하나의 멤리스터 소자 안에 서로 반대 방향으로 전도도를 변화시키는 층을 형성해, 실제 감각 신경계에서처럼 습관화와 민감화 등의 기능을 모사할 수 있는 새로운 멤리스터를 개발했다.
이 소자는 자극이 반복되면 점차 반응이 줄어들다가, 위험 신호가 감지되면 다시 민감하게 반응하는 등, 실제 신경계의 복잡한 시냅스 반응 패턴을 사실적으로 재현할 수 있다.
연구팀은 이 멤리스터를 이용해 촉각과 고통을 인식하는 멤리스터 기반 인공 감각 신경계를 제작하고, 이를 실제 로봇 손에 적용해 그 효율성을 실험했다.
반복적으로 안전한 촉각 자극을 가하자, 처음에는 낯선 촉각 자극에 민감하게 반응하던 로봇 손이 점차 자극을 무시하는 습관화 특성을 보였고, 이후 전기 충격과 함께 자극을 가했을 때는 이를 위험 신호로 인식해 다시 민감하게 반응하는 민감화 특성도 확인됐다.
이를 통해, 별도의 복잡한 소프트웨어나 프로세서 없이도 로봇이 사람처럼 효율적으로 자극에 대응할 수 있음을 실험적으로 입증하며, 에너지 측면에서 효율적인 신경계 모사 로봇(neuro-inspired robot)의 개발 가능성을 검증했다.
박시온 연구원은 “사람의 감각 신경계를 차세대 반도체로 모사해, 더 똑똑하고 에너지 측면에서 효율적으로 외부 환경에 대응하는 신개념 로봇 구현의 가능성을 열었다”라며, “앞으로 초소형 로봇, 군용 로봇, 로봇 의수 같은 의료용 로봇 등 차세대 반도체와 로보틱스의 여러 융합 분야에서 활용될 것으로 기대된다”고 밝혔다.
이번 연구는 박시온 석박통합과정 연구원이 제 1저자로 국제 학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 지난 7월 1일 자로 온라인 게재됐다.
※ 논문 제목: Experimental demonstration of third-order memristor-based artificial sensory nervous system for neuro-inspired robotics
※ DOI: https://doi.org/10.1038/s41467-025-60818-x
이번 연구는 한국연구재단의 차세대지능형반도체기술개발사업, 중견연구사업, PIM인공지능반도체핵심기술개발사업, 우수신진연구사업, 그리고 나노종합기술원의 나노메디컬 디바이스 사업의 지원을 받아 수행됐다.
2025.07.15 조회수 997 뇌는 포도당을 구별한다..비만·당뇨 치료의 단서 찾아
‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해낼까?’ 우리 대학 연구진은 이 질문에서 출발해, 뇌가 단순히 총열량(칼로리)을 감지하는 수준을 넘어 특정 영양소, 특히 포도당을 선택적으로 인식할 수 있다는 사실을 입증했다. 이번 연구는 향후 식욕 조절 및 대사성 질환 치료 전략에 새로운 패러다임을 제시할 수 있을 것으로 기대된다.
우리 대학 생명과학과 서성배 교수 연구팀이 바이오및뇌공학과 박영균 교수팀, 생명과학과 이승희 교수팀, 뉴욕 알버트 아인슈타인 의과대학과의 협력을 통해, 배고픔 상태에서 포도당이 결핍된 동물이 장내의 포도당을 선택적으로 인식하고 선호하도록 유도하는 장-뇌 회로의 존재를 규명했다고 9일 밝혔다.
생물은 당, 단백질, 지방 등 다양한 영양소로부터 에너지를 얻는다. 기존 연구들은 장내 총열량 정보가 시상하부의 배고픔 뉴런(hunger neurons)을 억제함으로써 식욕을 조절한다는 사실을 밝혀왔으나, 특정 포도당에 특이적으로 반응하는 장-뇌 회로와 이에 반응하는 특정 뇌세포의 존재는 규명되지 않았다.
연구팀은 이번 연구를 통해 뇌의 기능에 필수적인 포도당을 감지하고 필요한 영양소에 대한 섭취 행동을 조절하는 ‘장-뇌 회로’를 밝혀내는 데 성공했다.
또한, 이 회로는 뇌의 ‘스트레스 반응 세포(CRF 뉴런*)’가 배고픔이나 외부 자극뿐만 아니라, 소장에 직접 유입된 특정 열량 영양소에 대해서도 초 단위로 반응하며, 특히 ‘포도당(D-glucose)’에 선택적으로 반응한다는 점을 처음으로 입증했다.
*CRF 뉴런: 우리 몸이 심리적·물리적 스트레스에 대응하는 핵심 생리 시스템은 시상하부-뇌하수체-부신 축(Hypothalamus-Pituitary-Adrenal Axis, HPA axis)이다. 이 축의 중심에는 시상하부에서 CRF(부신피질호르몬 방출인자)를 분비하는 뉴런이 있으며, 이들은 다양한 스트레스 자극에 반응해 코르티솔 분비를 유도하고, 생리 및 대사 균형을 유지하는 신경 내분비 조절의 중추로 알려져 있다.
연구팀은 실시간 뇌 속을 정밀하게 추적할 수 있는 광유전학 기반 신경 활성 조절 및 회로 추적 기법을 활용해서, 포도당(D-글루코스, L-글루코스,) 아미노산, 지방 등 다양한 영양소의 쥐의 소장 내 직접 주입하고 관찰했다.
그 결과, 뇌 시상하부의 ‘시상하부 시상핵(PVN)* 부위’에 있는 CRF 뉴런 중 D-글루코스(glucose) 포도당에만 선택적으로 반응하며, 다른 당류나 단백질·지방류에는 반응하지 않거나 반대 방향의 반응을 보이는 것을 확인했다. 이는 뇌가 장내 영양소가 유입 시 반응에 대해 단일 뇌세포 수준에서 어떤 방향성을 유도한다는 것을 처음 확인한 것을 의미한다.
* 시상하부 시상핵(paraventricular nucleus, PVN): 뇌의 시상하부(hypothalamus) 안에 있는 매우 중요한 신경핵(뉴런 무리)으로, 신체 항상성(몸의 균형 유지)을 조절하는 핵심 구조
또한, 연구팀은 소장의 포도당 감지 신호가 ‘척수신경’을 거쳐 뇌의 특정 부위(등쪽 외측 팔곁핵,parabrachial nucleus, PBNdl)을 통해 PVN의 CRF 뉴런으로 전달되는 특징적인 회로를 밝혀냈다. 반면, 아미노산이나 지방 등 기타 영양소는 미주신경(vagus nerve)이란 다른 통로로 뇌에 전달된다는 사실도 확인했다.
광유전학적 억제 실험에서도, 공복 상태의 생쥐에서 CRF 뉴런을 억제하면 동물은 더 이상 포도당을 선호하지 않게 됐으며, 이 회로가 영양소 선택에 있어 포도당 특이적 선호를 유도하는 데 필수적임이 드러났다.
이 연구는 서 교수가 뉴욕대(NYU) 재직 시절 초파리를 모델로, 장내 포도당(글루코스) 및 당을 선택적으로 감지하는 ‘DH44 뉴런’을 발견했던 점을 착안해, 포유류에서도 시상하부 뉴런이 포도당 특이적 반응에 있어 기능적 유사성을 보일 것이라는 가설에서 시작되었다.
이 가설을 입증하기 위해 서 교수 연구팀 김진은 박사(KAIST 박사 졸, 現 캘리포니아공과대학교 연수연구원)가 학위과정 중 생쥐 실험을 통해 배고픈 쥐는 장에 주입된 다양한 영양소 중 열량을 지닌 포도당을 선호하며, CRF 뉴런이 빠르고 특이적인 반응을 보인다는 사실을 확인했다.
또한, 같은 팀 정원교 연구원(KAIST 학사 졸, 現 캘리포니아공과대학교 박사과정)과 함께 실험과 모델링을 통해 CRF 뉴런의 중요성을 규명했고, 김신혜 박사는 협업을 통해 장-뇌 회로 중 특정 척추 신경세포가 장의 정보를 뇌로 전달 한다는 놀라운 발견을 입증했다.
김진은 박사와 김신혜 박사는 “이 연구는 ‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해내는가?’라는 단순하지만, 본질적인 질문에서 시작됐고, 이번 연구에서 장-뇌 연결 회로의 핵심 축인 척수신경의 역할을 규명하고 장내 특정 영양소를 감지한 후 이를 뇌에 전달하는 척수 기반 신경 회로가 우리 몸의 에너지 대사 조절과 항상성 유지에 핵심적일 것이라는 것을 밝혀냈다”고 말했다.
서성배 교수는 “이번 연구는 포도당에 특화된 장-뇌 신호 경로를 규명함으로써, 비만·당뇨병 등 대사 질환의 새로운 치료 표적을 제시할 수 있다”며 “향후 아미노산, 지방 등 다른 필수 영양소를 감지하는 유사 회로의 존재와 그 상호작용 메커니즘을 밝히는 연구로 확장될 예정”이라고 밝혔다.
우리 대학 김진은 박사, 김신혜 박사, 정원교 학생이 공동 제1 저자로 참여한 이번 연구의 결과는 국제 학술지 ‘뉴런(Neuron)’에 2025년 6월 20일 온라인 게재됐다.
※논문명: Encoding the glucose identity by discrete hypothalamic neurons via the gut-brain axis
※DOI: https://doi.org/10.1016/j.neuron.2025.05.024
이번 연구는 삼성미래기술육성사업, 한국연구재단 리더과제, 포스코 청암재단 사이언스 펠로십, 아산재단 의생명과학 장학사업, 기초과학연구원, KAIST KAIX 사업의 지원을 통해 수행됐다.
2025.07.09 조회수 1176
뇌는 포도당을 구별한다..비만·당뇨 치료의 단서 찾아
‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해낼까?’ 우리 대학 연구진은 이 질문에서 출발해, 뇌가 단순히 총열량(칼로리)을 감지하는 수준을 넘어 특정 영양소, 특히 포도당을 선택적으로 인식할 수 있다는 사실을 입증했다. 이번 연구는 향후 식욕 조절 및 대사성 질환 치료 전략에 새로운 패러다임을 제시할 수 있을 것으로 기대된다.
우리 대학 생명과학과 서성배 교수 연구팀이 바이오및뇌공학과 박영균 교수팀, 생명과학과 이승희 교수팀, 뉴욕 알버트 아인슈타인 의과대학과의 협력을 통해, 배고픔 상태에서 포도당이 결핍된 동물이 장내의 포도당을 선택적으로 인식하고 선호하도록 유도하는 장-뇌 회로의 존재를 규명했다고 9일 밝혔다.
생물은 당, 단백질, 지방 등 다양한 영양소로부터 에너지를 얻는다. 기존 연구들은 장내 총열량 정보가 시상하부의 배고픔 뉴런(hunger neurons)을 억제함으로써 식욕을 조절한다는 사실을 밝혀왔으나, 특정 포도당에 특이적으로 반응하는 장-뇌 회로와 이에 반응하는 특정 뇌세포의 존재는 규명되지 않았다.
연구팀은 이번 연구를 통해 뇌의 기능에 필수적인 포도당을 감지하고 필요한 영양소에 대한 섭취 행동을 조절하는 ‘장-뇌 회로’를 밝혀내는 데 성공했다.
또한, 이 회로는 뇌의 ‘스트레스 반응 세포(CRF 뉴런*)’가 배고픔이나 외부 자극뿐만 아니라, 소장에 직접 유입된 특정 열량 영양소에 대해서도 초 단위로 반응하며, 특히 ‘포도당(D-glucose)’에 선택적으로 반응한다는 점을 처음으로 입증했다.
*CRF 뉴런: 우리 몸이 심리적·물리적 스트레스에 대응하는 핵심 생리 시스템은 시상하부-뇌하수체-부신 축(Hypothalamus-Pituitary-Adrenal Axis, HPA axis)이다. 이 축의 중심에는 시상하부에서 CRF(부신피질호르몬 방출인자)를 분비하는 뉴런이 있으며, 이들은 다양한 스트레스 자극에 반응해 코르티솔 분비를 유도하고, 생리 및 대사 균형을 유지하는 신경 내분비 조절의 중추로 알려져 있다.
연구팀은 실시간 뇌 속을 정밀하게 추적할 수 있는 광유전학 기반 신경 활성 조절 및 회로 추적 기법을 활용해서, 포도당(D-글루코스, L-글루코스,) 아미노산, 지방 등 다양한 영양소의 쥐의 소장 내 직접 주입하고 관찰했다.
그 결과, 뇌 시상하부의 ‘시상하부 시상핵(PVN)* 부위’에 있는 CRF 뉴런 중 D-글루코스(glucose) 포도당에만 선택적으로 반응하며, 다른 당류나 단백질·지방류에는 반응하지 않거나 반대 방향의 반응을 보이는 것을 확인했다. 이는 뇌가 장내 영양소가 유입 시 반응에 대해 단일 뇌세포 수준에서 어떤 방향성을 유도한다는 것을 처음 확인한 것을 의미한다.
* 시상하부 시상핵(paraventricular nucleus, PVN): 뇌의 시상하부(hypothalamus) 안에 있는 매우 중요한 신경핵(뉴런 무리)으로, 신체 항상성(몸의 균형 유지)을 조절하는 핵심 구조
또한, 연구팀은 소장의 포도당 감지 신호가 ‘척수신경’을 거쳐 뇌의 특정 부위(등쪽 외측 팔곁핵,parabrachial nucleus, PBNdl)을 통해 PVN의 CRF 뉴런으로 전달되는 특징적인 회로를 밝혀냈다. 반면, 아미노산이나 지방 등 기타 영양소는 미주신경(vagus nerve)이란 다른 통로로 뇌에 전달된다는 사실도 확인했다.
광유전학적 억제 실험에서도, 공복 상태의 생쥐에서 CRF 뉴런을 억제하면 동물은 더 이상 포도당을 선호하지 않게 됐으며, 이 회로가 영양소 선택에 있어 포도당 특이적 선호를 유도하는 데 필수적임이 드러났다.
이 연구는 서 교수가 뉴욕대(NYU) 재직 시절 초파리를 모델로, 장내 포도당(글루코스) 및 당을 선택적으로 감지하는 ‘DH44 뉴런’을 발견했던 점을 착안해, 포유류에서도 시상하부 뉴런이 포도당 특이적 반응에 있어 기능적 유사성을 보일 것이라는 가설에서 시작되었다.
이 가설을 입증하기 위해 서 교수 연구팀 김진은 박사(KAIST 박사 졸, 現 캘리포니아공과대학교 연수연구원)가 학위과정 중 생쥐 실험을 통해 배고픈 쥐는 장에 주입된 다양한 영양소 중 열량을 지닌 포도당을 선호하며, CRF 뉴런이 빠르고 특이적인 반응을 보인다는 사실을 확인했다.
또한, 같은 팀 정원교 연구원(KAIST 학사 졸, 現 캘리포니아공과대학교 박사과정)과 함께 실험과 모델링을 통해 CRF 뉴런의 중요성을 규명했고, 김신혜 박사는 협업을 통해 장-뇌 회로 중 특정 척추 신경세포가 장의 정보를 뇌로 전달 한다는 놀라운 발견을 입증했다.
김진은 박사와 김신혜 박사는 “이 연구는 ‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해내는가?’라는 단순하지만, 본질적인 질문에서 시작됐고, 이번 연구에서 장-뇌 연결 회로의 핵심 축인 척수신경의 역할을 규명하고 장내 특정 영양소를 감지한 후 이를 뇌에 전달하는 척수 기반 신경 회로가 우리 몸의 에너지 대사 조절과 항상성 유지에 핵심적일 것이라는 것을 밝혀냈다”고 말했다.
서성배 교수는 “이번 연구는 포도당에 특화된 장-뇌 신호 경로를 규명함으로써, 비만·당뇨병 등 대사 질환의 새로운 치료 표적을 제시할 수 있다”며 “향후 아미노산, 지방 등 다른 필수 영양소를 감지하는 유사 회로의 존재와 그 상호작용 메커니즘을 밝히는 연구로 확장될 예정”이라고 밝혔다.
우리 대학 김진은 박사, 김신혜 박사, 정원교 학생이 공동 제1 저자로 참여한 이번 연구의 결과는 국제 학술지 ‘뉴런(Neuron)’에 2025년 6월 20일 온라인 게재됐다.
※논문명: Encoding the glucose identity by discrete hypothalamic neurons via the gut-brain axis
※DOI: https://doi.org/10.1016/j.neuron.2025.05.024
이번 연구는 삼성미래기술육성사업, 한국연구재단 리더과제, 포스코 청암재단 사이언스 펠로십, 아산재단 의생명과학 장학사업, 기초과학연구원, KAIST KAIX 사업의 지원을 통해 수행됐다.
2025.07.09 조회수 1176 부작용·내성 극복한 신개념 칸디다증 치료제 개발
칸디다증은 곰팡이균(진균)의 일종인 칸디다(Candida)가 혈액을 통해 전신으로 퍼지며 장기 손상과 패혈증을 유발할 수 있는 치명적인 감염 질환이다. 최근 면역 저하 치료, 장기 이식, 의료기기 사용 등이 증가함에 따라 칸디다증 발병이 급증하고 있다. 한국 연구진이 기존 항진균제와 달리, 칸디다균에만 선택적으로 작용해 높은 치료 효능과 낮은 부작용을 동시에 갖춘 차세대 치료제를 개발하는데 성공했다.
우리 대학 생명과학과 정현정 교수 연구팀이 서울아산병원 정용필 교수팀과의 협력을 통해, 칸디다 세포벽의 두 핵심 효소를 동시에 저해하는 유전자 기반 나노치료제(FTNx)를 개발했다고 8일 밝혔다.
현재 사용 중인 칸디다의 항진균제들은 표적 선택성이 낮아 인체 세포에도 영향을 미칠 수 있으며, 이에 내성을 가지는 새로운 균의 출현으로 인해 치료 효과가 점차 떨어지고 있다. 특히 면역력이 저하된 환자들에게는 감염의 진행이 빠르고 예후도 좋지 않아, 기존 치료제의 한계를 극복할 수 있는 새로운 치료법의 개발이 시급한 상황이다.
이에 연구팀이 개발한 치료제는 전신 투여가 가능하며, 유전자 억제 기술과 나노소재 기술을 융합함으로써 기존 화합물 기반의 약물들이 가지는 구조적 한계를 효과적으로 극복하고, 칸디다균에만 선택적으로 치료하는데 성공했다.
연구팀은 칸디다라는 곰팡이균의 세포벽을 만드는 데 중요한 두 가지 효소 — β‑1,3‑글루칸 합성효소(FKS1)와 키틴 합성효소(CHS3)를 동시에 표적하는 짧은 DNA 조각(antisense oligonucleotide, ASO)을 탑재한 금 나노입자 기반의 복합체를 제작했다.
여기에 칸디다 세포벽의 특정 당지질 구조(당과 지방이 결합된 구조)와 결합하는 표면 코팅 기술을 적용하여 표적유도장치를 장착함으로써, 인체 세포에는 아예 전달되지 않고 칸디다에만 선택적으로 작용하는 정밀 타겟팅 효과를 구현하는 데 성공했다.
이 복합체는 칸디다 세포 내로 진입한 후, FKS1 및 CHS3의 유전자가 만들어내는 mRNA를 잘라버려서 번역을 억제해 세포벽 성분인 β‑1,3‑글루칸과 키틴의 합성을 동시에 차단한다. 이로 인해 칸디다 세포벽은 구조적 안정성을 유지하지 못하고 붕괴되며, 세균의 생존과 증식이 억제된다.
실제로 쥐에서 전신 칸디다증 모델 실험을 통해 치료 효과를 검증한 결과, 치료군에서 칸디다의 장기 내 균 수 감소, 면역 반응 정상화, 그리고 생존율의 유의미한 증가가 관찰됐다.
연구를 주도한 정현정 교수는 “이번 연구는 기존 치료제가 인체 독성과 약제내성 확산 문제를 극복하는 방법을 제시하며, 유전자 치료의 전신 감염 적용 가능성을 보여주는 중요한 전환점”이라며, “향후 임상 적용을 위한 투여 방식 최적화 및 독성 검증 연구를 지속적으로 진행할 계획”이라고 밝혔다.
해당 연구는 생명과학과 정주연 학생 및 서울아산병원 홍윤경 박사가 제1 저자로 참여했으며, 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 7월 1일 자로 게재됐다.
※ 논문명 : Effective treatment of systemic candidiasis by synergistic targeting of cell wall synthesis
※ DOI : 10.1038/s41467-025-60684-7
이번 연구는 보건복지부 및 한국연구재단의 지원을 받아 수행됐다.
2025.07.08 조회수 1592
부작용·내성 극복한 신개념 칸디다증 치료제 개발
칸디다증은 곰팡이균(진균)의 일종인 칸디다(Candida)가 혈액을 통해 전신으로 퍼지며 장기 손상과 패혈증을 유발할 수 있는 치명적인 감염 질환이다. 최근 면역 저하 치료, 장기 이식, 의료기기 사용 등이 증가함에 따라 칸디다증 발병이 급증하고 있다. 한국 연구진이 기존 항진균제와 달리, 칸디다균에만 선택적으로 작용해 높은 치료 효능과 낮은 부작용을 동시에 갖춘 차세대 치료제를 개발하는데 성공했다.
우리 대학 생명과학과 정현정 교수 연구팀이 서울아산병원 정용필 교수팀과의 협력을 통해, 칸디다 세포벽의 두 핵심 효소를 동시에 저해하는 유전자 기반 나노치료제(FTNx)를 개발했다고 8일 밝혔다.
현재 사용 중인 칸디다의 항진균제들은 표적 선택성이 낮아 인체 세포에도 영향을 미칠 수 있으며, 이에 내성을 가지는 새로운 균의 출현으로 인해 치료 효과가 점차 떨어지고 있다. 특히 면역력이 저하된 환자들에게는 감염의 진행이 빠르고 예후도 좋지 않아, 기존 치료제의 한계를 극복할 수 있는 새로운 치료법의 개발이 시급한 상황이다.
이에 연구팀이 개발한 치료제는 전신 투여가 가능하며, 유전자 억제 기술과 나노소재 기술을 융합함으로써 기존 화합물 기반의 약물들이 가지는 구조적 한계를 효과적으로 극복하고, 칸디다균에만 선택적으로 치료하는데 성공했다.
연구팀은 칸디다라는 곰팡이균의 세포벽을 만드는 데 중요한 두 가지 효소 — β‑1,3‑글루칸 합성효소(FKS1)와 키틴 합성효소(CHS3)를 동시에 표적하는 짧은 DNA 조각(antisense oligonucleotide, ASO)을 탑재한 금 나노입자 기반의 복합체를 제작했다.
여기에 칸디다 세포벽의 특정 당지질 구조(당과 지방이 결합된 구조)와 결합하는 표면 코팅 기술을 적용하여 표적유도장치를 장착함으로써, 인체 세포에는 아예 전달되지 않고 칸디다에만 선택적으로 작용하는 정밀 타겟팅 효과를 구현하는 데 성공했다.
이 복합체는 칸디다 세포 내로 진입한 후, FKS1 및 CHS3의 유전자가 만들어내는 mRNA를 잘라버려서 번역을 억제해 세포벽 성분인 β‑1,3‑글루칸과 키틴의 합성을 동시에 차단한다. 이로 인해 칸디다 세포벽은 구조적 안정성을 유지하지 못하고 붕괴되며, 세균의 생존과 증식이 억제된다.
실제로 쥐에서 전신 칸디다증 모델 실험을 통해 치료 효과를 검증한 결과, 치료군에서 칸디다의 장기 내 균 수 감소, 면역 반응 정상화, 그리고 생존율의 유의미한 증가가 관찰됐다.
연구를 주도한 정현정 교수는 “이번 연구는 기존 치료제가 인체 독성과 약제내성 확산 문제를 극복하는 방법을 제시하며, 유전자 치료의 전신 감염 적용 가능성을 보여주는 중요한 전환점”이라며, “향후 임상 적용을 위한 투여 방식 최적화 및 독성 검증 연구를 지속적으로 진행할 계획”이라고 밝혔다.
해당 연구는 생명과학과 정주연 학생 및 서울아산병원 홍윤경 박사가 제1 저자로 참여했으며, 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 7월 1일 자로 게재됐다.
※ 논문명 : Effective treatment of systemic candidiasis by synergistic targeting of cell wall synthesis
※ DOI : 10.1038/s41467-025-60684-7
이번 연구는 보건복지부 및 한국연구재단의 지원을 받아 수행됐다.
2025.07.08 조회수 1592 마이크로 OLED로 난치성 뇌질환 치료 '게임 체인저' 기술 제시
광유전학 기술은 빛에 반응하는 광 단백질이 발현된 뉴런에 특정 파장의 빛 자극을 통해 뉴런의 활성을 조절하는 기술로 다양한 뇌질환의 원인을 규명하며 난치성 뇌질환의 새로운 치료 방법을 개발할 가능성을 열고 있다. 이 기술은 인체의 뇌에 삽입하여 자극을 주는 의료 기기인 ‘뉴럴 프로브’를 통해 정확하게 자극하고 무른 뇌 조직의 손상을 최소화해야 한다. 이에 우리 연구진이 마이크로 OLED를 활용해 얇고 유연한 인체 삽입형 의료기기로 구현함으로써 뉴럴 프로브의 새로운 패러다임을 제시했다.
우리 대학 전기및전자공학부 최경철 교수와 이현주 연구팀이 공동 연구를 통해, 유연한 마이크로 OLED가 집적된 광유전학용 뉴럴 프로브 개발에 성공했다고 6일 밝혔다.
광유전학 연구에서 주요 기술은 광원의 빛을 뇌로 전달하는 방식으로 외부 광원으로부터의 깊은 뇌 영역까지 빛을 전달하기 위해 수십 년간 광섬유를 사용해 왔다. 하지만 단일 뉴런을 자극하기 위한 유연 광섬유, 초미세 광원 집적 뉴럴 프로브 등 관련 연구가 이뤄지고 있다.
연구팀은 마이크로 OLED는 높은 공간적 해상도와 유연성을 가져, 매우 작은 영역의 뉴런에서도 정확하게 빛을 조사할 수 있어 세밀한 뇌 회로 분석이 가능하고 동물의 움직임에 불편함을 주지 않으면서 부작용을 최소화하는 장점에 주목했다. 그뿐만 아니라, 미세한 파장 조절을 통해 정밀한 빛 조절이 가능하며 다중 자극을 통한 복잡한 뇌 기능 연구가 가능하다.
하지만, 체내 수분이나 물에 의해 전기적 특성이 쉽게 열화되기 때문에 생체 삽입형 전자장치로 활용되는데 한계가 있었고, 얇고 유연한 탐침 위 고해상도 집적 공정에 대한 세부적인 최적화도 필요했다.
공동연구팀은 수분과 산소가 많은 생체 내 환경에서 OLED의 구동 신뢰성을 높이며 생체 삽입 시 조직 손상을 최소화하고자, 산화알루미늄/파릴렌-C(Al2O3/parylene-C)로 구성된 초박막 유연 봉지막*을 얇은 탐침 형태인 260~600마이크로미터(μm) 너비로 패터닝해 생체친화성을 유지했다.
* 봉지막: 소자를 외부 환경요인인 산소와 물 분자로부터 완전히 차단하는 막 기술로 소자의 수명을 유지시키고 신뢰성을 줌
또한, 고해상도 마이크로 OLED를 집적함에 있어 전체 소자의 유연성과 생체친화성을 유지하기 위해, 봉지막과 동일한 생체친화 재료인 파릴렌-C(parylene-C)를 활용하였다. 아울러, 인접한 OLED 픽셀 간 전기적 간섭 현상을 제거하고 각 픽셀을 공간적으로 분리하기 위해 구조적 레이어인 ‘화소 정의막(pixel define layer)’을 도입함으로써, 8개의 마이크로 OLED를 독립적으로 개별 구동할 수 있도록 구현했다.
마지막으로, 소자 내 다중 박막층의 잔류 응력과 두께를 정밀하게 조절함으로써, 생체 내 환경에서도 소자의 유연성을 유지할 수 있도록 하였다. 이를 통해 외부 셔틀이나 바늘과 같은 보조 장치 없이도 단일 탐침만으로 휘어짐 없이 삽입이 가능하도록, 소자의 기계적 스트레스를 최적화해 설계했다.
결론적으로 연구팀은 채널로돕신2의 활성화에 적합한 470나노미터(nm) 파장에서 1밀리와트/제곱밀리미터(mW/mm2)이상의 광 파워 밀도를 가지는 즉, 광유전학 및 생체조직 자극 응용에서 상당히 높은 수준의 광출력을 가진 마이크로 OLED 집적 유연 뉴럴 프로브를 개발했다.
또한, 초박막 유연 봉지막은 2.66×10⁻⁵ g/m²/day의 낮은 수분 투습률을 보이며 소자 수명은 10년 이상 유지할 수 있고, 패릴렌-C(parylene-C)를 기반으로 생체 내 높은 봉지막 성능을 발휘하며, 전기적 간섭과 휨 이슈 없이 집적된 OLED의 개별 구동을 성공적으로 시연했다.
이번 연구를 주도한 최경철 교수 연구팀의 이소민 박사는 “고유연·고해상도의 마이크로 OLED를 얇은 유연 탐침 위에 집적하는 세부 공정 및 생체 적용성, 친화성 향상에 집중했다”며 “이번 연구는 기존 연구를 넘어 유연 프로브 형태에 최초로 개발해 보고된 사례로, 유연 OLED가 인체 삽입형 측정 및 치료 의료기기로서의 새로운 패러다임을 제시할 것으로 기대된다”고 말했다.
이번 연구는 전기및전자공학부 이소민 박사가 제1 저자로 나노 분야의 권위 있는 국제 학술지 `어드밴스드 펑셔널 머터리얼즈(Advanced Functional Materials, IF 18.5)'에 지난 3월 26일 字로 온라인 게재됐으며, 전면 표지 논문으로 이번 7월에 선정됐다.
※ 논문명: Advanced Micro-OLED Integration on Thin and Flexible Polymer Neural Probes for Targeted Optogenetic Stimulation
※ DOI: https://doi.org/10.1002/adfm.202420758
한편, 이번 연구는 과학기술정보통신부 한국연구재단의 전자약 기술개발사업(연구 과제명: 뇌인지-정서 향상 빛 자극 전자약의 핵심원천기술 개발 및 생체 적용가능성 검증)의 지원을 받아 수행됐다.
2025.07.07 조회수 1300
마이크로 OLED로 난치성 뇌질환 치료 '게임 체인저' 기술 제시
광유전학 기술은 빛에 반응하는 광 단백질이 발현된 뉴런에 특정 파장의 빛 자극을 통해 뉴런의 활성을 조절하는 기술로 다양한 뇌질환의 원인을 규명하며 난치성 뇌질환의 새로운 치료 방법을 개발할 가능성을 열고 있다. 이 기술은 인체의 뇌에 삽입하여 자극을 주는 의료 기기인 ‘뉴럴 프로브’를 통해 정확하게 자극하고 무른 뇌 조직의 손상을 최소화해야 한다. 이에 우리 연구진이 마이크로 OLED를 활용해 얇고 유연한 인체 삽입형 의료기기로 구현함으로써 뉴럴 프로브의 새로운 패러다임을 제시했다.
우리 대학 전기및전자공학부 최경철 교수와 이현주 연구팀이 공동 연구를 통해, 유연한 마이크로 OLED가 집적된 광유전학용 뉴럴 프로브 개발에 성공했다고 6일 밝혔다.
광유전학 연구에서 주요 기술은 광원의 빛을 뇌로 전달하는 방식으로 외부 광원으로부터의 깊은 뇌 영역까지 빛을 전달하기 위해 수십 년간 광섬유를 사용해 왔다. 하지만 단일 뉴런을 자극하기 위한 유연 광섬유, 초미세 광원 집적 뉴럴 프로브 등 관련 연구가 이뤄지고 있다.
연구팀은 마이크로 OLED는 높은 공간적 해상도와 유연성을 가져, 매우 작은 영역의 뉴런에서도 정확하게 빛을 조사할 수 있어 세밀한 뇌 회로 분석이 가능하고 동물의 움직임에 불편함을 주지 않으면서 부작용을 최소화하는 장점에 주목했다. 그뿐만 아니라, 미세한 파장 조절을 통해 정밀한 빛 조절이 가능하며 다중 자극을 통한 복잡한 뇌 기능 연구가 가능하다.
하지만, 체내 수분이나 물에 의해 전기적 특성이 쉽게 열화되기 때문에 생체 삽입형 전자장치로 활용되는데 한계가 있었고, 얇고 유연한 탐침 위 고해상도 집적 공정에 대한 세부적인 최적화도 필요했다.
공동연구팀은 수분과 산소가 많은 생체 내 환경에서 OLED의 구동 신뢰성을 높이며 생체 삽입 시 조직 손상을 최소화하고자, 산화알루미늄/파릴렌-C(Al2O3/parylene-C)로 구성된 초박막 유연 봉지막*을 얇은 탐침 형태인 260~600마이크로미터(μm) 너비로 패터닝해 생체친화성을 유지했다.
* 봉지막: 소자를 외부 환경요인인 산소와 물 분자로부터 완전히 차단하는 막 기술로 소자의 수명을 유지시키고 신뢰성을 줌
또한, 고해상도 마이크로 OLED를 집적함에 있어 전체 소자의 유연성과 생체친화성을 유지하기 위해, 봉지막과 동일한 생체친화 재료인 파릴렌-C(parylene-C)를 활용하였다. 아울러, 인접한 OLED 픽셀 간 전기적 간섭 현상을 제거하고 각 픽셀을 공간적으로 분리하기 위해 구조적 레이어인 ‘화소 정의막(pixel define layer)’을 도입함으로써, 8개의 마이크로 OLED를 독립적으로 개별 구동할 수 있도록 구현했다.
마지막으로, 소자 내 다중 박막층의 잔류 응력과 두께를 정밀하게 조절함으로써, 생체 내 환경에서도 소자의 유연성을 유지할 수 있도록 하였다. 이를 통해 외부 셔틀이나 바늘과 같은 보조 장치 없이도 단일 탐침만으로 휘어짐 없이 삽입이 가능하도록, 소자의 기계적 스트레스를 최적화해 설계했다.
결론적으로 연구팀은 채널로돕신2의 활성화에 적합한 470나노미터(nm) 파장에서 1밀리와트/제곱밀리미터(mW/mm2)이상의 광 파워 밀도를 가지는 즉, 광유전학 및 생체조직 자극 응용에서 상당히 높은 수준의 광출력을 가진 마이크로 OLED 집적 유연 뉴럴 프로브를 개발했다.
또한, 초박막 유연 봉지막은 2.66×10⁻⁵ g/m²/day의 낮은 수분 투습률을 보이며 소자 수명은 10년 이상 유지할 수 있고, 패릴렌-C(parylene-C)를 기반으로 생체 내 높은 봉지막 성능을 발휘하며, 전기적 간섭과 휨 이슈 없이 집적된 OLED의 개별 구동을 성공적으로 시연했다.
이번 연구를 주도한 최경철 교수 연구팀의 이소민 박사는 “고유연·고해상도의 마이크로 OLED를 얇은 유연 탐침 위에 집적하는 세부 공정 및 생체 적용성, 친화성 향상에 집중했다”며 “이번 연구는 기존 연구를 넘어 유연 프로브 형태에 최초로 개발해 보고된 사례로, 유연 OLED가 인체 삽입형 측정 및 치료 의료기기로서의 새로운 패러다임을 제시할 것으로 기대된다”고 말했다.
이번 연구는 전기및전자공학부 이소민 박사가 제1 저자로 나노 분야의 권위 있는 국제 학술지 `어드밴스드 펑셔널 머터리얼즈(Advanced Functional Materials, IF 18.5)'에 지난 3월 26일 字로 온라인 게재됐으며, 전면 표지 논문으로 이번 7월에 선정됐다.
※ 논문명: Advanced Micro-OLED Integration on Thin and Flexible Polymer Neural Probes for Targeted Optogenetic Stimulation
※ DOI: https://doi.org/10.1002/adfm.202420758
한편, 이번 연구는 과학기술정보통신부 한국연구재단의 전자약 기술개발사업(연구 과제명: 뇌인지-정서 향상 빛 자극 전자약의 핵심원천기술 개발 및 생체 적용가능성 검증)의 지원을 받아 수행됐다.
2025.07.07 조회수 1300 정확도·효율성 높인 생명과학 데이터 분석 도구 'scICE' 개발
기존보다 최대 30배 빠른 속도로 안정적인 결과만을 자동으로 선별하여 대규모 생명과학 데이터 분석의 정확도와 효율성을 획기적으로 향상하는 방법이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀은 세포 분류(클러스터링) 결과의 안정성을 수학적으로 평가해 불안정한 결과를 걸러내는 새로운 분석 도구인 ‘scICE(single-cell Inconsistency Clustering Estimator)’를 개발했다.
단일세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석법(scRNA-seq)은 현대 생명과학 연구의 핵심 도구로 자리 잡았다. 이 과정에서 클러스터링은 유사한 유전자 발현 특성을 가진 세포들을 그룹으로 묶는 작업으로, 암세포와 정상 세포를 구분하거나 새로운 세포 유형을 발견하는 데 중요한 첫걸음이다. 하지만 클러스터링 알고리즘은 무작위로 세포를 분류해 같은 데이터를 분석해도 결과가 달라지는 경우가 많다.
제1 저자인 김현 선임연구원은 “일부 정상 세포가 암세포로 잘못 분류되거나 중요한 세포 유형이 누락되는 불안정성으로 인해 연구자들은 다시 분석하거나 복잡한 계산을 통해 신뢰도가 높은 결과를 선별해야 했다”며, “기존 방법들은 분석을 여러 번 반복해 합의된 결과를 도출하는 방식으로, 계산량이 방대하고 수만 개 이상의 세포가 포함된 대용량 데이터에는 적합하지 않다”고 말했다.
연구팀이 개발한 scICE는 한 번의 분석만으로도 얼마나 일관성 있게 결과가 도출됐는지를 수학적으로 평가한다. 새로 도입한 ‘불일치 계수(Inconsistency Coefficient, IC)’를 통해 많은 계산량이 요구되는 연산 없이도 클러스터 간 안정성을 정량적으로 판단할 수 있다. 모든 세포를 일일이 비교하던 기존 방식과 달리, 불일치 계수를 활용한 안정성 평가는 클러스터 구조 간 유사성만 평가해 비교 대상을 획기적으로 줄일 수 있어 분석 시간을 크게 단축한다.
연구팀은 뇌, 폐, 혈액 등 다양한 조직에서 수집된 48개의 실제 및 모의 scRNA-seq 데이터에 scICE를 적용하여 그 유효성을 입증했다. 그 결과, 기존 분석 결과 중 약 3분의 2는 통계적으로 불안정하며 신뢰하기 어렵다는 사실을 밝혀냈다. 반면, scICE는 신뢰할 수 있는 결과만을 선별해 연구자의 시간과 계산 자원을 절약하면서도 정확도를 한층 높였다.
또한, scICE는 일반적인 클러스터링으로는 놓치기 쉬운 희귀한 세포 유형을 효과적으로 탐지했다. 실제로 일부 데이터에서 찾기 어려웠던 희귀 면역세포들을 scICE 기반의 서브클러스터링을 통해 안정적으로 식별해냈다. 예를 들어, 매우 복잡한 분석을 거쳐야만 식별할 수 있던 여러 대식세포(macrophage) 아형들을 훨씬 간편하고 정확하게 구분해냈다.
scICE에 관심 있는 연구자는 누구나 깃허브 사이트(https://github.com/Mathbiomed/scICE)를 통해 쉽게 활용해볼 수 있다.
김재경 교수는 “이번 연구는 수학적 아이디어가 어떻게 생명과학의 핵심 문제를 해결하고 분석 과정을 혁신할 수 있는지를 보여주는 성과”라며, “클러스터링 신뢰도의 중요성이 간과되어 온 측면이 있는데, 이번 기회로 scICE가 생명과학 분야에서 신뢰도 높은 데이터 해석을 가능케 하는 표준 도구로 자리 잡기를 기대한다”고 전했다.
우리 대학 박종은 교수 연구팀, POSTECH 김종경 교수 연구팀, 고려대 서민석 교수 연구팀과 공동으로 참여한 이번 연구결과는 세계적인 국제학술지 네이처 커뮤니케이션즈(Nature Communications, IF 14.7)에 7월 2일 온라인 게재됐다.
2025.07.03 조회수 1437
정확도·효율성 높인 생명과학 데이터 분석 도구 'scICE' 개발
기존보다 최대 30배 빠른 속도로 안정적인 결과만을 자동으로 선별하여 대규모 생명과학 데이터 분석의 정확도와 효율성을 획기적으로 향상하는 방법이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀은 세포 분류(클러스터링) 결과의 안정성을 수학적으로 평가해 불안정한 결과를 걸러내는 새로운 분석 도구인 ‘scICE(single-cell Inconsistency Clustering Estimator)’를 개발했다.
단일세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석법(scRNA-seq)은 현대 생명과학 연구의 핵심 도구로 자리 잡았다. 이 과정에서 클러스터링은 유사한 유전자 발현 특성을 가진 세포들을 그룹으로 묶는 작업으로, 암세포와 정상 세포를 구분하거나 새로운 세포 유형을 발견하는 데 중요한 첫걸음이다. 하지만 클러스터링 알고리즘은 무작위로 세포를 분류해 같은 데이터를 분석해도 결과가 달라지는 경우가 많다.
제1 저자인 김현 선임연구원은 “일부 정상 세포가 암세포로 잘못 분류되거나 중요한 세포 유형이 누락되는 불안정성으로 인해 연구자들은 다시 분석하거나 복잡한 계산을 통해 신뢰도가 높은 결과를 선별해야 했다”며, “기존 방법들은 분석을 여러 번 반복해 합의된 결과를 도출하는 방식으로, 계산량이 방대하고 수만 개 이상의 세포가 포함된 대용량 데이터에는 적합하지 않다”고 말했다.
연구팀이 개발한 scICE는 한 번의 분석만으로도 얼마나 일관성 있게 결과가 도출됐는지를 수학적으로 평가한다. 새로 도입한 ‘불일치 계수(Inconsistency Coefficient, IC)’를 통해 많은 계산량이 요구되는 연산 없이도 클러스터 간 안정성을 정량적으로 판단할 수 있다. 모든 세포를 일일이 비교하던 기존 방식과 달리, 불일치 계수를 활용한 안정성 평가는 클러스터 구조 간 유사성만 평가해 비교 대상을 획기적으로 줄일 수 있어 분석 시간을 크게 단축한다.
연구팀은 뇌, 폐, 혈액 등 다양한 조직에서 수집된 48개의 실제 및 모의 scRNA-seq 데이터에 scICE를 적용하여 그 유효성을 입증했다. 그 결과, 기존 분석 결과 중 약 3분의 2는 통계적으로 불안정하며 신뢰하기 어렵다는 사실을 밝혀냈다. 반면, scICE는 신뢰할 수 있는 결과만을 선별해 연구자의 시간과 계산 자원을 절약하면서도 정확도를 한층 높였다.
또한, scICE는 일반적인 클러스터링으로는 놓치기 쉬운 희귀한 세포 유형을 효과적으로 탐지했다. 실제로 일부 데이터에서 찾기 어려웠던 희귀 면역세포들을 scICE 기반의 서브클러스터링을 통해 안정적으로 식별해냈다. 예를 들어, 매우 복잡한 분석을 거쳐야만 식별할 수 있던 여러 대식세포(macrophage) 아형들을 훨씬 간편하고 정확하게 구분해냈다.
scICE에 관심 있는 연구자는 누구나 깃허브 사이트(https://github.com/Mathbiomed/scICE)를 통해 쉽게 활용해볼 수 있다.
김재경 교수는 “이번 연구는 수학적 아이디어가 어떻게 생명과학의 핵심 문제를 해결하고 분석 과정을 혁신할 수 있는지를 보여주는 성과”라며, “클러스터링 신뢰도의 중요성이 간과되어 온 측면이 있는데, 이번 기회로 scICE가 생명과학 분야에서 신뢰도 높은 데이터 해석을 가능케 하는 표준 도구로 자리 잡기를 기대한다”고 전했다.
우리 대학 박종은 교수 연구팀, POSTECH 김종경 교수 연구팀, 고려대 서민석 교수 연구팀과 공동으로 참여한 이번 연구결과는 세계적인 국제학술지 네이처 커뮤니케이션즈(Nature Communications, IF 14.7)에 7월 2일 온라인 게재됐다.
2025.07.03 조회수 1437