연구

< (왼쪽부터) 생명과학과 정현정 교수, 양승주 석박사통합과정 >
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
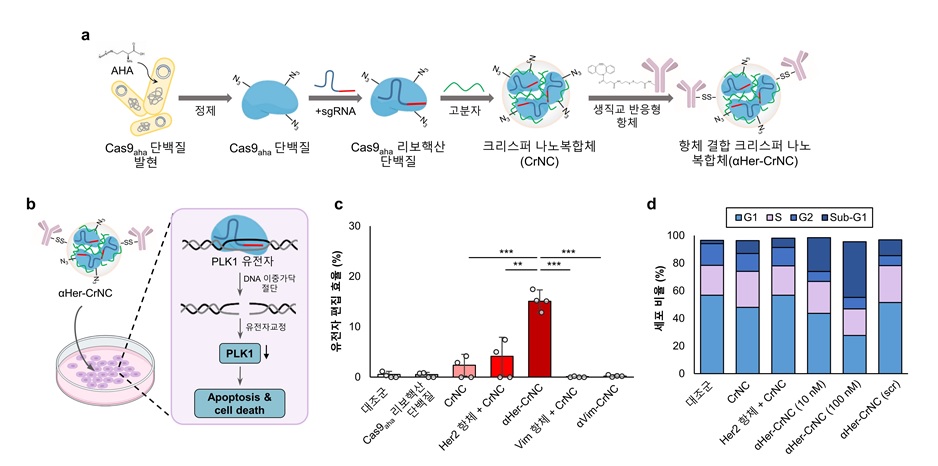
< 그림 1. 생직교반응 기반 표적치료제인 항체 결합 크리스퍼 나노복합체 ⍺Her-CrNC 제조 및 기능 (a), ⍺Her-CrNC에 의한 유전자 교정 및 항암효과(b)를 나타낸 모식도, ⍺Her-CrNC의 유전자 편집 효율(c), 암세포주기 분석(d) 결과. >
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
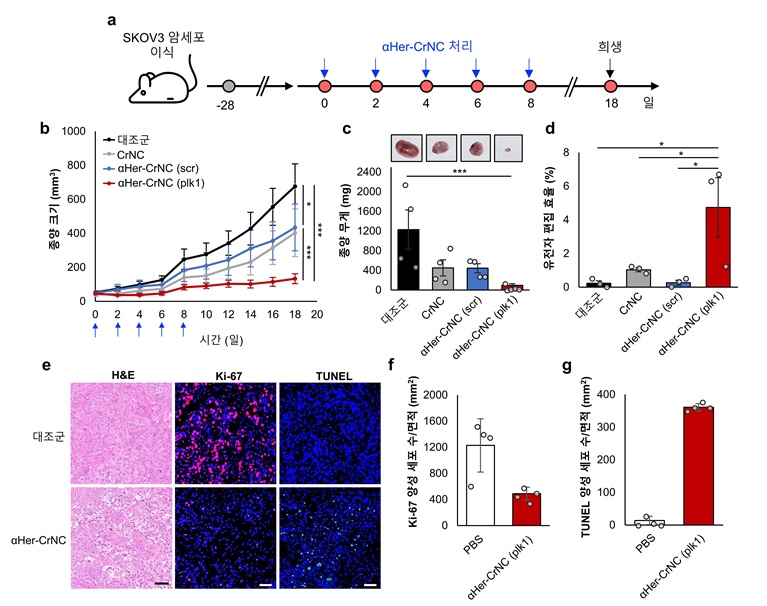
< 그림 2. 쥐의 난소암(SKOV3) 모델에서 ⍺Her-CrNC에 의한 항암 효능 검증 실험 모식도 (a), ⍺Her-CrNC의 쥐 투여 후 경과 일수에 따른 종양 크기(b) 및 종양 무게(c) 변화 관측 결과. 난소암의 표적 유전자 PLK1 교정 효율(d) 결과. ⍺Her-CrNC의 투여 후 난소암의 조직학적 분석 (e,f,g) 결과 >
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
-
연구 세계 최초 유전자 가위로 원하는 RNA ‘콕’ 집어 변형 성공
RNA 유전자 가위는 코로나바이러스와 같은 바이러스의 RNA를 제거하여 감염을 억제하거나 질병 원인 유전자 발현을 조절할 수 있어, 부작용이 적은 차세대 유전자 치료제로 크게 주목받고 있다. 우리 연구진은 세포 내 존재하는 수많은 RNA(유전 정보를 전달하고 단백질을 만드는 데 중요한 역할을 하는 분자) 중에서 원하는 RNA만을 정확하게 찾아서 아세틸화(화학 변형)할 수 있는 기술을 세계 최초로 개발했고, 이는 RNA 기반 치료의 새 장을 열 수 있는 핵심 기술이 될 것으로 기대된다. 우리 대학 생명과학과 허원도 석좌교수 연구팀이 최근 유전자 조절 및 RNA 기반 기술 분야에서 각광받는 RNA 유전자 가위 시스템(CRISPR-Cas13)을 이용해 우리 몸 안의 특정한 RNA에 아세틸화를 가할 수 있는 혁신적 기술을 개발했다고 10일 밝혔다. RNA는 ‘화학 변형(chemical modification)’이란 과정을 통해 그 특성과 기능이 변화할 수 있
2025-06-10 -
연구 교모세포종 암의 씨앗‘전암 세포’첫 규명·정조준했다
교모세포종(Glioblastoma)은 가장 공격적이고 예후가 나쁜 대표적 악성 뇌종양으로, 광범위한 뇌 절제술을 포함한 표준 치료 후에도 1년 이내 대부분 재발하며 생존률이 매우 낮은 치명적인 질환이다. KAIST 연구진이 교모세포종에 암세포로 발전하는 가능성을 가진 전암세포가 있다는 것을 최초로 밝혔다. 우리 대학 의과학대학원 이정호 교수 연구팀은 세계 최초로 교모세포종의 진화와 재발 및 치료 저항성의 근원이 되는 ‘전암세포(Precancerous cell)’를 규명했다. 이정호 교수 연구팀은 2018년 교모세포종이 뇌 깊은 곳에 있는 돌연변이 줄기세포로부터 시작된다는 것을 최초로 밝혀내며 ‘네이쳐(Nature)’지에 게재한 바 있다. 이번 연구에서는 암의 씨앗과 같은 ‘전암 세포’가 어디서 유래하는지, 즉, 돌연변이 기원 세포가 어떻게 분화되는지를 규명하였고 이 전암 세포가 종양 내 세부 유형의 암세포들을
2025-04-21 -
연구 암세포 사멸과 연관된 대사를 관장하는 최상위인자 규명
우리 대학 생명과학과 강석조 교수 연구팀이 3차원 종양미세환경에서 성장한 암세포에서 유래한 케모카인(Chemokine) CXCL5가 암세포의 대사 리프로그래밍(reprogramming)을 조절하며 이를 통하여 지질 과산화물의 축적으로 인해 유도되는 세포 사멸인 페롭토시스(ferroptosis)에 대한 저항성을 획득한다고 7일 밝혔다. CXCL5는 수용체인 CXCR2와의 결합을 통해 세포의 이동(migration) 및 침습(invasion)을 촉진하는 역할을 하는 케모카인으로, 종양미세환경에서 면역세포들의 침윤에 관여함이 알려져왔다. CXCL5는 여러 암종에서 발현이 증가되어 있음이 보고되었으나 실제 3차원 종양미세환경 내 암세포에서 유래한 CXCL5의 역할에 대해서는 밝혀진 바가 없다. 강 교수 연구팀은 세포외기질의 침착과 대식세포의 침투가 특징적인 암 미세환경을 모사하는 3차원 배양 시스템을 구축해 세포 간, 세포와 세포외기질 간 상호작용 뿐 아니라 종양미세환경 내 암세
2025-03-07 -
연구 암세포 발생 순간 되돌리는 분자스위치 발견
조광현 교수 연구팀은 암세포를 죽이지 않고 그 상태만을 변환시켜 정상 세포와 유사한 상태로 되돌리는 암 가역 치료 원천기술을 개발한 바 있다. 이번에는 정상세포가 암세포로 변화되는 순간의 유전자 네트워크에 암 가역화를 유도할 수 있는 분자스위치가 숨겨져 있음을 최초로 밝히는데 성공하였다. 우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 정상세포에서 암세포로 변화하는 순간의 임계 전이(臨界轉移, critical transition) 현상을 포착하고 이를 분석해 암세포를 다시 정상세포로 되돌릴 수 있는 분자스위치를 발굴하는 기술 개발에 성공했다고 5일 밝혔다. 임계 전이란 물이 섭씨 100도에서 증기로 변하는 것처럼 특정 시점에 갑작스러운 상태변화가 일어나는 현상을 말한다. 정상세포가 유전적, 후성유전적 변화의 축적으로 인해 특정 시점에 암세포로 변화되는 과정에도 이러한 임계 전이 현상이 나타난다. 연구팀은 암 발생 과정에서 정상세포가 암세포로 전환되기 직전, 정상세포와
2025-02-05 -
연구 암세포를 정상세포로 되돌려 치료하는 원천기술 개발
지금까지 다양한 항암 치료 기술이 개발됐음에도 현재 시행되고 있는 모든 항암치료의 공통점은 암세포를 사멸시켜서 치료하는 것을 목표로 하고 있다. 이로 인해 암세포가 내성을 획득해 재발하거나 정상세포까지 사멸시켜 큰 부작용을 유발하는 등 근본적인 한계를 지니고 있다. 우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암세포를 죽이지 않고 그 상태만을 변환시켜 정상 대장세포와 유사한 상태로 되돌림으로써 부작용 없이 치료할 수 있는 대장암 가역 치료를 위한 원천기술을 개발하였다고 22일 밝혔다. 연구팀은 정상세포의 암화 과정에서 정상적인 세포분화 궤적을 역행한다는 관찰 결과에 주목하고, 이를 기반으로 정상세포의 분화궤적에 대한 유전자네트워크의 디지털트윈을 제작하는 기술을 개발했다. 그리고 이를 시뮬레이션 분석해 정상세포 분화를 유도하는 마스터 분자스위치를 체계적으로 탐색해 발굴한 뒤 대장암세포에 적용했을 때 대장암세포의 상태가 정상화된다는 것을 분자세포 실험과 동물실험
2024-12-23